
3221
.pdfХладон-22 (R22). По термодинамическим свойствам R22 даже несколько превосходит аммиак. Наряду с этим, как и все фреоны, он почти безопасен и безвреден. Меньшее отношение давлений рк/р0, чем у аммиака, и более низкие температуры после сжатия в компрессоре (до 100 °С) позволяют расширить область применения одноступенчатого сжатия на R22 до – 40 
–45 °С. Двухступенчатое сжатие на R22 обеспечивает t0 до – 70 °С, а с поджимающим эжектором (вместо третьей ступени) – до
–100 °С.
R22 начинает постепенно вытеснять аммиак и на крупных установках.
Фреон-502 (R502). R502 – это азеотропная смесь R22 и R115 (48,8 и 51,2 %). По свойствам близок к R22, но имеет еще более низкие температуры сжатия. Позволяет расширить диапазон применения одноступенчатых машин до t0 = – 50 °С (при tк = 45 °С). Эффективность цикла еще выше, чем у R22. Особенно эффективен в машинах с бессальниковыми и герметичными компрессорами. Из-за повышенной стоимости R502 пока еще находит ограниченное применение, но это – очень перспективный хладагент.
R13B1. Имеет наиболее широкий диапазон возможности применения одноступенчатого сжатия – до t0 = – 60 °С, температура конденсации – до 35 °С. Наиболее перспективный хладагент среднего давления, но пока еще находит ограниченное применение из-за высокой стоимости.
Хладагенты высокого давления R13, R14 и др. Эта группа хладагентов характеризуется тем, что критическая температура их ниже 30 °С, т. е. при tк = 30 °С и более они не конденсируются. Поэтому хладагенты высокого давления применяют только в нижней ветви каскадных установок, охлаждая конденсатор не водой, а кипящим аммиаком или R22 при –15 °С и ниже.
R13 и близкие к ним по давлениям R23, R170 (этан) и R503 (R13/R23) имеют нормальные температуры кипения: – 81,6; –
148

82; – 88,5 и – 87,8 °С. Их применяют для получения температур кипения от – 80 до –110°С.
R14 с нормальной температурой кипения – 128 °С и критической температурой – 45,6 °С можно использовать в диапазоне температур кипения от – 155 °С (р0 = 0,21·105 Па) до
– 110 °С (р0 = 3,1·105 Па). Температура конденсации его должна составлять около – 80 – 70 °С [рк = (12 18)·105 Па].
Хладагенты низкого давления R12B1, R142 и др. Эта группа хладагентов имеет нормальную температуру кипения – 10 °С и выше. Хладагенты с наибольшей объемной холодопроизводительностью – R12B1 и R142 – применяют в поршневых компрессорах при температуре конденсации до 100 °С, используемых в холодильных машинах кондиционирования воздуха в тропическом исполнении, для крановых кондиционеров и тепловых насосов.
В холодильных машинах с центробежными компрессорами небольшой производительности используют R113, R11 и R114. Последний находит применение и в домашних холодильниках.
3.Диаграммы термодинамических свойств
Вхолодильной машине непрерывно происходят процессы, при которых изменяется агрегатное состояние вещества или только его параметры (давление, температура, удельный объем и др.). Чтобы определить параметры в начале и в конце процесса для каждого хладагента, пользуются составленными на основании опытов и расчетов термодинамическими диаграммами. По двум любым независимым параметрам можно построить точку на диаграмме. И наоборот, имея точку на диаграмме, можно найти все ее параметры. На диаграммах можно нанести
149
происходящие в машинах процессы (кипение, подогрев, сжатие пара, охлаждение и др.) и определить параметры в различных точках цикла, необходимые для расчета отдельных узлов холодильной машины и для ее правильной эксплуатации.
Рассмотрим диаграмму s – Т. По оси ординат отложена абсолютная температура Т, а по оси абсцисс – удельная энтропия s.
Удельной энтропией называют такой параметр вещества, изменение которого Δs равно отношению удельного количества теплоты, подведенной к телу q, к средней температуре этого
тела T :
Δs = q/T .
Если q измеряется в кДж/кг, а Т – в К, то размерность Δs
– кДж/(кг·К).
На рис. 2 в процессе подвода теплоты (кривая 0 – 1) удельная энтропия возрастает от s0 до s1. Если выбрать среднюю температуру Т так, чтобы площадки А и Б были бы равны, то площадь под процессом (0 – 1 – s1 – s0) будет равна удельному количеству подведенной теплоты:
q01 = Δs01 T .
Поскольку
Δs01 = s1 – s0, s1 = s0 + q01/T .
150
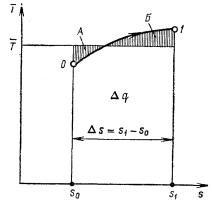
Рис. 2. К определению количества подведенной теплоты q в процессе 0 – 1 по диаграмме s – Т
Начало отсчета и значение s0 выбирают произвольно, так как при расчетах циклов надо знать только разность значений удельной энтропии в конце и начале процесса, абсолютная величина s0 не имеет значения.
Другим важным параметром состояния является удельная энтальпия h. Удельной энтальпией называют полную энергию 1 кг рабочего тела, равную сумме удельной внутренней энергии и и потенциальной энергии давления pv:
h = и + pv.
Удельная внутренняя энергия и представляет собой сумму кинетической энергии теплового движения молекул, зависящей от температуры тела, и потенциальной энергии взаимодействия молекул, зависящей от удельного объема.
Можно показать, что изменение удельной энтальпии
h = q + v p.
151
Поэтому в термодинамическом процессе при постоянном давлении (р = const и p = 0) изменение удельной энтальпии равно удельному количеству подведенной теплоты, т. е. h =
q, или h1 = h0 + q01.
Как и для удельной энтропии, точка начала отсчета и величина h0 значения не имеют, так как для выполнения расчетов необходимо знать только разность значений удельной энтальпии,
Рассмотрим подробнее s – Т-диаграмму (рис. 3, а). Диаграмма имеет пять областей: выше температуры замерзания (тройной точки) слева от пограничной кривой насыщенной жидкости Ж’ – область жидкости; между пограничными кривыми Ж’ и П’’ (линия сухого насыщенного пара) находится влажный пар (смесь жидкости и насыщенного пара): правее пограничной кривой П’’ и выше Ткр – перегретый пар. Ниже изотермы tкр находится твердая фаза (левее C1 – С2) и смесь твердого вещества и насыщенного пара (между C1 – С2 и П’’).
У аммиака и фреонов давления, близкие к тройной точке, настолько низкие, что работа машин в этом диапазоне неэффективна. Поэтому для этих хладагентов область температур, близких к температуре замерзания, не показывают.
Рассмотрим основные процессы на примерах. Возьмем жидкость при t = – 10 °С и р = 4·105 Па (точка 8) и будем подводить к ней теплоту (увеличивать энтропию) при постоянном давлении (по изобаре, т. е. р = const). Давлению р = 4·105 Па соответствует температура кипения 0 °С. Поэтому в точке 0 (s0 = 4) жидкость начинает кипеть. При дальнейшем подводе теплоты температура (0 °С) не изменяется. Между пограничными кривыми Ж’ и П’’ изобара совпадает с изотермой. Массовая доля пара в смеси x (степень сухости) возрастает от х = 0 на пограничной кривой Ж’ до х = 1 на пограничной кривой П’’. Доля пара в промежуточной точке
152
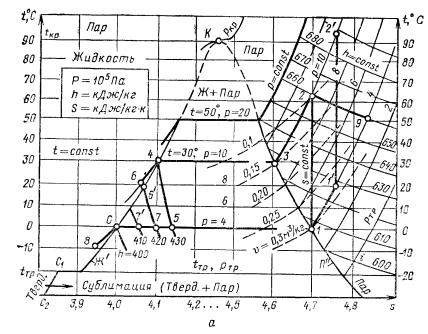
(например, 7) равна отношению (h7 – h0)/(h1 – h0) = (420 – 400)/(605 – 400) = 0,1. Разность h1 – h0 определяет скрытую теплоту парообразования при данном давлении. Дальнейший подвод теплоты (процесс 1 – 1’ и далее) превращает насыщенный пар в перегретый.
153
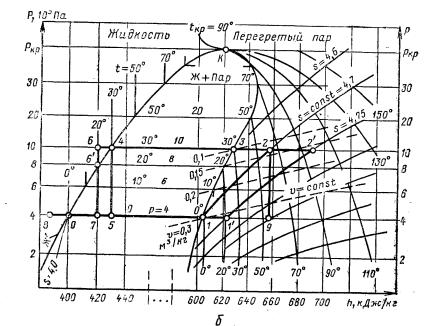
Рис. 3. Термодинамические диаграммы:
а – s – Т (энтропия – температура); б – h – lg р (энтальпия – давление)
Процесс 1 – 2 – повышение давления от р = 4·105 Па до р = 10·105 Па идет по линии s = const, т. е. при постоянной энтропии. Такой процесс – без подвода и отвода теплоты – называют адиабатическим. Он может быть осуществлен, например, при быстром сжатии пара в компрессоре. При этом часть работы сжатия превращается в теплоту, удельная энтальпия увеличивается на h2 – h1 = 660 – 605 = 55 кДж/кг, а температура
– с 0 до 64 °С. Если перед сжатием пар подогреть от 0 до 20 °С (процесс 1 – 1’), то после сжатия его (1’– 2’) температура 2’ будет примерно на 20 С выше, чем в точке 2.
Процесс 2 – 1 обратный по отношению к сжатию 1 – 2: пар адиабатически расширяется, производя работу, и давление его падает от 10 до 4·105 Па. Такой процесс происходит, например,
154
в турбодетандере: пар раскручивает турбинку и выходит резко охлажденный. Если сжатый пар пропустить через отверстие (процесс 2 – 9), то давление его упадет, а часть энергии перейдет в теплоту (энтропия возрастет). Энтальпия при этом не изменяется (h9 = h2). Такой процесс (h = const) называют дросселированием. При дросселировании пара температура снижается примерно на 1/4 °С при падении давления на 0,1 МПа. Снижение температуры при дросселировании значительно меньше, чем при адиабатическом расширении с отдачей работы.
При отводе теплоты при постоянном давлении вместо нагрева и кипения происходят процессы охлаждения и конденсации. В процессе 2 – 3 перегретый пар охлаждается до сухого насыщенного. В процессе 3 – 4 отводится скрытая теплота парообразования r = h3 – h4 происходит конденсация. Процесс 4 – 6 – переохлаждение жидкости с 30 до 20 °С при том же давлении (р = 10·105 Па). Изобара 4 – 6 в области переохлажденной жидкости почти совпадает в s – Т-диаграмме с пограничной кривой Ж’. Жидкость в точке 6’ (на кривой Ж’) имеет такую же температуру, как и в точке 6, но при подводе теплоты к жидкости в точке 6’ (р = 8·105 Па) жидкость сразу начинает кипеть, а при подводе теплоты к жидкости в точке 6 (р = 10·105 Па) жидкость нагревается до 30 °С и только затем закипает.
При дросселировании жидкости (например, процесс 4 – 5) частично образуется пар. В оставшейся доле жидкости (1 – х) температура снижается до t5. Снижение температуры при дросселировании жидкости значительно больше, чем при дросселировании пара (сравните процесс 4 – 5 с процессом 2 – 9), так как охлаждение жидкости является результатом частичного ее выкипания.
Чтобы диаграммы были более компактны, обычно среднюю область влажного пара вырезают (в расчетах она не требуется). Область изменения давлений дают, как правило,
от 0,2 до (20 30) ·105 Па.
155
В практических расчетах удобнее пользоваться диаграммой h – lg р (рис. 3, б). В отличие от диаграммы s – T у пограничных кривых здесь имеют изломы не изобары, а изотермы. Проследите, например, за изотермой t = 30 °С. В области влажного пара, как и в s –Т-диаграмме, она совпадает с изобарой р = 10·105 Па, но из точки 4 она идет вверх, а из точки 3 – вниз, в то время как изобара располагается горизонтально. Значения удельной энтальпии читаются прямо по равномерной шкале абсцисс, а линии s = const наклонные. Это значительно удобнее, так как в расчетах циклов обычно пользуются энтальпией, а не энтропией. Кроме того, более наглядно показан процесс
переохлаждения жидкости при р = const. Температуры t6 и t6’ равны.
4. Хладоносители
Хладоносителем называют вещество, которое отбирает теплоту от одной части холодильной установки и отдает его другой, не меняя при этом своего агрегатного состояния.
Вещество, выбранное в качестве хладоносителя, должно иметь низкую температуру замерзания, малые вязкость и плотность, высокие теплопроводность и теплоемкость, быть безопасным и безвредным, химически стойким, инертным по отношению к металлам, а также недефицитным и недорогим. Почти всем этим требованиям отвечает вода. Однако сравнительно высокая температура замерзания воды ограничивает область ее применения установками кондиционирования воздуха. Для охлаждения камер до температур, близких к 0 °С, требуется подавать в батареи хладоноситель, температура которого около – 10 °С. Вода в этих условиях будет замерзать.
156

В качестве хладоносителей применяют растворы хлористого натрия или хлористого кальция, которые называют рассолами, а также растворы этиленгликоля (антифризы), R30 и др. (табл. 2).
Таблица 2. Параметры хладоносителей
Эвтектические растворы
Свойства |
Вода |
|
CaCl2 |
Этилен- |
|
|
|
гликоль |
|
||
|
|
NaCI |
|
R30 |
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Массовая доля, |
100 |
23,1 |
29,9 |
67 |
100 |
Температура |
0 |
– 21,2 |
– 55 |
– 73 |
– 96,7 |
замерзания, °С |
|
|
|
|
|
Нормальная |
100 |
106 |
110 |
189 |
40,1 |
температура |
|
|
|
|
|
кипения, °С |
|
|
|
|
|
Удельная |
335 |
236 |
213 |
– |
– |
теплота плав- |
|
|
|
|
|
ления, кДж/кг |
|
|
|
|
|
Удельная |
4,21 |
3,32 |
2,74 |
2,29 |
1,16 |
теплоемкость |
|
|
|
|
|
при 0°С, |
|
|
|
|
|
кДж/(кг.К) |
|
|
|
|
|
Коррозионная |
Нет |
Сильная |
Средняя |
Слабая |
Нет |
способность |
|
|
|
|
|
Токсичность |
Нет |
Нет |
Средняя |
Слабая |
Средняя |
Стоимость, |
0,04 |
4,5 |
101 |
540 |
340 |
157
