
Лабораторный практикум по общей химической технологии
.pdfМинистерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего образования «Пермский национальный исследовательский политехнический университет»
ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО ОБЩЕЙ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ
Под ред. О.А. Федотовой
Утверждено Редакционно-издательским советом университета
в качестве учебно-методического пособия
Издательство Пермского национального исследовательского
политехнического университета
2016
УДК 66.02(072.8)(076.5) Л12
Рецензенты:
д-р техн. наук, профессор В.З. Пойлов (Пермский национальный исследовательский политехнический университет);
д-р техн. наук, профессор Б.Е. Шенфельд (ФГБУ УралНИИ «Экология»)
Лабораторный практикум по общей химической Л12 технологии : учеб.-метод. пособие / О.А. Федотова, В.А. Рупчева, В.В. Вахрушев, А.Р. Кобелева; под. ред. О.А. Федотовой. – Пермь : Изд-во Перм. нац. исслед.
политехн. ун-та, 2016. – 85 с.
ISBN 978-5-398-01633-8
Представлено описание 7 лабораторных работ технологического характера по дисциплине «Общая химическая технология». Рассмотрены теоретические закономерности химических процессов. Даны описание экспериментальных методов исследования, схемы лабораторных установок, методики проведения исследований, рекомендации по обработке и анализу результатов экспериментов. В каждой лабораторной работе приведены списки рекомендуемой литературы и вопросы для самоконтроля студентов.
Предназначено для студентов, обучающихся по направлению 240100.62 «Химическая технология».
УДК 66.02(072.8)(076.5)
ISBN 978-5-398-01633-8 |
© ПНИПУ, 2016 |
2
СОДЕРЖАНИЕ |
|
ВВЕДЕНИЕ................................................................................................ |
4 |
Лабораторная работа № 1. ОБЖИГ КАРБОНАТОВ.............................. |
5 |
Лабораторная работа № 2. ОБЖИГ СЕРОСОДЕРЖАЩЕГО |
|
СЫРЬЯ...................................................................................................... |
11 |
Лабораторная работа № 3. ХИМВОДОПОДГОТОВКА |
|
(ИОННЫЙ ОБМЕН)................................................................................ |
22 |
Лабораторная работа № 4. КАРБОНИЗАЦИЯ AMМИАЧНО- |
|
СОЛЕВОГО РАСТВОРА........................................................................ |
34 |
Лабораторная работа № 5. ОПРЕДЕЛЕНИЕ |
|
ГРАНУЛОМЕТРИЧЕСКОГО СОСТАВА ДИСПЕРСНЫХ |
|
МАТЕРИАЛОВ........................................................................................ |
43 |
Лабораторная работа № 6. ПОЛУЧЕНИЕ ГИДРОКСИДА |
|
НАТРИЯ КАУСТИФИКАЦИЕЙ СОДОВОГО РАСТВОРА .............. |
53 |
Лабораторная работа № 7. ИССЛЕДОВАНИЕ ПРОЦЕССА |
|
АДИАБАТИЧЕСКОЙ АБСОРБЦИИ ХЛОРОВОДОРОДА................ |
63 |
ПРИЛОЖЕНИЕ........................................................................................ |
72 |
3
ВВЕДЕНИЕ
Настоящее пособие предназначено для студентов, обучающихся по направлению 240100.62 «Химическая технология» трех профилей: Химическая технология неорганических веществ, Химическая технология природных энергоносителей и углеродных материалов, Химическая технология переработки древесины. Цель преподавания дисциплины «Общая химическая технология» – усвоение общих закономерностей хими- ко-технологических процессов применительно к основным типам химико-технологических систем, закономерностей протекания гомогенных и гетерогенных, каталитических и некаталитических процессов.
Одной из важных составляющих аудиторной работы по дисциплине «Общая химическая технология» является лабораторный практикум. При выполнении лабораторных работ студент должен продемонстрировать знание теоретического материала курса. Составление отчетов по каждой выполненной лабораторной работе позволит студентам показать умение проводить расчеты основных критериев химического производства; проводить расчеты материальных и тепловых балансов ХТС и ее подсистем, расходных коэффициентов по сырью и энергии; анализировать и обосновывать оптимальные параметры технологических процессов; выбирать рациональные способы использования сырья и энергии; принимать конкретные технические решения и совершенствовать технологический процесс с целью нанесения минимального ущерба окружающей среде; а также показать владение рациональными методами оценки технологий и вопросами создания безотходных технологий и методами определения технологических режимов работы оборудования.
Лабораторные работы выполняются на модельных установках, являющихся связующим звеном теории и промышленной практики, что позволяет студентам быстро, уверенно и грамотно освоить курс.
4
Лабораторная работа № 1
ОБЖИГ КАРБОНАТОВ
Цель работы – исследование кинетики процесса разложения известняка в зависимости oт различных факторов (температуры, расхода воздуха, размера исходных частиц, поверхность контакта фаз). В лабораторной установке моделируется процесс обжига известняка в неподвижном (стационарном) слое.
Теоретические сведения
Обжиг – высокотемпературная термическая обработка материалов или изделий с целью изменения (стабилизации) их фазового и химического состава и/или повышения прочности, снижения пористости.
Рассмотрим закономерности процесса обжига карбонатов на примере обжига известняка.
Обжиг извести представляет собой процесс термического разложения карбоната кальция (CaCO3) с образованием свободной окиси кальция (CaO) и углекислого газа (CO2) по реакции
CaCO3 =CaO +CO2 −Q.
Эта реакция обратимая и в зависимости от условий проведения процесса может идти в прямом и обратном направлениях, поэтому из печи необходимо отводить СаО и СО2.
Разложение СаСО3 начинается уже при температуре 900 °С. Наиболее целесообразно данный процесс на производстве проводить при температуре 1100–1200 °С. Необходимо учитывать, что повышение температуры выше 1200 °С наряду с ускорением процесса разложения карбоната кальция может вызвать пережог извести, что недопустимо. Повышение или понижение температуры обжига зависит от теплотворной спо-
5
собности теплоносителя. В производстве чаще всего используют кокс в качестве теплоносителя.
Продолжительность разложения СаСО3 зависит также от размера кусков известняка. Чем больше куски известняка, тем дольше они должны обжигаться. В связи с этим желательно до известных пределов уменьшать размер кусков известняка, что увеличит производительность известеобжигательных печей. Чем однороднее размер кусков известняка и топлива, тем равномернее обжиг, тем меньше сопротивление печи и выше ее производительность. Целесообразно, например, разделить дробленый известняк на три фракции с размером кусков: 80– 150, 40–80 и 20–40 мм.
Длительность обжига извести зависит от температуры обжига, размеров кусков известняка и топлива, загружаемых в печь, теплотворной способности топлива и гидравлических условий работы печи. Длительность обжига назначают с таким расчетом, чтобы достигнуть максимальной производительности печи.
Описание установки и методика проведения работы
Схема лабораторной установки приведена на рис. 1. Установка состоит из печи, реакционной трубки, фарфоровой лодочки с образцом, поглотительного сосуда с раствором KOH, зажимов, реометра и воздуходувки.
Методика проведения лабораторной работы заключается в следующем. Включают нагрев печи 4 (температура нагрева задается преподавателем). В поглотительные сосуды 7 пипеткой наливают по 10 мл 5%-го раствора КОН. Соединяют одну пару сосудов с трубкой печи с помощью зажимов 6 или 6′, другая пара сосудов перекрыта. Затем в нагретую до заданной температуры печь помещают фарфоровую лодочку с навеской образца. Включают воздуходувку 1 и с определенной скоростью (задается преподавателем) через реометр 2 подают воздух
6
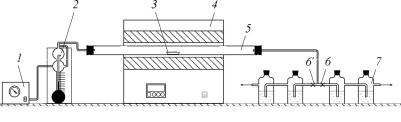
Рис. 1. Схема установки исследования кинетики обжига CaCO3: 1 – воздуходувка; 2 – реометр; 3 – фарфоровая лодочка с образцом; 4 – печь; 5 – реакционная трубка; 6, 6′ – зажимы; 7 – поглотительный сосуд (раствор KOH)
в печь для удаления из зоны реакции выделившегося СО2 . .
При этом диоксид углерода поглощается раствором КОН в поглотителях 7. Через 5 мин поглотители отсоединяют и пропускают газ в другую пару поглотителей. Для этого сначала открывают зажим 6' и только затем перекрывают зажим 6. Продолжительность опыта 20 мин. Содержимое обоих поглотителей сливают в небольшой стакан и оттуда в случае необходимости берут аликвоту или проводят анализ на CO2 из полного объема.
Определение диоксида углерода в растворе газообъемным методом
Сущность метода заключается в обработке анализируемого раствора серной кислотой с концентрацией 7 % и замере объема выделившегося СО2 . Установка для определения со-
держания диоксида углерода в растворе (рис. 2) состоит из уравнительной склянки, компенсационной трубки, бюретки, трехходового крана, реакционного сосуда, стаканчика.
Реакционный сосуд 5 плотно закрывается пробкой, в которую вставлена пробирка с отверстиями, находящимися в верхней части пробирки ближе к пробке. Реакционный сосуд 5 соединен с измерительной бюреткой 3, в которой измеряется
7
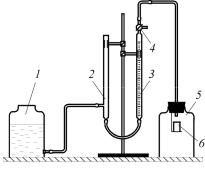
Рис. 2. Установка для определения содержания диоксида углерода в растворе: 1 – уравнительная склянка; 2 – компенсационная трубка; 3 – бюретка; 4 – трехходовой кран; 5 – реакционный сосуд; 6 – стаканчик
объем выделившегося диоксида углерода. Компенсационная трубка 2 и уравнительная склянка 1 заполнены насыщенным раствором хлорида натрия, в который добавлено несколько капель кислоты и метилового оранжевого. Прежде чем приступить к анализу, установку проверяют на герметичность. Для этого при открытом кране 4 поднимают уравнительную склянку 1, так чтобы уровень жидкости в бюретке 3 и склянке 1 был на одной высоте, отмечают объем воздуха в бюретке и опускают склянку 1. Через 10 мин объем воздуха измеряют снова. Если он не изменился, то установка герметична. Для выполнения анализа в реакционный сосуд 5 наливают пипеткой определенный объем анализируемой жидкости (задается преподавателем). В стакан 6 через отверстия наливают 7%-ю H2SO4 так, чтобы уровень жидкости не доходил до краев отверстий на 1 см. Затем плотно закрывают реакционный сосуд 5 пробкой, в которую вставлена пробирка. Осторожно наклоняют сосуд 5 так, чтобы из стакана 6 вытекла кислота. Последняя взаимодействует с пробой раствора, при этом выделяется СО2 , который вытесняет запорную жидкость в уравнительной
склянке 1.
8

По количеству вытесненной жидкости определяют объем выделившегося диоксида углерода. Объем выделившегося диоксида углерода V пересчитывают на объем сухого газа V0 при 0 °С (273 К) и 760 мм рт. ст. по формуле
V =V 273 (P − p) |
, |
|||
0 |
760 |
(273 |
+t) |
|
|
|
|||
где V – объем выделившегося диоксида углерода, мл; P – барометрическое давление, мм рт. ст.; p – давление паров воды
при комнатной температуре, мм рт. ст.; 760 – нормальное давление, мм рт. ст.; t – комнатная температура, °С.
При расчете выделившегося СО2 необходимо учитывать
аликвоту, взятую для анализа, и общий объем из двух поглотителей, мл.
Зная теоретический объем выделившегося СО2 из навески (Vтеор ) и практический (Vпракт ), полученный из анализов, рассчитывают степень разложения α (%).
α =Vпракт 100 %.
Vтеор
Полученные результаты заносят в таблицу и строят график зависимости степени разложения (α) от температуры или
от других факторов (по заданию преподавателя).
Используя полученные и расчетные данные, составляют материальный баланс обжига известняка.
9
Полученные результаты исследований
Номер |
Температура |
Время |
Объем выдел. |
Объем |
Степень |
СО2 за опреде- |
сухого |
разложе- |
|||
опыта |
опыта, |
опыта τ, |
ленное время V, |
газа V0, |
ния α, |
|
°С |
мин |
|||
|
|
|
мл |
мл |
% |
1 |
|
5 |
|
|
|
|
|
|
|
|
|
2 |
t1 |
10 |
|
|
|
|
|
|
|
|
|
3 |
15 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
4 |
|
20 |
|
|
|
|
|
|
|
|
|
5 |
|
5 |
|
|
|
|
|
|
|
|
|
6 |
t2 |
10 |
|
|
|
|
|
|
|
|
|
7 |
15 |
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
8 |
|
20 |
|
|
|
|
|
|
|
|
|
Контрольные вопросы
1.Факторы, влияющие на скорость и степень разложения известняка.
2.Дайте определения понятия «лимитирующие стадии процесса».
3.Чем объясняется выбор температурного режима обжига известника?
4.Опишите процесс обжига известняка как пример гетерогенного процесса в системе газ – твердое.
Список литературы
1.Шокин И.Н., Крашенинников С.А. Технология соды. –
М.: Химия, 1975. – 286 с.
2.Руководство к практическим занятиям по технологии неорганических веществ / М.Е. Позин [и др.]. – М.: Химия, 1986. – 368 с.
10
