
2995
.pdf
54 Ш32
СИБИРСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ ПУТЕЙ СООБЩЕНИЯ
С.А. ШАХОВ, Е.В. РОГОВА
Методические указания к выполнению лабораторных работ
Новосибирск
2016
1
УДК 541.1
Ш32
Ш а х о в С . А . , Р о г о в а Е . В . Фотоколориметрия: Метод. указ. к выполнению лабораторных работ. – Новосибирск: Изд-во СГУПСа, 2016. – 26 с.
Кратко изложены основные понятия фотоколориметрического метода анализа. Для закрепления изучаемого материала и приобретения практических навыков даны контрольные вопросы и лабораторные работы.
Предназначены для студентов I курса (очной формы обучения) технических специальностей, изучающих курсы «Общая химия», «Химия и микробиология воды» и «Химия в строительстве», а также для магистрантов, обучающихся по направлению «Строительство».
Рассмотрены и рекомендованы к изданию на заседании кафедры «Химия».
О т в е т с т в е н н ы й р е д а к т о р д-р техн. наук, проф. С.А. Шахов
Р е ц е н з е н т завкафедрой «Безопасность жизнедеятельности»
д-р техн. наук, проф. В.И. Медведев
©Сибирский государственный университет путей сообщения, 2016
©Шахов С.А., Рогова Е.В., 2016
2
Введение
Все химические соединения взаимодействуют с электромагнитным излучением, уменьшая интенсивность его потока. Поглощение излучения при определенной длине волны является информацией о качественном и количественном составе определяемого вещества и составляет аналитический сигнал. Методы, основанные на измерении уменьшения интенсивности излучения, прошедшего через раствор анализируемого вещества, составляют обширную группу абсорбционных оптических методов. Из этой группы наибольшее распространение получил фотоколориметрический метод анализа – оптический метод анализа, основанный на поглощении полихроматического (немонохроматического) излучения, т.е. пучка лучей с близкими длинами волны в видимой области спектра (400–700 нм). Фотоколориметрию используют для определения концентрации окрашенных растворов. Ее использование обусловлено следующими факторами:
–наличие разнообразных фотометрических методик анализа многочисленных неорганических и органических веществ;
–возможность использования относительно недорогой и доступной аппаратуры;
–возможность фотометрических определений соединений в интервале от 100 до 10–6 мас. %, включая анализ веществ высокой степени очистки.
Специфичность, чувствительность, относительная простота и точность определений, достигаемая с помощью современной аппаратуры, обеспечивает широкое использование метода в различных областях науки и практики.
Цель данных методических указаний – познакомить студентов с применением фотометрического анализа для исследования
иконтроля веществ.
3
1. Общая характеристика фотоколориметрического метода
Фотометрические методы анализа основаны на избирательном поглощении света молекулами анализируемого вещества. Согласно квантовой механике свет представляет собой поток фотонов или квантов – частиц, обладающих определенной энергией и импульсом. Энергия каждого кванта определяется длиной волны излучения. В результате поглощения излучения молекула поглощающего вещества переходит из одного энергетического состояния с минимальной энергией E1 в другое энергетическое состояние с большей энергией Е2. При поглощении кванта электромагнитного излучения происходят квантовые переходы молекул из одного электронного состояния в другое, что характеризуется наличием определенных полос поглощения в электронных спектрах поглощения.
Энергия кванта поглощенного излучения равна разности энергий двух состояний молекулы: конечного Е2 и начального Е1.
Отсюда
h = Е = Е2 – E1,
где h – постоянная Планка (6,625∙10–34 Дж∙с); – частота излучения, связанная с длиной волны электромагнитного излучения отношением = с/λ (с – скорость световой волны в вакууме, с = 3 ∙ 1010 см/с; λ – длина волны электромагнитного излучения).
Природа полос поглощения в видимой области спектра одинакова (400–700 нм) и связана с числом и расположением электронов в поглощающих молекулах и ионах.
Между поглощением излучения раствором, концентрацией в нем поглощающего вещества С и толщиной слоя раствора существует зависимость, выражаемая законом Бугера – Ламберта – Бера:
(1)
где I – интенсивность излучения, проходящего через поглощающий раствор; I0 – интенсивность потока света, направленного на поглощающий раствор; ελ – молярный коэффициент светопоглощения при данной длине волны, моль–1∙л∙см–1); С – концентрация вещества в растворе, моль/л; l – толщина поглощающего слоя, см.
4

В логарифмической форме закон Бугера – Ламберта – Бера выглядит следующим образом:
lg I lg I |
0 |
|
Cl; |
|
|
|
|
|
|
|
lg |
I |
0 |
|
Cl. |
|
|
|
|
|
||||
|
|
|
|
|
|
|||
|
|
|
|
|
I |
|
|
|
|
|
|
|
|
|
|
||
Величина |
lg |
I |
0 |
характеризует поглощение излучения. Ее |
||||
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
I |
|
|
|
|
|
|
называют оптической плотностью А и рассчитывают следующим образом:
A lg |
I |
0 |
. |
(2) |
|
|
|||||
I |
|||||
|
|
||||
|
|
|
|||
С учетом формулы (2) основной закон светопоглощения принимает следующий вид:
A |
Cl. |
|
|
(3)
Таким образом, оптическая плотность раствора прямо пропорциональна молярному коэффициенту светопоглощения, концентрации поглощающего вещества и толщине слоя раствора.
Если С = 1 моль/л и l = 1 см, то А = ελ. Следовательно, молярный коэффициент светопоглощения представляет собой оптическую плотность раствора с концентрацией 1 моль/л, помещенного в кювету с толщиной слоя 1 см. Величина ελ зависит от длины волны проходящего света λ, природы растворенного вещества, температуры раствора.
Закон светопоглощения Бугера – Ламберта – Бера справедлив для разбавленных растворов при следующих условиях:
1)неизменность поглощающих частиц в растворе и постоянство состава;
2)монохроматичность проходящего через пробу светового потока.
Первое условие выполняется при соответствующем выборе аналитической реакции и соблюдении одинаковых условий во всей серии производимых измерений. При этом фотометрические методы подразделяют на прямые и косвенные. В прямых методах определяемый ион Мz+ с помощью реагента R переводят в светопоглощающее соединение MR, а затем измеряют интенсивность светопоглощения раствора этого соединения. При косвенных методах используют вспомогательные вещества, которые при взаи-
5
модействии с определяемым соединением либо разрушаются, либо образуют новые светопоглощающие соединения.
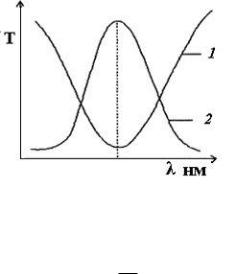
С целью монохроматизации светового потока, т.е. чтобы из всей видимой области спектра λ = 400–700 нм выделить лучи определенных длин волн, на пути световых потоков перед поглощающими растворами устанавливают избирательные поглотители света, называемые светофильтрами. Светофильтр для фотометрирования (табл. 1) выбирают таким образом, чтобы максимум поглощения окрашенного раствора соответствовал максимуму пропускания (минимуму поглощения) светофильтра (рис. 1).
|
|
Таблица 1 |
|
Длины волн спектра и соответствующие окраски |
|||
|
|
|
|
Цвет раствора |
Область максимального погло- |
Цвет светофильтра |
|
щения лучей раствором, нм |
|||
|
|
||
Желто-зеленый |
400–450 |
Фиолетовый |
|
Желтый |
450–480 |
Синий |
|
Оранжевый |
480–490 |
Зелено-синий |
|
Красный |
490–500 |
Сине-зеленый |
|
Пурпурный |
500–560 |
Зеленый |
|
Фиолетовый |
560–575 |
Желто-зеленый |
|
Синий |
575–590 |
Желтый |
|
Зелено-синий |
590–625 |
Оранжевый |
|
Сине-зеленый |
625–700 |
Красный |
|
Рис. 1. Спектр поглощения излучения: 1 – светофильтром; 2 – раствором
Пропусканием Т называют отношение I / I0, т.е.
T |
I |
. |
|
I |
|
||
|
0 |
|
|
|
|
|
|
Его значение может изменяться от 0 до 1 или от 0 до 100 %. Зависимость между пропусканием Т и светопоглощением или оптической плотностью А выражается уравнением
A lgT. |
(4) |
6
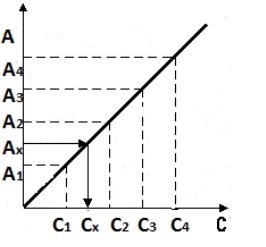
Самым распространенным и точным методом фотометрических определений является метод градуировочного графика. По этому методу готовят 5–8 стандартных (эталонных) растворов анализируемого вещества с различными, но точными концентрациями, заданными заранее. После выполнения с этими растворами выбранной аналитической реакции измеряют оптическую плотность полученных окрашенных растворов при определенной длине волны и толщине слоя относительно растворителя или раствора сравнения, который содержит все те же реагенты, что и рабочие растворы (кроме определяемого вещества). Строят график зависимости А = f(С), который называют градуировочным графиком (рис. 2).
Рис. 2. Градуировочный график зависимости А = f(С)
При строгом выполнении закона светопоглощения Бугера – Ламберта – Бера градуировочный график представляет из себя прямую линию, проходящую через начало координат. Используя метод построения градуировочного графика, количественные фотометрические измерения можно проводить с высокой степенью точности и при его отклонении от линейности. Но в этом случае следует увеличить количество эталонных растворов, и каждая точка для построения графика должна быть средним значением не менее трех параллельных измерений.
Контрольные вопросы
1.На чем основан фотометрический метод анализа? Что такое оптическая плотность? Какие значения принимает оптическая плотность прозрачного и абсолютно непрозрачного раствора?
2.Что такое коэффициент пропускания Т и оптическая плотность А? В каких пределах изменяются эти величины?
7

3.Запишите уравнения, которыми выражается основной закон светопоглощения Бугера – Ламберта – Бера.
4.Какие факторы могут привести к нарушению линейной зависимости оптической плотности от концентрации раствора?
5.Каков физический смысл молярного коэффициента поглощения? От каких факторов зависит молярный коэффициент поглощения: а) концентрация раствора; б) температура; в) длина волны проходящего света; г) природа вещества?
6.Что такое светофильтры? Каково их назначение?
7.Какова природа светопоглощения в видимом участке спектра?
8.Метод градуировочного графика, его особенности.
9.В каких координатах строят градуировочный график? Каково его назначение?
2. Основная аппаратура и схема выполнения фотометрического анализа
Основная аппаратура. Для выполнения лабораторных работ, рассматриваемых в настоящих методических указаниях, используется лабораторная установка (учебно-лабораторный комплекс «Химия») для фотометрического определения, состоящая из трех блоков (рис. 3).
а) |
б) |
в) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
sam-
sung |
Рис. 3. Схема лабораторной установки для фотометрического определения:
а– модуль «Фотоколориметр»; б – универсальный контроллер;
в– компьютер
Модуль «Фотоколориметр» (см. рис. 3, а) предназначен для измерения концентрации растворов окрашенных веществ в видимой области спектра (400–700 нм), включает в себя основные узлы: лампа накаливания, набор светофильтров, кюветы для растворов, фотоэлемент. Измерения, полученные в ходе эксперимента, с модуля «Фотоколориметр» передаются на контроллер (см. рис. 3, б), который обрабатывает полученную информацию и передает ее на компьютер (см. рис. 3, в). Оператор видит результаты измерений на мониторе в виде графика или таблицы. Компьютер позволяет выполнять с результатами эксперимента различные операции: сохра-
8

нять, удалять, добавлять данные в расчеты и т.п. Описание подготовки лабораторной установки к работе и порядок управления ею приведены в прил. А.
Общая схема выполнения фотометрического анализа.
Методика выполнения фотометрического анализа включает следующие стадии:
1.Подготовка пробы и перевод определяемого вещества в раствор (в реакционно-способную по отношению к аналитической реакции форму). Например, при анализе органических фосфорсодержащих соединений связанный фосфор предварительно переводят в фосфат-ионы РО43–. Если необходимо определить содержание хлора в хлорорганических соединениях, его первоначально гидролизуют до хлорид-ионов Cl– и т.п.
2.Перевод анализируемого вещества в окрашенную форму в результате проведения цветной реакции.
3.Измерение оптической плотности полученного раствора аналитической формы. Принцип измерения коэффициента пропускания состоит в том, что на фотоприемник направляется сначала полный поток I0, а затем поток I, прошедший через поглощающее вещество. Отношение потоков есть коэффициент про-
пускания Т исследуемого раствора: Т = I / I0 100 %.
4. По величине светопоглощения (оптической плотности) с помощью градуировочного графика находят концентрацию анализируемого вещества (рис. 4).
Рис. 4. Нахождение концентрации анализируемого раствора по градуировочному графику
Контрольные вопросы
1.Какой прибор используется для определения концентрации вещества в растворе? Из каких частей он состоит?
2.В чем заключается принцип работы фотоколориметра?
9
3.Для чего используют раствор сравнения?
4.Из каких основных блоков состоит лабораторная установка для фотоколориметрического определения?
5.Используя схему (см. рис. 3), объясните, как связаны блоки лабораторной установки между собой. Объясните назначение каждого модуля.
6.Какова последовательность операций при проведении фотоколориметрического измерения?
3. Практическая часть
Перед выполнением каждой работы студент должен ознакомиться с инструкцией по технике безопасности при проведении лабораторных работ по химии. Лабораторные работы необходимо выполнять только под руководством преподавателя.
3.1. Лабораторная работа № 1 Определение железа (III) в виде роданидного комплекса
Цель работы – определить концентрацию ионов железа в растворе с помощью градуировочного графика, построенного по серии стандартных растворов.
Задачи:
1)изучить сущность фотометрического определения концентрации вещества методом градуировочного графика;
2)определить концентрацию ионов железа в виде роданидного комплекса в анализируемом растворе.
Оборудование и реактивы:
1. Учебно-лабораторный комплекс «Химия» в следующей комплектации: модуль «Фотоколориметр» в комплекте с кюветой (l = 1 см), центральный контроллер.
2. Лабораторная посуда: мерные колбы объемом 50 мл, пипетки градуированные объемом 1; 2; 5 мл, мерная колба объемом
100 мл.
3.Реактивы: стандартный раствор соли Fe (III) NH4Fe(SO4)2
12 H2O (0,002 М раствор), HNO3 (раствор 1 : 1), роданид аммония или калия – 10%-й раствор, дистиллированная вода.
Теоретические сведения. Для определения концентрации иона Fe3+ в растворе определяемый ион переводят в соединение кроваво-красного цвета – роданид железа (III). Ион Fe3+ с рода- нид-ионами CNS– образует в сильнокислой среде ряд комплексных соединений различного состава:
10
