
Энергетические установки
..pdf
1. Энтропия – мера ценности теплоты, ее работоспособности и технологической эффективности. Можно сказать, что для изолированной системы (нагреватель – рабочее тело) ∆s = 0, при
получении от |
нагревателя количества теплоты |
q |
s = q1 |
, |
|
|
|
1 |
1 |
T1 |
|
|
|
|
|
|
|
и чем меньше |
s1, т.е. чем выше T1, тем больше совершаемая |
||||
системой работа. |
|
|
|
|
|
Повседневный опыт свидетельствует, что чем выше температура теплоносителя при том же количестве теплоты q, т.е.
чем меньше энтропия s = Tq , тем теплота ценнее.
2. Энтропия – мера потери работы вследствие необратимости реальных процессов. Чем больше необратимость процесса в изолированной системе, тем больше возрастает энтропия s2 >> s1 и тем большая доля энергии не превращается в работу,
арассеивается в окружающую среду.
3.Энтропия – мера беспорядка. Если установить некоторую меру неупорядоченности макросистемы – неупорядоченности
расположения и движения частиц D, то можно записать s = k ln D.
Следовательно, возрастание беспорядка означает возрастание энтропии, рассеивание энергии. При подводе теплоты увеличивается хаотичность теплового движения частиц и энтропия возрастает. В противном случае охлаждение системы при постоянном объеме есть извлечение из нее теплоты, а следовательно, и энтропии. Упорядоченность системы при этом повышается, а энтропия уменьшается. При конденсации газа в жидкость молекулы занимают более определенные положения, упорядоченность их расположения скачкообразно увеличивается, что соответствует скачкообразному уменьшению энтропии. При дальнейшем понижении температуры тепловое движение становится все менее интенсивным, беспорядок – все меньшим, а значит, все меньшей становится и энтропия. Ког-
11
да жидкость превратится в твердое вещество, молекулы (ионы) образуют правильные кристаллические решетки, т.е. неупорядоченность опять уменьшится, а с нею уменьшится и энтропия и т.д. Такая закономерность позволяет предположить, что при абсолютной температуре, равной нулю, тепловое движение полностью прекратится и в системе установится порядок, т.е. неупорядоченность и энтропия станут равными нулю. Это предположение согласуется с опытом, но не поддается опытной проверке (так как абсолютная температура, равная нулю, недостижима) и носит название третьего закона термодинамики.
Универсальное уравнение состояния идеального газа.
Идеальным газом называется такой газ, в котором отсутствуют силы взаимного притяжения и отталкивания между молекулами, и размерами молекул можно принебречь. Все реальные газы при высоких температурах и малых давлениях можно практически считать идеальными газами. Уравнение состояния идеального газа можно вывести из молекулярно-кинетической теории или из совместного рассмотрения законов Бойля – Мариотта и Гей-Люссака. Это уравнение было выведено в 1834 г. французским физиком Клапейроном и для газа массой 1 кг имеет вид
P υ = R T ,
где R – газовая постоянная, представляет работу 1 кг газа в процессе при постоянном давлении и при изменении температуры на 1 К.
Для произвольного количества газа массой m уравнение состояния записано следующим образом:
P V = m R T.
В 1874 г. Д.И. Менделеев, основываясь на законе Дальтона (в равных объемах разных идеальных газов, находящихся при одинаковых температурах и давлениях, содержится одинаковое
12
количество молекул) предложил универсальное уравнение состояния газа, которое называют уравнением Клапейрона – Менделеева:
P V = m R T ,
где µ – молярная (молекулярная) масса газа, кг/моль;
R = 8,3142 Дж/(моль·К) – универсальная газовая постоянная, представляет собой работу 1 моля идеального газа при постоянном давлении и при изменении температуры на 1 К.
1.3. Второй закон термодинамики
Второй закон термодинамики, как и первый, является опытным законом, основывающимся на многовековых наблюдениях ученых, однако установлен он был только в середине
XIX в.
Наблюдения за явлениями природы показывают, что возникновение и развитие самопроизвольно протекающих в ней естественных процессов, работа которых может быть использована для нужд человека, возможно лишь при отсутствии равновесия между участвующей в процессе термодинамической системой
иокружающей средой. Эти процессы всегда характеризуются односторонним их протеканием от более высокого потенциала к более низкому (от более высокой температуры к более низкой или от более высокого давления к более низкому). При протекании указанных процессов термодинамическая система стремится к тому, чтобы прийти в равновесие с окружающей средой, характеризуемое равенством давления и температуры системы
иокружающей среды.
Из наблюдений за явлениями природы также следует, что для того, чтобы заставить процесс протекать в направлении, обратном направлению протекания самопроизвольного процесса, необходимо затратить заимствованную из внешней среды энергию.
13
Второй закон термодинамики представляет собой обобщение изложенных положений и заключается в следующем.
1.Самопроизвольное протекание естественных процессов возникает и развивается при отсутствии равновесия между участвующей в процессе термодинамической системой и окружающей средой.
2.Самопроизвольно происходящие в природе естественные процессы, работа которых может быть использована человеком, всегда протекают лишь в одном направлении – от более высокого потенциала к более низкому.
3.Самопроизвольно протекающие процессы идут в направлении, приводящем к установлению равновесия термодинамической системы и окружающей среды, по достижении этого равновесия процессы прекращаются.
4.Процесс может протекать в направлении, обратном самопроизвольному процессу, если энергия для этого заимствуется из внешней среды.
Формулировки второго закона термодинамики, данные различными учеными, вылились в форму постулатов, полученных
врезультате развития положений, высказанных французским ученым С. Карно.
В частности, постулат немецкого ученого Р. Клаузиуса состоит в том, что теплота не может переходить от холодного тела к теплому без компенсации. Сущность постулата английского ученого В. Томсона заключается в том, что невозможно осуществить цикл теплового двигателя без переноса некоторого количества теплоты от источника теплоты с более высокой температурой к источнику с более низкой температурой.
Эту формулировку следует понимать так: для того чтобы работала периодически действующая машина, необходимо присутствие как минимум двух источников теплоты различной температуры; при этом в работу может быть превращена лишь часть теплоты, забираемого из высокотемпературного источника, в то время как другая часть теплоты должна быть передана
14

низкотемпературному источнику. Высокотемпературный источник иногда называют теплоотдатчиком или верхним источником теплоты, а низкотемпературный – теплоприемником, нижним источником теплоты или холодильником.
1.4. Термодинамические процессы
Метод исследования термодинамических процессов.
Первый закон термодинамики устанавливает взаимосвязь между количеством теплоты, внутренней энергией и работой. При этом количество теплоты, подво-
димое к телу или отводимое от |
P |
2 |
||
тела, зависит от характера процес- |
Нагрев |
Охлаждение |
||
ный, изотермический, изобарный |
||||
са. К основным термодинамиче- |
|
|
||
ским процессам относятся: изохор- |
|
|
||
и адиабатный. |
|
|
1 |
|
Изохорный процесс (рис 1.1) |
|
|||
|
υ |
|||
протекает при постоянном объеме: |
|
|||
υ= const, υ2 = υ1. |
|
Рис. 1.1. Изохорный |
||
Уравнение состояния процесса |
|
процесс |
||
|
|
|||
|
P2 |
= T2 . |
|
|
|
P |
|
|
|
|
T |
|
|
|
1 |
1 |
|
|
|
Поскольку υ2 = υ1, работа l не совершается и уравнение первого закона термодинамики принимает вид
q = ∆u = cυ (t2 −t1 ).
Изобарный процесс (рис. 1.2) протекает при постоянстве давления:
P = const, P2 = P1.
15

Рис. 1.2. Изобарный процесс в Р, υ-координатах
Уравнение процесса состояния в этом случае записывается
как
υ2 = T2 .
υ1 T1
Работу можно найти из выражения l = P(υ2 −υ1 ).
Уравнение первого закона технической термодинамики принимает вид
q = ∆u +l = cp (t2 −t1 ).
Изотермический процесс (рис 1.3) протекает при постоянной температуре:
T =const, T2 =T1.
Уравнение состояния
P1 = υ2 .
P2 υ1
Поскольку T1 =T2 , то ∆u = 0 и уравнение первого закона термодинамики будет иметь вид
q =l = R T ln υ2
υ1
16

или
q=l = R T ln PP1 ,
2
где R – газовая постоянная.
Рис. 1.3. Изобарный процесс в Т, s-координатах
Адиабатный процесс – процесс, при котором теплообмен с окружающей средой исключен. Тепло не подводится и не отводится (рис. 1.4), т.е. q = 0. Уравнение состояния в этому случае записывается следующим образом:
|
|
P υλ =const, |
||
где λ = |
сp |
– показатель адиабаты. |
||
c |
||||
|
|
|
||
|
υ |
|
|
|
|
|
T |
2 |
|
|
|
Нагрев |
Охлаждение |
|
|
|
|
1 |
|
s
Рис. 1.4. Изохорный процесс
17

Уравнение первого закона термодинамического процесса будет иметь вид
l= −∆u = −сυ (T2 −T1 ).
1.5.Реальные газы, водяной пар, влажный воздух
Реальные газы отличаются от идеальных тем, что молекулы этих газов имеют объемы и связаны между собой силами взаимодействия, которые уменьшаются с увеличением расстояния между молекулами. Наиболее простым и качественно верно отображающим поведение реального газа уравнением является уравнение Ван-дер-Ваальса:
P + υα2 (υ−b) = R T ,
где а, b – постоянные величины, первая учитывает силы взаимодействия, вторая – размер молекул;
α/ υ2 – характеризует добавочное давление, под которым находится реальный газ вследствие сил сцепления между молекулами, называется внутренним давлением.
Для жидких тел это давление имеет большие значения (например, для воды при 200 °С составляет 1050 МПа), а для газов из-за малых сил сцепления молекул оно очень мало. Поэтому внешнее давление, под которым находится жидкость, оказывает ничтожное влияние на ее объем, и жидкость считают несжимае-
мой. В газах ввиду малости значения α/ υ2 внешнее давление легко изменяет их объем.
Практически пользоваться уравнением Ван-дер-Ваальса нельзя, так как оно дает результаты, недостаточно точные для современной паротехники. В настоящее время наиболее точным является уравнение состояния реальных газов, разработанное М.П. Вукаловичем и Н.И. Новиковым (МЭИ) применительно, в основном, к водяному пару. Вывод этого уравнения основан
18
на предположении наличия в реальных газах ассоциаций молекул, механически объединенных в двойные, тройные и более сложные комплексы, образующиеся в результате взаимодействия между ними. Результаты расчетов с помощью этого уравнения дают наиболее близкое совпадение с опытными данными. Однако для практических целей оно также непригодно из-за сложности и необходимости выполнения трудоемких вычислений. На практике обычно пользуются готовыми данными, которые берут из таблиц водяного пара или из i, s-диаграммы водяного пара.
Водяной пар. Одним из наиболее распространенных рабочих тел в паровых турбинах, паровых машинах, атомных установках, теплоносителем в различных теплообменниках является водяной пар. Пар – газообразное тело в состоянии, близком к кипящей жидкости. Парообразование – процесс превращения вещества из жидкого состояния в парообразное. Испарение – парообразование, происходящее всегда, при любой температуре с поверхности жидкости. При некоторой определенной температуре, зависящей от природы жидкости и давления, под воздействием которого она находится, начинается парообразование во всей массе жидкости. Этот процесс называется кипением. Обратный процесс парообразования называется конденсацией. Она также протекает при постоянной температуре.
В процессах кипения и парообразования в координатах T, s можно выделить четыре области фазового состояния воды
(рис. 1.5):
–область I – газообразное состояние перегретого пара, обладающего свойствами реального газа;
–область II – равновесное состояние воды и насыщенного водяного пара (двухфазное состояние). Двухфазную область II также называют областью парообразования;
–область III, ограниченная изотермой ЕK – жидкое состояние (вода).
19
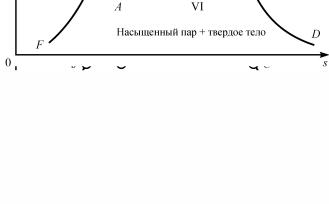
Рис. 1.5. Фазовая диаграмма водяного пара в T,s-координатах
Области III, II и II, I отделены так называемыми пограничными линиями: левой AK и правой KD. Общая для левой и правой пограничной линий (областей I, II, III и IV) точка K называется критической точкой. Эта точка имеет определенные параметры pкр, υкр и Ткр, при которых кипящая вода переходит
в перегретый пар, минуя двухфазную область. Отсюда следует, что вода (точнее, ее жидкая фаза) не может существовать при температурах выше Tкр. Будучи нагретой до этой температуры,
вся вода практически мгновенно должна превратиться в пар. Вместе с тем пар при давлениях больших, чем pкр, и при охла-
ждении до температуры Ткр непосредственно превращается
в жидкость, минуя область влажного пара. Критическая точка воды имеет следующие параметры: Pкр = 22,136 МПа; Tкр =
= 374,15 °С; υкр = 0,00326 м3 кг.
кг.
Значения р, Т, υ и s для обеих пограничных линий (кипения и сухого насыщенного пара) приводятся в специальных таблицах термодинамических свойств водяного пара.
20
