
Физическая химия. Термодинамика растворов. Фазовые равновесия метод
.pdfМинистерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Пермскийнациональныйисследовательский политехническийуниверситет»
ФИЗИЧЕСКАЯ ХИМИЯ
Термодинамика растворов. Фазовые равновесия
Методическиеуказания клабораторнымработам
Издательство Пермского национального исследовательского
политехнического университета
2015
УДК544.344(072.8) Ф50
Составители:
канд. хим. наук, доцентО.И. Бахирева, канд. хим. наук, доцентМ.М. Соколова
Рецензент д-рхим. наукГ.В. Леонтьева
(Пермский национальный исследовательский политехнический университет)
Физическая химия. Термодинамика растворов. Фазовые Ф50 равновесия : метод. указания к лаборат. работам / сост. О.И. Бахирева, М.М. Соколова. – Пермь : Изд-во Перм. нац. исслед.
политехн. ун-та, 2014. – 44 с.
Содержат программу, контрольные вопросы и указания к выполнению лабораторных работ по разделу «Термодинамика растворов. Фазовые равновесия».
Предназначены для студентов, изучающих курсы «Физическая химия» и «Физическая и коллоидная химия».
УДК544.344(072.8)
© ПНИПУ, 2015
2
СОДЕРЖАНИЕ |
|
Введение.................................................................................................................... |
4 |
Программа раздела «Термодинамика растворов. |
|
Фазовые равновесия» ............................................................................ |
4 |
Лабораторная работа № 1. Исследование температур кипения |
|
разбавленных растворов. Эбулиоскопия............................................. |
6 |
Лабораторная работа № 2. Изучение зависимости давления |
|
насыщенного пара индивидуальных жидкостей |
|
от температуры ................................................................................... |
11 |
Лабораторная работа № 3. Изучение распределения уксусной |
|
кислоты между водой и органическим растворителем.................... |
15 |
Лабораторная работа № 4. Изучение распределения йода |
|
между водой и органическим растворителем................................... |
20 |
Лабораторная работа № 5. Многократная экстракция йода |
|
из водного раствора органическим растворителем.......................... |
24 |
Лабораторная работа № 6. Изучение равновесия жидкость – пар |
|
в двухкомпонентных жидких системах............................................. |
31 |
Лабораторная работа № 7. Построение диаграммы состояния |
|
двухкомпонентной системы (термический анализ) ......................... |
34 |
Список литературы.............................................................................. |
43 |
3
ВВЕДЕНИЕ
Физическая химия изучает связь между физической и химической формами движения. Она объясняет химические явления и их закономерности на основе законов физики. Физическая химия имеет большое практическое применение, вклад каждого из разделов физической химии в технологические процессы синтеза разнообразных веществ, химические производства значителен, поскольку все они основаны на законах физической химии.
Раздел «Термодинамика растворов. Фазовые равновесия» также имеет большое значение: расплавленные соли и их смеси используются в различных областях техники, например в электрометаллургии, ядерной технике и др. Рациональный подбор солевых смесей при этом основан на использовании диаграмм плавкости с определением фазовых процессов выделения и очистки веществ различными способами: кристаллизацией, ректификацией, экстракцией и др. Изучение химических равновесий и определение констант равновесия химических реакций позволяет рассчитать составы равновесных смесей и выход продуктов реакции.
Настоящее методическое пособие должно способствовать лучшему усвоению теоретических знаний и получению практических навыков в решении задач раздела физической химии «Термодинамика растворов. Фазовые равновесия».
Программа раздела «Термодинамика растворов. Фазовые равновесия»
Термодинамические свойства растворов. Парциальные молярные величины. Уравнения Гиббса – Дюгема. Расчет парциальных молярных величин. Тепловые эффекты при растворении. Идеальные, предельно разбавленные и неидеальные растворы. Зависимость равновесных свойств растворов (давление пара компонента над раствором, понижение температуры замерзания и повышение
4
температуры кипения, растворимость твердых веществ, распределение растворенного вещества между двумя несмешивающимися растворителями) от химического потенциала и других парциальных молярных величин. Положительные и отрицательные отклонения от законов идеальных растворов. Методы определения активности компонентов раствора. Условия термодинамического равновесия между фазами. Связь между температурой и давлением при фазовом переходе. Уравнение Клапейрона – Клаузиуса. Зависимость давления насыщенного пара жидкости и твердого тела от температуры. Фазовые переходы второго рода.
Гетерогенные равновесия. Основные понятия и определения: фаза, составная часть смеси, число компонентов, термодинамическая степень свободы. Правило фаз Гиббса. Общие представления о диаграммах состояния. Применение правила фаз для анализа однокомпонентных систем. Фазовые равновесия в однокомпонентных системах. Диаграммы состояния воды и серы. Монотропные и энантиотропные превращения.
Растворы летучих жидкостей. Соотношение между составом раствора и составом пара, равновесного с раствором. Законы Коновалова. Азеотропы. Диаграммы состояния раствор пар в координатах: общее давление состав, температура кипения состав, состав раствора состав пара. Правило рычага. Разделение раствора на компоненты: фракционная перегонка. Перегонка с водяным паром. Равновесие твердое вещество – жидкость в бинарных системах. Физико-химический анализ. Диаграммы плавкости с эвтектикой, химическими соединениями и твердыми растворами.
Равновесие жидкость – жидкость. Ограниченная растворимость двух жидкостей. Распределение компонента в системе несмешивающихся жидкостей. Экстракция.
5
ЛАБОРАТОРНАЯ РАБОТА № 1
Исследование температур кипения разбавленных растворов. Эбулиоскопия
Цель работы
Исследовать зависимость температуры кипения от концентрации разбавленных растворов. Ознакомиться с эбулиоскопическим методом определения молекулярной массы вещества, степени диссоциации и изотонического коэффициента.
Вопросыколлоквиума
1.Растворы: общая характеристика, классификация, способы выражения концентрации.
2.Парциальные молярные характеристики растворов. Уравнения Гиббса – Дюгема.
3.Зависимость давления насыщенного пара от концентрации раствора. Законы Рауля и Генри. Отклонения от законов Рауля.
4.Повышение температуры кипения и понижение температуры замерзания разбавленных растворов, содержащих нелетучее растворенное вещество.
5.Эбулиоскопия и криоскопия.
6.Порядок выполнения работы. Расчет эбулиоскопической постоянной растворителя, молекулярной массы и изотонического коэффициента растворенного вещества.
Приборы и реактивы
1.Эбулиоскоп.
2.Термометр Бекмана.
3.Спиртовка.
4.Исследуемые вещества.
Описание экспериментальной установки
Для расчета эбулиоскопической постоянной растворителя и молекулярной массы растворенного вещества необходимо определить
6
температуры кипения чистого растворителя и растворов. Измерение температуры проводят с помощью термометра Бекмана. Особенность этого ртутного термометра состоит в наличии в его верхней части дополнительного резервуара, в который может быть перелита ртуть из основного резервуара. Это позволяет использовать термометр в различных интервалах температур. Шкала термометра Бекмана имеет условный характер: она рассчитана на 5–6 градусов, а наименьшее деление шкалы составляет 0,01 градуса. С помощью лупы можно отсчитывать температуру по термометру Бекмана с точностью до 0,001 градуса.
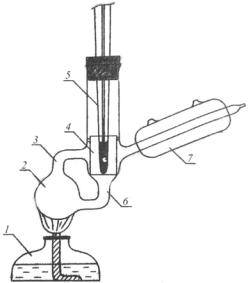
Прибор для определения температур кипения называется эбулиоскопом. В данной работе используется эбулиоскоп Свентославского, схема установки представлена на рис. 1.1.
Рис. 1.1. Установка для эбулиоскопии
В эбулиоскоп наливается исследуемая жидкость, горелка 1 нагревает ее до кипения. Образующиеся пары, захватывая кипящую жидкость из сосуда 2, переносят ее по трубке 3 в пробирку 4. Жидкость тонкой струей омывает термометр 5. В трубке 3 вся избыточ-
7
ная теплота, уносимая жидкостью вследствие ее перегрева, расходуется на превращение соответствующего количества жидкости в пар. Таким образом, в пробирке 4 устанавливается температура кипения жидкости при данном внешнем давлении (равновесие между жидкостью и паром). Пар конденсируется в холодильнике 7 и по трубке 6 возвращается в сосуд 2.
Порядок выполнения работы
1.Определяют температуру кипения чистого растворителя.
Для этого в предварительно промытый дистиллированной водой эбулиоскоп наливают 20–30 см3 растворителя (воды). При этом обращают внимание на то, чтобы уровень растворителя находился на 1 см выше шейки сосуда. Вставляют термометр Бекмана, плотно закрывая эбулиоскоп пробкой (термометр не должен касаться стенок сосуда). В холодильник пускают воду и ставят под прибор спиртовку. Когда столбик ртути появится в шкале термометра, его высота будет колебаться вследствие неравномерного нагрева. Наблюдают за процессом кипения 5–7 мин, записывают максимальную температуру. Затем убирают спиртовку, охлаждают прибор, для того чтобы при последующем извлечении термометра не происходило испарение жидкости и масса растворителя не изменялась. Достают термометр, ставят его в штатив.
2.Определяют температуру кипения растворов. Для этого в эбулиоскоп последовательно добавляют точно рассчитанные навески исследуемого вещества, масса растворителя при этом остается постоянной. Температуру кипения каждого раствора определяют с помощью термометраБекмана, какв п. 1.
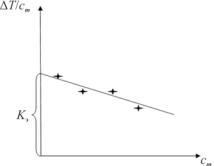
3.Определяют эбулиоскопическую константу растворителя,
построив график зависимости отношения T от моляльности рас- cm
твора cm.
4.Рассчитывают молекулярную массу растворенного вещества.
5.Определяют изотонический коэффициент и степень диссоциации электролита.
8
Определение эбулиоскопической постоянной растворителя и молекулярной массы растворенного вещества
Эбулиоскопическую постоянную растворителя рассчитывают по формуле
Kэ lim |
T . |
(1.1) |
|
cm |
|
Для каждого раствора рассчитывают моляльную концентрацию cm и изменение температуры кипения (по сравнению с чистым растворителем) Т. Затем строят график зависимости отношения
T от моляльности раствора cm. Экстраполируют полученную за- cm
висимость до значения cm = 0 и по оси T определяют значение cm
эбулиоскопической постоянной (рис. 1.2).
Рис. 1.2. Зависимость T от cm cm
Молекулярную массу растворенного вещества (г·моль–1) рассчитывают по формуле
M |
Kэ 1000 m2 i , |
(1.2) |
|
T m1 |
|
|
|
9 |
где Т – разница температур кипения раствора и растворителя, градусы;
Kэ – эбулиоскопическая постоянная растворителя, К·кг·моль–1; m1 – масса растворителя, г;
m2 – масса растворенного вещества, г.
Определение изотонического коэффициента и степени диссоциации электролита в растворе
Для вычисления изотонического коэффициента и степени диссоциации электролита используют измеренные температуры кипения растворителя и растворов электролита с концентрацией 0,1–1 мас. %. Значениеизотоническогокоэффициентарассчитывают поформуле
i |
|
T |
|
(T T0 )M m1 |
, |
(1.3) |
|||
K |
|
с |
|
||||||
|
э |
|
K |
э |
m 1000 |
|
|
||
|
|
m |
|
|
2 |
|
|
||
где Т и Т0 – температуры кипения раствора и растворителя, градусы. Степень диссоциации рассчитывают по формуле
|
i 1 |
|
, |
(1.4) |
|
1 |
|||||
|
|
|
|||
где i – изотонический коэффициент;
ν – число ионов, на которые диссоциирует молекула растворенного вещества.
Рекомендуемый вид таблицы:
Исследуемое вещество: __________________________
Масса растворителя, г: _________
Температура кипения растворителя Т0, градус: ________
Номер |
Концентрация |
Масса |
Моляльность |
Температура |
|
T |
кипения |
Т |
c |
||||
опыта |
раствора, |
растворенного |
раствора cm, |
раствора |
||
мас. % |
вещества, г |
моль·кг –1 |
|
m |
||
|
Т, градус |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10
