
Органические соединения. Часть 1. Углеводороды
.pdf
|
|
+ H2 |
Pd, t° |
|
|
CH3–CH2–CH2–CH2–CH3 |
|
циклопентан |
пентан |
||
Циклогексан и его гомологи при нагревании дегидрируются и превращаются в ароматические углеводороды:
Pd,t°t°
+ 3H2
циклогексан бензол
3.2. Арены
Аренами (ароматическими соединениями) называются углеводороды карбоциклического ряда, в молекулах которых содержится одно или несколько бензольных колец. Общая формула аренов CnH2n-6. Для ряда ароматических углеводородов сохранились тривиальные названия:
|
CH3 |
CH3 |
CH=CH2 |
|
|
CH3 |
|
бензол |
толуол |
м-ксилол |
стирол |
Все шесть атомов углерода в молекуле бензола находятся в sp2- гибридном состоянии. Валентный угол между σ-связями равен 120°. Каждый атом углерода образует σ-связи с двумя другими атомами углерода и в то же время имеет одну негибридизованную p- орбиталь. Все шесть p-электронов взаимодействуют между собой, образуя π-связи, объединенные в единое π-электронное облако. Таким образом, в молекуле бензола осуществляется круговое сопряжение. В результате все связи между атомами углерода в бензоле
31
выровнены и имеют длину 0,139 нм. Это значение является промежуточным между длиной ординарной связи в алканах – 0,154 нм и длиной двойной связи в алкенах 0,133 нм.
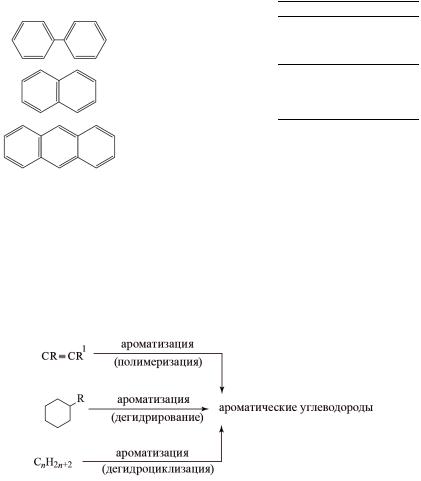
Условно арены можно разделить на две группы. Первая– производные бензола, например, толуол, ксилол. Ко второй группе относятся конденсированные арены или полиядерные. В табл. 3.1 представлены структурныеформулыиназвания наиболеераспространенныхаренов.
|
|
Таблица 3.1 |
Структурныеформулыиназваниянекоторыхаренов |
||
|
|
|
Формула |
Систематическое название |
Тривиальное название |
|
Бензол |
Бензол |
|
|
|
|
Метилбензол |
Толуол |
|
|
|
|
1,2-Диметилбензол |
орто-Ксилол |
|
|
|
|
1,3-Диметилбензол |
мета-Ксилол |
|
|
|
|
1,4-Диметилбензол |
пара-Ксилол |
|
|
|
32
|
|
Окончание табл. 3.1 |
Формула |
Систематическое название |
Тривиальное название |
|
Дифенил |
Дифенил |
|
|
|
|
Нафталин |
Нафталин |
|
|
|
|
Антрацен |
Антрацен |
|
|
|
Для гомологов бензола характерна структурная изомерия, которая обусловлена взаимным расположением заместителей в ядре. Положение заместителей указывают цифрами или приставками: орто-(о-), мета(м-), пара-(п-). Радикал C6H5 называется фенил, а радикал с двумя свободными валентностями –C6H4– называется фенилен.
Лабораторные методы получения аренов представлены на рис. 6.
Рис. 6. Методы получения аренов
Ароматические углеводороды являются малополярными соединениями, и по физическим свойствам во многом подобны свойствам других углеводородов.
Химические свойства. Общие химические свойства аренов приведены на рис. 7.
33
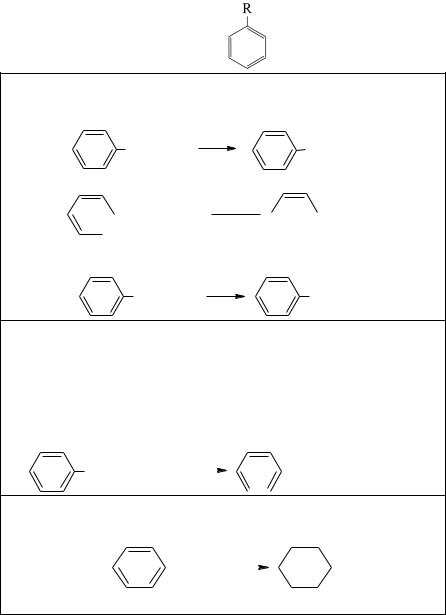
Арены
Замещениеатомаводородавкольце (вприсутствиикатализато-
ров)
1. Галогенирование в присутствии катализатора (FeCl3, AlCl3…)
H + Cl2 FeCl |
Cl + HCl |
3 |
|
2. Нитрование HNO3 в присутствии катализатора H2SO4

 H + HO–NO2 H2SO4
H + HO–NO2 H2SO4


 NO2 + H2O
NO2 + H2O
3. Реакция Фриделя–Крафтса (взаимодействие с галогеналканом, алкеном или хлорангидридом в присутствии катализатора AlCl3)
H+ CH3Cl AlCl3 |
CH3+HCl |
Реакции окисления
1. Горение
2C6H6 + 15O2 = 12CO2 + 6H2O
2. Раствор KMnO4
а) бензол не реагирует; б) у гомологов бензола окисляется боковая цепь и образуется
–СOOH-группа, соединенная с ароматическим кольцом
C3H7 |
|
|
|
|
|
|
COOH + CO2+ H2O |
|
раствор KMnO |
4 |
|||||||
|
|
|
||||||
Реакции присоединения (протекают трудно)
1. Присоединение H2 в присутствии Pt-катализатора и to
+ 3H |
350° |
|
Pt |
||
2 |
Рис. 7. Химические свойства ароматических углеводородов (окончание на с. 35)
34
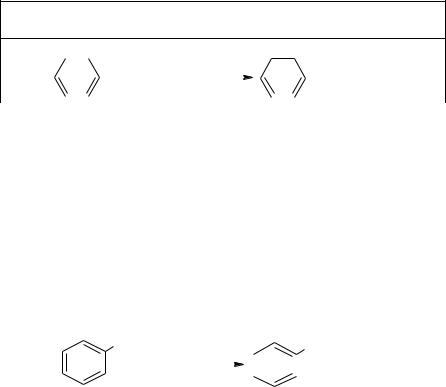
2. Присоединение Cl2 при облучении
С6H6 + 3Cl2 = C6H6Cl6
Хлорирование гомологов бензола при облучении в боковую цепь
|
|
|
|
|
|
CH + Cl |
2 |
облучение |
|
|
|
|
|
CH |
Cl +HCl |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
3 |
|
|
2 |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 7. Окончание |
|
|
|
|
|
|
|
|
Для аренов наиболее характерны реакции, протекающие по механизму электрофильного замещения, обозначаемого символом SE. Реакции присоединения приводят к разрушению ароматической системы и требуют больших затрат энергии, поэтому протекают только при определенных условиях – температуре, высоком давлении в присутствии катализаторов.
По химическим свойствам гомологи бензола имеют ряд особенностей, связанных с влиянием алкильного радикала на бензольное кольцо, и наоборот. Это влияние приводит к тому, что замещается всегда атом водорода у атома углерода, непосредственно связанного с бензольным кольцом:
CH2CH3 |
Cl2 |
, hν |
|
|
|
CHClCH3 |
|
|
|
|
+HCl |
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Замещение в бензольном кольце возможно только по механизму SE в присутствии катализатора AlCl3:
C6H5 – CH3 + Cl2 →AlCl3 Cl – C6H4 – CH3 + HCl
Важным фактором, определяющим химические свойства молекулы, является распределение в ней электронной плотности. Характер распределения зависит от взаимного влияния атомов. В молекулах, имеющих только σ-связи, взаимное влияние атомов осуществляется через индуктивный эффект. В молекулах, представляющих собой сопряженные системы, проявляется действие мезомерного эффекта (M).
35
В молекуле бензола π-электронное облако распределяется равномерно по всем атомам углерода за счет сопряжения. Если в бензольное кольцо ввести заместитель, то равномерное распределение нарушается и происходит перераспределение электронной плотности в кольце. Поэтому место второго заместителя в бензольном кольце будет определяться природой уже имеющегося заместителя.
Заместители делят на две группы в зависимости от проявляемого ими эффекта: электронодонорные и электроноакцепторные.
Электронодонорные заместители повышают электронную плотность в сопряженной системе, в результате электронная плотность сосредотачивается в орто- и пара-положениях. К ним отно-
сятся такие группы, как –CH3, –OH, –NH2, –Cl (–F, –Br, –I). Они называются заместителями или ориентантами первого рода.
Электроноакцепторные заместители снижают электронную плотность в сопряженной системе и направляют электрофильное замещение в мета-положения бензольного кольца. К ним относятся такие группы, как –SO3H, –CCl3, –NO2, –COOH, –CH=O. Они назы-
ваются заместителями или ориентантами второго рода.
36
4.ПЕРЕРАБОТКА НЕФТИ
ИДРУГИХ ПРИРОДНЫХ СОЕДИНЕНИЙ
Важным источником углеводорода является нефть. Это не только топливо, но и ценное химическое сырье для получения различных органических продуктов. Нефть представляет собой сложную смесь жидких и небольшого количества твердых углеводородов различной молекулярной массы.
Углеводороды, входящие в состав нефти, можно разделить на три группы:
1)предельные углеводороды с прямой или разветвленной цепью;
2)пяти- и шестичленные циклоалканы (нафтены) и их гомологи;
3)ароматические углеводороды (бензол и его гомологи). Непредельные углеводороды (алкены) в нефти встречаются до-
вольно редко. В основном они образуются при вторичной переработке нефти. Таким образом, в зависимости от состава все нефти делятся на метановые, нафтеновые и ароматические.
Нежелательной примесью, содержащейся в нефти, является сера
иее соединения (тиолы, сульфиды и др.), которые вызывают коррозию металлических труб и аппаратуры для переработки нефти. В зависимости от количества серы нефти подразделяются на несернистые (серы <0,2 %), малосернистые (0,2–1 %), сернистые (1–3 %), высокосернистые (>3 %). В нефти также содержится большое количество (до 10– 20 %) высокомолекулярных соединений: нефтяных смол и асфальтенов (продукты конденсации смол). В сырой нефти содержится вода
ирастворенные в ней неорганические соли кальция и магния, а также газы (углеводороды с числом углеродных атомов С1–С4).
После очистки нефти ее подвергают переработке. Первичным (основным) процессом переработки является прямая перегонка, т.е. термическое разделение нефти на ее составные части – фракции (физический метод переработки). При этом почти не происходит разложения (деструкции) углеводородов. Разделение основано на различии температур кипения отдельных нефтяных фракций, имеющих
37
разную молярную массу. Как правило, получают бензиновую и керасиновую фракции, мазут, гудрон.
1. Бензиновая фракция – смесь углеводородов с числом углеродных атомов С5–С12. При более тщательной разгонке эта фракция может быть разделена на легкий бензин, или петролейный эфир
(tкип = 40…70 °С), тяжелый бензин (tкип = 40…195 °С) и лигроин
(tкип = 120…235 °С). Первая фракция составляет до 20 % от общего количества нефти.
2. Керосиновая фракция – смесь углеводородов с числом углеродных атомов С9–С16. При температуре 165–200 °С перегоняется легкая фракция керосина – уайт-спирит, который применяется как растворитель для масляных красок и других целей. Затем отгоняет-
ся обычный керосин (tкип = 200…300 °С). При 180–360 °С может быть получено дизельное топливо. Керосиновую фракцию используют как топливо для тракторов и реактивных двигателей.
3. Мазут, который представляет собой смесь углеводородов с большим числом углеродных атомов. Дальнейшая разгонка под вакуумом (во избежание осмоления при высоких температурах) или перегонкой с водяным паром из мазута можно выделить некоторые фракции, известные под общим названием соляровых масел (С12– С20). Эти масла применяют в качестве моторного топлива. Используя перегонку с водяным паром или вакуумную перегонку, из некоторых фракций предварительной разгонки мазута можно выделить смазочные масла (С20–С50), вазелин и смесь твердых углеводоро-
дов – парафин (С19–С35).
4. Гудрон (нефтяной пек), который является остатком после отгонки из мазута вышеупомянутых фракций. Из гудрона вырабатывают битум, используемый в строительстве. Растворы различных гудронов, образующих атмосферо- и коррозионно-стойкие покрытия, применяют в качестве заменителей олифы.
Бензин, полученный прямой перегонкой нефти, непригоден для непосредственного использования в современных двигателях. Его превращают в высокосортный (высокооктановый) бензин путем каталитического риформинга. Этот процесс, протекающий при
38
500 °С, заключается в изомеризации алканов – превращении неразветвленных или малоразветвленных алканов в разветвленные:
R – CH2 – CH2 – CH2 – CH3 кат→
кат→R – CH(CH3 )– CH2 – CH3 + R – C(CH3 )2 – CH3
Для увеличения выхода бензина и повышения его качества некоторые фракции прямой перегонки и мазут подвергают вторичной переработке, связанной с частичным разложением (деструкцией) углеводородов. Эти химические методы переработки основаны на превращениях углеводородов под влиянием температуры, давления
икатализаторов. Особое значение получили различные виды крекинга. С помощью крекинга получают из высококипящих нефтяных фракций (керосин, соляровые масла, мазут) низкокипящие. Различают два основных типа крекинга – термический и каталитический.
Термический крекинг делят на жидкофазный (переработка тяжелых и легких фракций – лигроина, керосина, газойля при 460– 560 °С и давлении 20,26–70,91·105 Па) и парофазный (переработка гудрона, битумов и крекинг-остатков при 550–600 °С и нормальном давлении). Если парофазный крекинг проводят при более высоких температурах (650–700 °С) и атмосферном давлении, то такой процесс называют пиролизом. Он связан с более глубокими изменениями в молекуле углеводорода вплоть до образования элементного углерода (углистого остатка, или кокса). Пиролиз нефти дает смесь ароматических углеводородов (до 15 %). Более половины сырья превращается в газы – алканы и алкены.
Основными процессами при крекинге являются гомолитический разрыв углеродной цепи с одновременной изомеризацией
ициклизацией, а также дегидрогенизация углеводорода с образованием непредельных соединений. Место разрыва углеродной цепи зависит от температуры и давления: с повышением температуры разрыв происходит ближе к краю цепи с образованием устойчивых углеводородов с короткими цепями. С повышением давления цепь разрывается ближе к середине. Например, крекинг
39
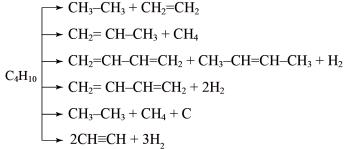
н-бутана в зависимости от условий может идти с образованием следующих веществ:
Термический крекинг – свободнорадикальный процесс. Жидкие и газообразные продукты крекинга разделяются на ректификационной колонне. Наиболее ценная жидкая фракция – бензиновая, но ее химическая устойчивость довольно низкая. Это связано с тем, что в ее состав входят непредельные соединения, которые способны окисляться и образовывать смолообразные продукты. Поэтому в крекинг-бензин добавляют соответствующие ингибиторы.
Каталитический крекинг протекает в присутствии катализаторов (алюмосиликатов или хлорида алюминия) при 480–540 °С и давлении 0,2–0,3 МПа. Процесс начинается с отщепления от алкана
гидрид-иона Н– с образованием карбкатиона (R–(CH2 )n –CH2+ ), кото-
рый распадается потом на непредельное соединение (CH2=CH–R′) и другой карбониевый ион, но с меньшим числом углеродных атомов. Образовавшийся карбкатион может превратиться в два продукта – непредельное (при отщеплении протона) и предельное (при присоединении гидрид-иона) соединения:
- +
R–(СН2)n–СН3 ←+Н R– (СН2)n–СН2+ →-Н R–(СН2)n–1–СН=СН2
Каталитический крекинг – процесс более совершенный, чем термический. Он позволяет получать не только предельные и непредельные углеводороды с более короткими связями, но и углеводороды изостроения. При этом количество непредельных углеводородов уменьшается за счет увеличения содержания бензола и его производ-
40
