
Органические соединения. Часть 1. Углеводороды
.pdfМинистерство образования и науки Российской Федерации
Государственное образовательное учреждение высшего профессионального образования «Пермский государственный технический университет»
ОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
Часть 1 УГЛЕВОДОРОДЫ
Утверждено Редакционно-издательским советом университета
в качестве учебно-методического пособия
Издательство Пермского государственного технического университета
2011
Авторы:
Л.Г. Черанева, Т.К. Томчук, Л.С. Пан, Г.А. Старкова, О.В. Нагорный
УДК 541.1 ББК 24.23я7 О-64
Рецензенты:
канд. хим. наук, доцент М.М. Соколова (Пермский государственный технический университет);
канд. хим. наук А.С. Колышкин (ООО «Фирма „Радиус-сервис“»)
Органические соединения: учеб.-метод. пособие. Ч.1. Уг- О-64 леводороды / Л.Г. Черанева [и др.]. – Пермь: Изд-во Перм. гос.
техн. ун-та, 2011. – 55 с.
ISBN 978-5-398-00610-0
Рассмотрены особенности строения углеводородов, типы химических реакций с указанием механизмов их протекания. Приведены задания для самостоятельной работы студентов и тесты для подготовки к экзамену.
Предназначено для студентов нехимических специальностей дневной, заочной и дистанционной формы обучения, изучающих курс «Органическая химия».
УДК 541.1 ББК 24.23я7
ISBN978-5-398-00610-0 |
©ГОУ ВПО |
|
«Пермскийгосударственный |
|
техническийуниверситет»,2011 |
2
ОГЛАВЛЕНИЕ |
|
1. Основы строения и реакционная способность органических |
|
соединений................................................................................................................................................... |
4 |
1.1. Классификация органических соединений................................ |
4 |
1.2. Номенклатура............................................................................... |
6 |
1.3. Типы органических реакций и их механизмы........................... |
9 |
1.4. Строение органических соединений........................................ |
14 |
2. Ациклические (алифатические) углеводороды .................................................... |
19 |
2.1. Алканы........................................................................................ |
19 |
2.2. Непредельные (ненасыщенные) углеводороды ...................... |
22 |
2.2.1. Алкены.................................................................................. |
22 |
2.2.2. Алкадиены............................................................................ |
24 |
2.2.3. Алкины................................................................................. |
26 |
3. Карбоциклические соединения........................................................................................... |
29 |
3.1. Алициклические соединения. Циклоалканы........................... |
29 |
3.2. Арены.......................................................................................... |
31 |
4. Переработка нефти и других природных соединений...................................... |
37 |
Индивидуальные задания для самостоятельной работы.................................. |
43 |
Задание № 1....................................................................................... |
43 |
Задание № 2....................................................................................... |
46 |
Тесты для подготовки к экзамену......................................................................................... |
49 |
Тест № 1............................................................................................. |
49 |
Тест № 2............................................................................................. |
50 |
Тест № 3............................................................................................. |
52 |
Библиографический список......................................................................................................... |
54 |
3
1. ОСНОВЫ СТРОЕНИЯ И РЕАКЦИОННАЯ СПОСОБНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
1.1.Классификация органических соединений
Воснову современной классификации органических соединений положены два важнейших признака: строение углеродного скелета молекулы и наличие в молекуле функциональных групп.
По строению углеродного скелета органические соединения делят на группы: ациклические, карбоциклические и гетероциклические.
Ациклические (алифатические) соединения, в которых цепь атомов углерода может быть неразветвленной и разветвленной:
ÑÍ 3 – ÑÍ 2 – ÑÍ 2 – ÑÍ 3 |
ÑÍ 2 = Ñ– ÑÍ = ÑÍ 2 |
ÑÍ 3 – ÑÍ – ÑÎ Î Í |
|
| |
| |
|
ÑÍ 3 |
NÍ 2 |
н-бутан |
2-метилбутадиен-1,3 |
α-аминопропановая |
|
|
кислота |
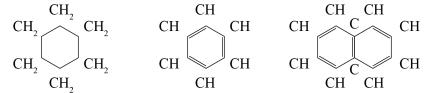
Карбоциклические соединения, в которых цепь, состоящая только из атомов углерода, замкнута в цикл:
циклогексан |
бензол |
нафталин |
Гетероциклические соединения, имеющие в составе циклического скелета, кроме атомов углерода, один или несколько гетероатомов, как правило, атомы азота, кислорода или серы:
4

|
тиофен |
пиридин |
||
Классификация по наличию функциональных групп представ- |
||||
лена в табл. 1.1. |
|
|
||
|
Некоторыефункциональныегруппы |
Таблица 1.1 |
||
|
|
|||
исоответствующиеклассыорганических соединений |
||||
|
|
|
||
Функциональная группа |
Название класса |
Общая формула |
||
Формула |
Название |
класса |
||
|
||||
– |
– |
Углеводороды |
R–H |
|
–F,–Cl,–Br,–I(–Hal) Галогены |
Галогенопроизводные |
R–Hal |
||
–OH |
Гидроксильная |
Спирты |
R–OH |
|
|
|
Фенолы |
Ar–OH |
|
–O– |
Окси |
Простые эфиры |
R–O–R’ |
|
–SH |
Меркапто |
Тиолы |
R–SH |
|
–NH2 |
Амино |
Амины (первичные) |
R–NH2 |
|
|
Нитро |
Нитросоединения |
R–NO2 |
|
|
Карбонильная |
Альдегиды |
R–CH=O |
|
|
Кетоны |
R–CO–R’ |
||
|
|
|||
|
Карбоксильная |
Карбоновые кислоты |
R–COOH |
|
|
Сульфо |
Сульфоновые |
R–SO3H |
|
|
кислоты |
|||
|
|
|
||
Символом R принято обозначать любой углеводородный радикал, символом Ar – ароматический радикал.
Встречается и название «сульфокислоты».
Родоначальными соединениями ворганической химии считаются углеводороды, состоящие только из атомов углерода и водорода. Вбольшинстве своем органические молекулы содержат функциональ-
5
ные группы, определяющие химические свойства соединения и принадлежность его копределенному классу. В состав функциональной группы обязательно входит гетероатом, хотя иногда кфункциональным группам причисляют и углерод-углеродные кратные связи (С=С и С≡С). Многие такие группы вообще не содержат атом углерода. В зависимости от наличия вмолекуле тех или иных функциональных групп органические соединения делятся на классы, важнейшие из которых приведенывтабл. 1.1.
Соединения, имеющие в молекуле одну функциональную группу, называются монофункциональными. Если в молекуле несколько одинаковых функциональных групп, то такие соединения называются полифункциональными, например, хлороформ, глицерин. Гетерофункциональные соединения содержат в молекулах различные функциональные группы. Их можно одновременно отнести к нескольким классам. Например, молочную кислоту можно рассматривать как карбоновую кислоту и как спирт, а таурин – как сульфоновую кислоту и как амин:
|
CH2 – CH – CH2 |
CH3 – CH – COOH |
|||
СНCl3 |
| |
| |
| |
| |
|
OH |
OH |
OH |
OH |
||
|
|||||
хлороформ |
|
глицерин |
молочная кислота |
||
H2N – CH2 –CH2 –SO3H
таурин
1.2. Номенклатура
Номенклатура органических соединений – это система терминов, обозначающих строение веществ и пространственное расположение атомов в их молекулах.
6
Международной номенклатурой в настоящее время является систематическая номенклатура ИЮПАК (IUPAC – Международный союз теоретической и прикладной химии). Среди вариантов систематических номенклатур наиболее распространенной является заместительная номенклатура, которая заключается в том, что в соединении выделяется основа, в которой произведено замещение атомов водорода на другие атомы или группы. Заместитель – это атом или группа атомов, замещающих атом водорода в родоначальной структуре. Функциональная группа – это атом или группа атомов неуглеводородного характера, которые определяют принадлежность соединения к определенному классу.
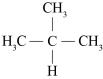
Правила ИЮПАК позволяют употреблять названия органических соединений, построенные на основе устаревших тривиальной и рациональной номенклатур. Тривиальная номенклатура – это совокупность исторически сложившихся названий органических соединений (например, ацетон, уксусная кислота и т.д.). Рациональная номенклатура позволяет строить название вещества на основании его структуры с более простым соединением, выбранным в качестве прототипа. Например, если прототипом является метан, то вещество называется триметилметан:
триметилметан
Приведем некоторые основополагающие принципы составления систематических названий, позволяющие составлять формулы органических веществ, изучаемых в курсе химии:
1. В основу систематических названий положены названия углеводородов, которые содержат столько же атомов углерода, сколько их находится в главной углеродной цепи молекулы. В качестве
7
основных углеводородов используются предельные и ароматические углеводороды и некоторые другие вещества.
2. Главной углеродной цепью в молекуле является самая длинная цепь углеродных атомов (или характерная группа, например, бензольное кольцо).
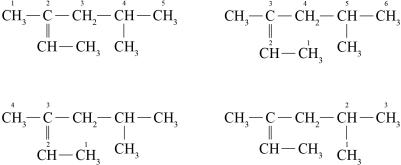
Пример. Назовите по систематической номенклатуре следующее соединение:
Цепь из 5 атомов углерода |
Цепь из 6 атомов углерода |
|
Цепь из 4 атомов углерода |
Цепь из 3 атомов углерода |
В приведенном примере самой длинной цепью является цепь из 6 атомов, основой названия будет слово «гексан».
3.Главнаяуглероднаяцепьдолжнабытьпронумерованаправильно:
•сумма номеров всех атомов углерода, которые имеют заместители, должна быть наименьшей;
•кратная связь (двойная или тройная углеродные связи) должна иметь наименьший возможный номер; если в молекуле имеются
идвойная, и тройная связи, то двойная связь имеет преимущество;
•если имеется несколько возможностей нумерации, то выбирают ту, при которой разветвление получает меньший номер;
•атом углерода в альдегидной или кислотной группе, как правило, должен иметь номер 1 (хотя допускается рассматривать эти группы в качестве заместителя).
4.Записывают названия всех заместителей и указывают цифрой (передназванием)номератомауглерода,укоторогонаходитсязаместитель.
8
5. Кратные связи и функциональные группы:
•кратные связи называют, заменяя суффикс -ан в названии углеводорода, определяющего главную цепь, на соответствующее родовое окончание (например, для алкенов -ен) и указывая цифрой их местонахождение;
•функциональные группы указывают, добавляя соответствующий суффикс к названию углеводорода, например, для спиртов – -ол, альдегидов – -аль, для карбоновых кислот – -овая кислота и др.
6. Несколько заместителей (или связей), имеющих одинаковое название (метил, хлор и т.п.), объединяют префиксами ди- (два), три- (три), тетра- (четыре) и т.д.
7. Заместители перечисляют в алфавитном порядке (русский алфавит), не учитывая умножающие префиксы.
Полное название углеводорода в рассматриваемом примере – 3,5-диметилгексен-2.
1.3.Типы органических реакций и их механизмы
Впроцессе химических реакций происходит разрыв одних и образование новых химических связей. Способность соединения вступать в химическую реакцию и реагировать с той или иной скоростью определяет его реакционную способность.
Ворганической химии встречаются следующие типы химических реакций.
Реакции присоединения. В этом случае из двух (или нескольких) молекул образуется одно новое вещество:
СН2=СН2 + Вr2→CH2Br – CH2Br
этен 1,2-дибромэтан
К реакциям присоединения можно отнести и реакции восстановления (присоединения атомов водорода). Эта реакция является обратной реакции окисления. Действие восстанавливающего реагента обозначается символом [H]:
9
H3C− CO− CH3 [H]→ H3C− CH| − CH3
OH
пропанон пропанол-2
Частным случаем реакции восстановления является гидрирование:
СН2=СН2 →Н2,Pt CH3 – CH3
этен этан
Реакции замещения. В молекуле один атом (или группа атомов) замещается другим атомом (или группы атомов), в результате чего образуются новые соединения:
СН4 + Cl2 →CH3Cl + HCl
метан хлорметан
Реакции отщепления (элиминирование). В результате такой реакции образуется новое вещество, содержащее кратную связь:
СН3 – СН2Br + NaOH→ CH2= CH2 + NaBr + H2O
(спирт.р-р) бромэтан этен
Реакции разложения. Эти реакции приводят к образованию новых веществ более простого строения в результате разложения исходного соединения на два или более:
HCOOH →Pt CO2 +H2
метановая кислота
Перегруппировки. При этом происходит внутримолекулярные перемещения атомов или групп атомов без изменения молекулярной формулы соединений, участвующих в реакции:
10
