
Изучение взаимной растворимости жидкостей в двухкомпонентной системе (120
..pdfCopyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
граммы в координатах T −Х при постоянном давлении. Такие диаграммы, отображающие зависимость состава раствора, выраженного в массовых процентах или в молярных долях, от температуры при P = const, часто называют диаграммами растворимости.
Все жидкости в той или иной степени растворимы друг в друге, oднако эта растворимость настолько различна, что системы можно подразделить на несколько групп:
1)практически нерастворимые друг в друге жидкости: бензин – вода, ртуть – вода и др.;
2)ограниченно взаимно растворимые жидкости. Они растворяются лишь частично, и происходит расслаивание системы на две равновесные фазы: анилин – вода, метиловый спирт – гексан, фенол – вода и др.;
3)жидкости с неограниченной взаимной растворимостью: бензол – хлороформ, метиловый спирт – вода, ацетон – вода и др.
Если две жидкости обладают неограниченной взаимной растворимостью (гомогенная система), то Ф = 1, К = 2 и
C = 3−1 = 2.
Вслучае, когда жидкости практически не смешиваются (масло
вводе), Ф = 2, К = 2 и
С = 3−2 = 1,
т. е. с изменением температуры изменяется состав сосуществующих фаз.
1.5. Фазовые диаграммы для двухкомпонентных систем с ограниченной взаимной растворимостью жидкостей
Пусть два жидких компонента А и В (например, вода и анилин) обладают ограниченной взаимной растворимостью. Тогда при постепенном добавлении одной жидкости к другой при данных значениях температуры и давления сначала происходит их взаимное растворение до известного предела, связанного с образованием насыщенного раствора. Дальнейшее прибавление избытка одной жидкости к другой вызывает расслаивание системы с образованием двух фаз (насыщенного раствора компонента А в компоненте В
11
Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
и насыщенного раствора компонента В в компоненте А), находящихся в равновесии. Влияние давления на состав равновесных фаз невелико, так как объемный эффект перехода одной жидкой фазы в другую очень мал вследствие соизмеримости значений молярных объемов жидких фаз. Для заметного изменения взаимной растворимости двух жидкостей при Т = const необходимо приложить достаточно большое давление. Поэтому при изучении взаимной растворимости жидкостей в зависимости от температуры, давление можно считать постоянным.
Правило фаз Гиббса для систем с ограниченной взаимной растворимостью жидкостей имеет вид
С = К +1−Ф,
так как Р = const, т. е.
С = 2+1−Ф = 3−Ф.
Часто с повышением температуры взаимная растворимость жидкостей увеличивается, что приводит к сближению состава равновесных жидких фаз. Однако в некоторых случаях при повышении температуры взаимная растворимость жидкостей уменьшается. Это связано с тем, что в зависимости от природы системы теплота перехода вещества из одной фазы в другую может быть как положительной, так и отрицательной величиной.
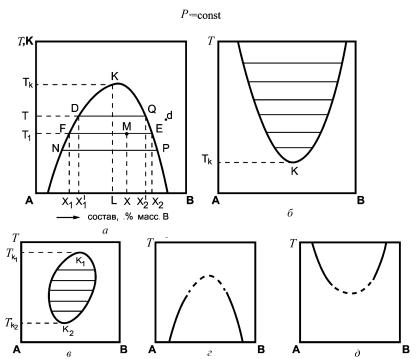
На рис. 1 представлены различные типы фазовых диаграмм для двухкомпонентных жидких систем с ограниченной взаимной растворимостью компонентов. Из рисунка следует, что фазовые диаграммы имеют различный характер. В одном случае (рис. 1, а) кривая растворимости имеет максимум, в другом (рис. 1, б) — минимум, а в третьем случае (рис. 1, в) она представляет собой замкнутую кривую, т. е. имеет максимум и минимум. Кривые, изображенные на рис. 1, называются кривыми расслаивания.
Любая точка на диаграмме состояния системы, которая определяет состав, фазовое состояние и параметры системы, называется фигуративной точкой. На каждой диаграмме любая фигуративная точка, лежащая под кривой расслаивания, т. е. внутри области расслаивания, соответствует гетерогенной смеси жидкостей. Область, лежащая по другую сторону кривой, соответствует гомогенному
12
Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
Рис. 1. Зависимость взаимной растворимости жидкостей от температуры для систем различного типа при постоянном давлении (состав выражен в % масс.)
раствору. Левые ветви кривых характеризуют растворимость компонента В, т. е. поле слева от кривой расслаивания характеризует раствор компонента В в компоненте А, поле справа — раствор компонента А в компоненте В (гомогенные системы), см., например, точку d на рис. 1, а. Для областей cлева от кривой расслаивания на фазовых диаграммах С = 2+1−1 = 2.
В гетерогенной системе внутри области расслаивания, ограниченной кривой расслаивания, составы фаз, находящихся в равновесии, определяются по правилу соединительной прямой: фигуративная точка, отображающая состав системы в целом, и точки, характеризующие составы равновесных фаз, лежат на одной прямой, параллельной оси состава системы.
13
Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
Например, для фигуративной точки М (cм. рис. 1, а) состав всей системы в целом определяется точкой Х на оси абсцисс. Проведя линию FE параллельно оси абсцисс, получим точки F и Е, соответствующие двум равновесным жидким фазам состава Х1 и Х2. Число степеней свободы С для любой фигуративной точки, лежащей внутри области расслаивания, например точки М (см. рис. 1, а), равно С = 2+1−2 = 1.
Фигуративные точки (например, F и Е), отображающие составы двух фаз, находящихся в равновесии, называются сопряженными точками, а линии, соединяющие сопряженные точки (например, FE), называются нодами.
На рис. 1 ноды показаны горизонтальными линиями. Как видно на рисунке, по мере приближения к точкам максимума или минимума ноды становятся короче, а в точке K составы жидких слоев становятся тождественными. Точка K является критической точкой, а температура ТK, при которой составы двух равновесных жидких фаз одинаковы и компоненты полностью смешиваются между собой, называется критической температурой растворимости.
Наиболее распространены системы с верхней критической температурой растворимости (см. рис. 1, а). К ним относятся системы анилин — вода, фенол — вода, гексан — нитробензол и др. Системы триэтиламин — вода, диэтиламин — вода и другие имеют нижнюю критическую температуру растворимости
(см. рис. 1, б). В этом случае при температуре ниже критической вплоть до температуры кристаллизации жидкости смешиваются во всех соотношениях (гомогенная область). Известны также системы, обладающие как верхней, так и нижней критическими температурами растворимости: метилпиперидин — вода, никотин — вода и др. (см. рис. 1, в). Экспериментальное изучение взаимной растворимости жидкостей показало, что во многих системах не реализуются ни верхняя, ни нижняя критические температуры растворимости. В этом случае кривые расслаивания остаются незамкнутыми (см. рис. 1, г, д). Это объясняется тем, что температура кипения или температура кристаллизации смеси достигается раньше критической температуры растворимости. Опытным путем показано, что системы в критическом состоянии инвариантны, т. е.
14
Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
в точке K при постоянном давлении значениe С = 0. Это положение полностью подтверждается термодинамикой и связано со специфическими особенностями критического состояния системы.
Для определения критической температуры растворимости В.Ф. Алексеев предложил использовать правило прямолинейного диаметра, по которому среднее арифметическое из состава равновесных жидких фаз является линейной функцией температуры (правило прямолинейного диаметра Алексеева). Это правило можно сформулировать следующим образом: середины нод, расположенные между точками, отображающими составы равновесных фаз при разных значениях температуры, лежат на одной прямой, идущей от критической точки (прямая KL на рис. 1, а).
Точка пересечения прямой KL с кривой расслаивания отвечает критической точке K, а следовательно, критической температуре растворимости.
По фазовой диаграмме можно определить состав системы и количественное соотношение фаз в любой точке. Например, в точке М (см. рис. 1, а) общий состав смеси Х , состав первой фазы — Х1, состав второй фазы — Х2, а относительные количества фаз можно определить по правилу рычага: фигуративная точка, отображающая состав всей системы, делит проходящую через нее ноду на отрезки, обратно пропорциональные массам равновесных фаз.
Для точки М , согласно правилу рычага,
mж1 |
= |
ME |
(13) |
|
|
|
, |
||
mж2 |
|
|||
|
MF |
|
||
где mж1 и mж2 — массы соответственно первой фазы (состава Х1) и второй фазы (состава Х2).
Изучение фазовых диаграмм жидкостей с ограниченной взаимной растворимостью имеет важное значение для многих областей практической деятельности, так как позволяет выбрать составы, при которых смеси жидкостей в заданных условиях не расслаиваются.
15
Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
2. ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
Цель работы: 1) по экспериментальным данным построить диаграмму растворимости системы фенол — вода;
2)определить критическую температуру растворимости жидкостей;
3)проанализировать диаграмму растворимости по правилу фаз Гиббса.
Для изучения взаимной растворимости жидкостей используют метод В.Ф. Алексеева. Он заключается в том, что берут ряд запаянных ампул с известным содержанием исследуемых веществ. Ампулы помещают в термостатированную стеклянную водяную баню, температуру которой постепенно повышают. При этом ампулы для перемешивания смеси непрерывно встряхивают. Для каждой ампулы определяют температуру гомогенизации, т. е. температуру, при которой система становится однородной.
Проверяют найденные значения температуры гомогенизации, медленно охлаждая водяную баню. При этом отмечают температуру гетерогенизации, т. е. температуру, при которой начинается выделение кристаллов на стенках каждой ампулы и жидкость вновь становится мутной. Разность измеряемых значений температуры не должна превышать 1 ◦С. Среднее из полученных значений позволяет определить температуру, при которой исследуемые вещества растворимы друг в друге в том соотношении, в котором они были взяты в каждой ампуле.
Лабораторная работа состоит из двух частей:
1)определение температуры гомогенизации (режим нагрева);
2)определение температуры гетерогенизации (режим охлажде-
ния).
2.1.Порядок выполнения работы
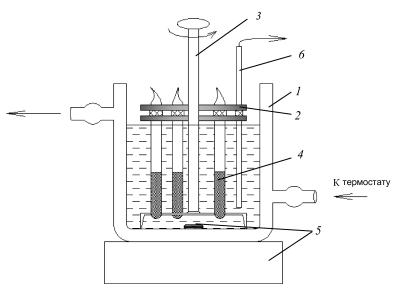
1.Собрать установку для определения взаимной растворимости жидкостей в соответствии с рис. 2.
2.Налить в водяную баню 1 л дистиллированной воды (до метки). Погрузить в водяную баню магнитную мешалку и термопару. Водяная баня снабжена рубашкой, в которую должна непрерывно поступать вода из термостата.
16
Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
Рис. 2. Установка для изучения взаимной растворимости жидкостей:
1 – термостатированная стеклянная водяная баня с дистиллированной водой; 2 – кассета для крепления ампул; 3 – устройство для поворота и встряхивания ампул; 4 – ампулы со смесью фенола и воды заданного состава; 5 – магнитная мешалка; 6 – термопара, соединенная с измерительным блоком компьютера
3.Взять семь пронумерованных и запаянных ампул, содержащих смесь фенола и воды различного состава (табл. 1), и поместить их в кассету. Кассету с ампулами погрузить в водяную баню
ивключить магнитную мешалку, установив скорость вращения на деление «50».
4.Подготовить термостат к работе. Для этого залить в термостат 8 л дистиллированной воды. После включения термостата (белая квадратная кнопка) загорится зеленая индикаторная лампа. Открыть кран 7 (рис. 3) и подать к термостату холодную водопроводную воду.
Определение температуры гомогенизации (режим нагрева)
1. Установить мощность нагрева воды в термостате на деление «250», температура нагрева воды 90 ◦С.
17
Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
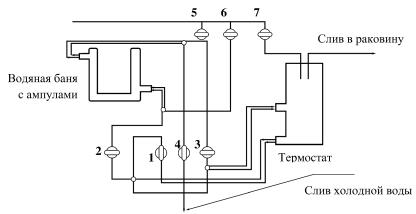
Рис. 3. Схема подачи воды для нагрева и охлаждения водяной бани с ампулами:
1—7 — краны термостата
2.К первому разъему измерительного блока компьютера подсоединить термопару для измерения температуры до 100 ◦С.
3.В меню программы «L – Химия – Практикум» выбрать сценарий «Датчики: температура 0 — 100 ◦С (длинный датчик) →
→зависимость от времени».
4.Подключить водяную баню с ампулами к термостату по большому контуру (см. рис. 3). Для этого открыть краны 2 и 3. Через кран 2 вода из термостата поступает в рубашку водяной бани, а через кран 3 возвращается в термостат. Вода в этом случае не нагревается, и по большому контуру циркулирует вода комнатной температуры.
Необходимо проследить, чтобы были открыты краны 7, 2, 3 и закрыты краны 1, 4, 6 (проверить воду на слив).
5.Поворотом ручки вправо включить режим нагрева термостата. При этом загорится желтая индикаторная лампа. Одновременно с включением режима нагрева воды в термостате нужно нажать экранную кнопку компьютера «Пуск» и перейти к измерениям. Программа начинает записывать температуру в водяной бане и фиксировать время (в секундах) в непрерывном режиме.
6.Кассету с ампулами периодически встряхивать для перемешивания смеси, не извлекая ее из водяной бани.
18
Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
7. Внимательно следить за состоянием смеси компонентов в ампулах и, как только мутная смесь в ампуле станет прозрачной, зафиксировать температуру гомогенизации. При этом учитывать
последовательность перехода смесей компонентов заданного состава при нагреве в однородное состояние: ампула 1, ампула 7, ампула 6, ампула 2, ампула 5, ампула 3, ампула 4.
Определение температуры гетерогенизации (режим охлаждения)
1.Выключить нагревательную систему термостата (при этом желтая индикаторная лампа должна погаснуть). Включить систему охлаждения термостата (малый контур циркуляции, см. рис. 3). Для этого открыть кран 1 и закрыть краны 2 и 3. Таким образом, при охлаждении термостата должны быть открыты краны 7 и 1.
2.Приступить к охлаждению водяной бани с ампулами. Для этого открыть сначала кран 4 (слив воды в канализацию), а затем очень осторожно открыть кран 6 так, чтобы вода из крана 4 сливалась по каплям. Таким образом, при открытых кранах 7, 1, 4, 6 рубашка водяной бани с ампулами непосредственно подсоединена к холодной воде. При охлаждении внимательно следить за появлением кристаллов на стенках ампул и помутнением жидкости. Этому моменту соответствует температура гетерогениза-
ции, которую нужно зафиксировать для каждого состава смеси
вследующем порядке: ампула 4, ампула 3, ампула 5, ампула 2,
ампула 6, ампула 7, ампула 1.
3.По окончании работы закрыть краны в последовательности 7, 6, 1, 4 и отключить термостат. При этом зеленая индикаторная лампа должна погаснуть. Выключить компьютер.
2.2. Оформление отчета
1.Экспериментальные данные занести в табл. 1.
2.По полученным данным построить диаграмму растворимо-
сти.
3.Проверить применимость к данной системе правила прямолинейного диаметра Алексеева. Определить критическую температуру растворимости.
19
Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис»
|
|
|
|
|
Таблица 1 |
|
|
|
|
|
|
|
|
Номер |
Состав смеси, |
Температура, ◦С |
|
|
||
% масс. |
|
|
||||
ампулы |
|
|
|
|
|
|
Фенол |
Вода |
гомогенизации |
гетерогенизации |
|
средняя |
|
|
|
|||||
|
(Т1) |
(Т2) |
|
(Тср) |
||
|
|
|
|
|||
1 |
90 |
10 |
|
|
|
|
|
|
|
|
|
|
|
2 |
20 |
80 |
|
|
|
|
|
|
|
|
|
|
|
3 |
30 |
70 |
|
|
|
|
|
|
|
|
|
|
|
4 |
40 |
60 |
|
|
|
|
|
|
|
|
|
|
|
5 |
50 |
50 |
|
|
|
|
|
|
|
|
|
|
|
6 |
60 |
40 |
|
|
|
|
|
|
|
|
|
|
|
7 |
70 |
30 |
|
|
|
|
|
|
|
|
|
|
|
4. Рассмотреть диаграмму растворимости по правилу фаз Гиббса, получив задание у преподавателя.
3. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1. При смешивании n-нитрогидрохинона с водой произошло расслоение смеси на два раствора: раствор воды
вn-нитрогидрохиноне (раствор 1) и раствор n-нитрогидрохинона
вводе (раствор 2).
Составы растворов при различных значениях температуры приведены в табл. 2.
Таблица 2
Раствор |
|
|
|
T, K |
|
|
|
|
|
|
|
|
|
|
|
||
363 |
368 |
373 |
378 |
383 |
388 |
393 |
||
|
||||||||
|
|
|
|
|
|
|
|
|
1, % масс. H2O |
29,5 |
31,3 |
33,0 |
35,0 |
38,3 |
43,0 |
58,5 |
|
2, % масс. H2O |
80,0 |
79,7 |
78,8 |
78,0 |
76,2 |
72,5 |
58,5 |
1. Построить диаграмму растворимости системы n-нитрогид- рохинон — вода.
20
