
- •Понятие об эквиваленте. Эквивалент сложных веществ. Изменение эквивалента веществ, при вступлении их в химические реакции. Закон эквивалентов.
- •Теоретические основы объемного анализа. Классификация методов объемного анализа по реакции, лежащей в их основе и по способу титрования. Расчеты, применяемые в объемном анализе.
- •Перманганатометрия. Определение активности каталазы крови.
- •Йодометрия. Определение содержания чистой аскорбиновой кислоты в витамине c.
- •Окислительно-восстановительные реакции. Зависимость эквивалента окислителя и восстановителя от реакции среды.
- •Типы окислительно-восстановительных реакций.
- •Аргенометрия. Методы Мора и Фольгарда.
- •Термохимические уравнения и расчеты. Закон Гесса и следствия из него. Стандартные теплоты сгорания и образования и их применение для термохимических расчетов.
- •Обратимые и необратимые по направлению реакции. Понятия о химическом равновесии. Принцип Ле-Шателье.
- •Химическая кинетика, как основа для изучения скоростей и механизма биохимических процессов. Средняя скорость реакции.
- •Закон действующих масс. Константа скорости реакции. Зависимость скорости реакции от концентрации.
- •Молекулярность и порядок реакции. Лимитирующая стадия процесса.
- •Типы сложных химических реакций.
- •Уравнение кинетики реакции 1 порядка. Период полупревращения.
- •Уравнения кинетики реакции 2 порядка.
- •Зависимость скорости реакции от температуры. Температурный коэффициент скорости реакции (правило Вант-Гоффа).
- •Энергия активации. Уравнение Аррениуса.
- •Катализ и катализаторы. Гомогенный, гетерогенный и микрогетерогенный катализ.
- •Ферменты как биологические катализаторы и их классификация.
- •Ферментативный катализ. Уравнение Михаэлиса-Ментен и его анализ.
- •Способы выражения концентрации растворов.
- •Коллигативные свойства растворов. Закон Рауля и следствия из него.
- •Осмос и осмотическое давление. Закон Вант-Гоффа. Изотонический коэффициент.
- •Понижение температуры замерзания растворов. Криоскопическая постоянная.
- •Повышение температуры кипения растворов. Эбуллиоскопическая постоянная.
- •Роль осмоса и осмотического давления в биологических системах. Плазмолиз. Гемолиз.
- •Теория кислот и оснований. Сильные и слабые электролиты. Степень диссоциации.
- •Константа диссоциации. Закон разбавления Освальда.
- •Электролиты в организме человека.
- •Протолитическая теория кислот и оснований.
- •Диссоциация воды. Ионное произведение воды. Водородный показатель.
- •Гидролиз солей. Степень гидролиза.
- •Константа гидролиза соли, образованной сильным основанием и слабой кислотой (вывод уравнения).
- •Константа гидролиза соли, образованной слабым основанием и сильной кислотой (вывод реакции).
- •Константа гидролиза соли, образованной слабым основанием и слабой кислотой.
- •Ступенчатый гидролиз солей. Связь константы гидролиза со степенью гидролиза.
- •Буферные системы и механизм их действия. Буферная емкость и факторы ее определяющие.
- •Уравнение Гендерсона-Гассельбаха для расчета pH буферных систем (вывод).
- •Буферные системы крови.
- •Методы получения коллоидных растворов.
- •Методы очистки коллоидных растворов. Искусственная почка.
- •Строение коллоидных частиц. Строение мицеллы.
- •Электрокинетические явления. Электрофорез. Электроосмос. Потенциалы протекания и седиментации.
-
Электролиты в организме человека.
Электролиты выполняют в организме важную роль: отвечают за осмолярность и величину ионной силы биосред, образуют биоэлектрический потенциал, катализируют процессы обмена веществ, стабилизируют определенные ткани (костная), служат в качестве энергетических депо (фосфаты), участвуют в свертывающей системе крови. Для практики полезно запомнить, что физиологическими растворами являются 1 / 6 моль/л растворы солей, молекулы которых полностью диссоциируют на 2 иона, и 1/3 моль/л растворы растворов неэлектролитов (например, 1/3 моль/л раствор глюкозы). Коллоидные растворы клеток и биологических жидкостей находятся в соприкосновении с электролитами. Поэтому при введении в организм какого-либо электролита надо учитывать не только его концентрацию, но и заряд ионов.
-
Протолитическая теория кислот и оснований.
В 1923г. Бренстед и Лoури предложили протолитическую теорию кислот и оснований. Согласно этой теории к кислотам относятся вещества, способные отдавать протоны, а к основаниям – вещества, способные их присоединять. Поскольку отдача протона кислотой – процесс обратимый, то получившийся при этом остаток кислоты может снова присоединить протон и, следовательно, будет основанием. Поэтому с каждой кислотой сопряжено основание, в которое она переходит, теряя протон.
Все реакции кислотно-основного взаимодействия по этой теории состоят в обратимом перенос протона от кислоты к основанию. В результате такого процесса образуется пара новых частиц, одна из которых способна отдавать протон, а другая его принимать. Таким образом, кислота оказывается в равновесии с сопряженным основанием, а основание – с сопряженной кислотой.
Соединения, которые могут быть как кислотами, так и основаними, называются амфипротными, или амфолитами. К ним относятся вода, продукты ступенчатой диссоциации многоосновных кислот (HPO42-,HC2O-4 ) и т. д., поскольку они могут и присоединять, и отдавать протон.
-
Диссоциация воды. Ионное произведение воды. Водородный показатель.
Вода - слабый электролит, по упрощенной схеме ее диссоциацию можно представить следующим уравнением: Н2 О =Н + + ОН
В
условиях равновесия константа диссоциации
воды
Кд,с=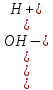
Поскольку степень диссоциации воды очень мала, то концентрацию недиссоциированных молекул можно принять равной молярной концентрации жидкой воды. Поэтому при Т=const [H+[OH]] = Kд,с[H2O] =const.
Произведение концентраций ионов [H+] и [ОН] называется ионным произведением воды и является постоянной величиной при неизменной температуре и при 298К составляет: [H+[ОН]] = K(H2O) = KВ = Kw = 10–14
Ионное произведение воды Кw увеличивается с ростом температуры, так как диссоциация воды –эндотермический процесс. (KW(100010C) = 6-13)
Для указания концентрации ионов водорода в растворе используют так называемый водородный показатель: pH = –lg[H+], При температуре 298 К рН + рОН = 14, поэтому в чистой воде [H+] = [ОН10] = 1–7 моль/л, следовательно, рН = рОН = 7; в кислотной среде [H+] > [ОН], следовательно, рН < 7, а рОН > 7; в щелочных растворах [H+] < [ОН], поэтому рН > 7, а рОН < 7.
