
- •Введение
- •Общее понятие об экосистемах
- •1.1. Экосистема и плодородие
- •Биотехнология
- •Плодородие
- •2. Химическая природа кальция
- •0,560 СаО СаСо3 1,785
- •2,497 СаСо3 Са 0,400
- •3. Кальций в земной коре
- •4. Кальций в почвах
- •4.1. Цеолиты и специфическая роль в них кальция
- •4.2. Активность ионов кальция и водорода в мощном черноземе
- •4.3. Кальций и фосфаты в почвах и растениях
- •4.4. Гипсование и известкование почв
- •5. Кальций в природных водах
- •5.1. Состав и свойства воды как растворителя по а.М. Никанорову и др.
- •5.2. Химизм природной воды
- •6. Кальций в организмах
- •6.1. Кальций в растениях
- •6.1.1. Влияние кальция на корневую систему растений и рН
- •6.1.2. Соединения кальция в растениях
- •6.1.3. Питательная среда и специфическая роль кальция
- •6.1.4. Повышение устойчивости растений под влиянием кальция
- •6.1.5. Кальций в жизни растений
- •6.2. Кальций в организме человека и животных
- •6.2.1. Транспорт ионов кальция, мембранные рецепторы и внутриклеточный кальций
- •6.2.2. Значение кальция в жизни организмов
- •7. Экологические функции кальция
- •7.1. Сорбирование урана поверхностью карбонатов
- •Заключение
- •Литература
4. Кальций в почвах
Уж как хотите, верьте иль не верьте,
А почва – это океан бессмертья.
Всего два метра глубиной, но – чудо! –
Туда уходят, чтоб взойти оттуда.
Егор Исаев, 1987
Кальций играет важную роль в процессах почвообразования, он входит состав почвенного поглощающего комплекса, участвует в обменных реакциях почвенного раствора, обусловливая высокую буферную способность почв в кислом интервале среды. Гуматы кальция играют также важную роль в формировании структуры почвы, во многом обеспечивая ее прочность. Кроме того, кальций активно участвует в процессах осаждения полуторных окислов марганца, нередко формируя конкреционные образования совместно с этим элементом и кремнеземом (Орлов Д.С., Безуглова О.С., 2000).
Миграционная способность кальция во многом определяется почвенно-климатическими условиями. В гумидном климате при активном развитии в почвах процесса выщелачивания он выносится в реки, озера, моря и океаны. Кларк кальция в Мировом океане равен 0,04%. В океанической воде он не задерживается, а концентрируется в скелетах организмов и после их гибели осаждается на дно преимущественно в форме СаСО3. Известковые илы широко распространены во всех океанах на глубине не более 4 тыс. м. И.Р. Форстер, пожалуй, первым осмыслил и оценил грандиозную созидательную деятельность живых организмов, благодаря которой возникают известковые массивы. Правда, еще за 40 лет до И.Р. Форстера великий шведский натуралист Карл Линней сказал: "Omne calx ex wermibus" ("Весь известняк из червей"), подразумевая под червями всех беспозвоночных. Сказал, но дальше этого не пошел. И.Р. Форстер же, вернувшись из плавания, опубликовал книгу, где изложил свои взгляды, которые вскоре нашли развитие в трудах многих ученых.
В аридном и супераридном климате кальций выпадает из растворов в виде карбонатов, формируя мощные толщи карбонатных пород и иллювиально-карбонатные горизонты в почвах. С выщелачиванием кальция из известняковых массивов связано развитие карста, образование пещер, сталактитов и сталагмитов.
В почвах кислого ряда, характеризующихся значительным проявлением процесса выщелачивания, наблюдается явление биогенного накопления кальция в подстилке и аккумулятивных поверхностных горизонтах. Обусловлено это той важной ролью, которую выполняет этот элемент в растительных организмах. В ходе геологической истории росло биогенное карбонатообразование, а химическое осаждение кальцита уменьшалось. Постепенно изменяется и размер вовлечения кальция в биологический круговорот. Подсчитано, что в доисторический период его потребление с приростом составляло 137 кг/га в год. Весь этот кальций возвращался в почву с опадом растений, т.е. малый биологический круговорот кальция носил почти замкнутый характер. В настоящее время ситуация коренным образом изменилась: растительность полей выносит ежегодно только 30-50 кг/га кальция, но большая его часть отчуждается с урожаем (Орлов Д.С., Безуглова О.С., 2000).
Но нарушение биогеохимического круговорота кальция в настоящее время происходит не только и не столько за счет отчуждения части его с сельскохозяйственной продукцией, но и за счет использования карбонатных пород в строительстве, сельском хозяйстве (известкование почв), металлургической промышленности (рис. 5).
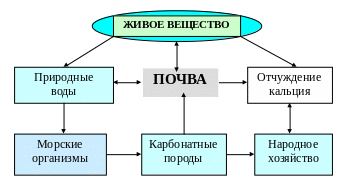
Рис. 5. Биогеохимическая схема превращения кальция
Согласно расчетам В.В.Добровольского (1998), масса кальция, вовлеченного в годовой биологический круговорот, составляет 3,4∙109 т/год. С континентальным стоком в форме катионов Са2+ выносится около 0,5∙109 т/год этого элемента; несколько меньшее количество удаляется с твердым стоком - 0,471∙109 т/год. Кроме того, с поверхности суши в океан с пылью, содержащейся в воздухе, выносится 0,048∙109 т/год кальция. Его средняя концентрация в океанических атмосферных осадках, согласно расчетам B.C. Савенко (1976), равна 0,36 мг/л. Следовательно, в осадках, образующихся в течение года над Мировым океаном, содержится 164∙106 т кальция; 20% "сухих" осаждений - 32,8∙106 т. По данным В.В. Добровольского (1998), общая масса кальция, поступающая на протяжении года из океана в атмосферу, составляет около 197∙106 т. Примерно 22∙106 т, по его подсчетам, переносится с океаническими воздушными массами на сушу, а остальные вновь возвращаются в океан. Средняя концентрация кальция в атмосферных осадках над сушей 3 мг/л. Следовательно, утверждает В.В. Добровольский (1998), в осадках, выпадающих на протяжении года на поверхность Мировой суши, содержится 339∙106 т этого элемента. С учетом 20% на «сухое» осаждение (68∙106 т) общая масса кальция, участвующая в годовом обмене суша-атмосфера, составляет 407∙106 т.
Валовое содержание кальция в почве колеблется от 0,1 до 2,0%. Почвы, образованные из продуктов выветривания известняков, могут содержать до 10% этого элемента. Высоким содержанием кальция отличаются и почвы низинных торфяников. Содержание кальция в почве, прежде всего, зависит от материнской породы и степени ее выветривания. В аридисолях содержится приблизительно 5% кальция, альфисоли и оксисоли содержат его соответственно 1,0 и 0,6%.
Кальций в почве представлен в виде водорастворимых солей, обменно-поглощенных ионов, а также кальцием, входящим в состав кристаллических решеток минералов и органического вещества почвы.
При характеристике почв определяют валовое содержание, обменный и водорастворимый кальций. Согласно К.К. Гедройцу (1955), растения могут использовать только кальций водорастворимый и обменный. Почвы с высоким содержанием обменного кальция обладают наиболее ценной агрономической структурой и другими благоприятными физическими и физико-химическими свойствами, обеспечивающими высокое плодородие. Наиболее богаты обменным кальцием черноземы; при переходе от черноземов к югу в зону каштановых, а затем сероземных почв, и к северу в зоны серых лесных и дерново-подзолистых почв, содержание обменного кальция снижается. При недостаточной насыщенности почв обменным кальцием применяют известкование и гипсование. Известкование - очень старый способ улучшения бедных почв. Значение рН солевой суспензии почвы показывает степень насыщения поглощающего комплекса водородом; путем титрования с добавлением кальция легко может быть определено количество основания, нужное для доведения рН до нейтрального значения, и, исходя из результатов таких определений, даются надежные практические рекомендации по известкованию. Возможно, именно потому, что нет никаких трудностей в определении "доступности" кальция в почвах и в составлении практических рекомендаций для внесения дополнительной извести, по мнению Дж. У. Кука (1970; 1975), существует тенденция пренебрегать кальцием в почвенно-агрохимических исследованиях.
Наиболее распространенными кальцийсодержащими минералами являются карбонат кальция (СаСО3) и доломит - CaMg(CO3)2. В небольшом количестве встречаются гипс (CaSO4∙2H2O), различные фосфаты кальция и апатиты. Из силикатных минералов особенно богаты кальцием плагиоклаз, пироксены и амфиболы. В числе других минералов, содержащих этот элемент, в почвах встречаются полевой шпат, роговая обманка и эпидот. Они входят в состав изверженных и метаморфических пород, медленно выветриваются и играют гораздо меньшую роль в питании растений кальцием, чем карбонаты или сульфаты.
Растворимость кальцийсодержащих минералов в почве зависит от величины рН и содержания диоксида углерода. При подкислении она резко возрастает. Причем, карбонат кальция встречается в почве только при значениях рН выше 7,0 и определяет содержание этого элемента в почвенном растворе. Растворение карбонатов кальция и доломита углекислым газом, выделяемым при разложении микроорганизмами органических веществ и дыхании корней растений. Процесс выветривания карбонатов имеет большое значение для разрушения известняковых и доломитовых пород, обезызвествления карбонатных осадочных отложений, таких как лесс и ледниковый валунный мергель, и карбонатных почв. Вначале образуется хорошо растворимый гидрокарбонат кальция, диссоциирующий на ионы Са2+ и НСО3-. Ионы водорода нейтрализуются с образованием СО2 и Н2О. В результате обменной реакции появляются свободные ионы Са2+, часть которых образует соли с различными ионами почвенного раствора, а основная их доля обменно адсорбируется глинистыми минералами и гуминовыми кислотами:
СаСО3 + СО2 + Н2О → Са(НСО3)2 → Са2+ + 2НСО3-,
2НСО3- + 2Н+ → 2Н2СО3 → 2СО2 + 2Н2О;
или СаСО3 + 2Н+ → Са2+ + СО2 + Н2О
Кальций доминирует среди обменных катионов почвенного поглощающего комплекса. На его долю приходится 40-75 % катионообменной емкости большинства почв. Исключение составляют содержащие натрий щелочные почвы, кислые почвы с высоким содержанием алюминия и водорода, а также сформированные на серпентинитах богатые магнием почвы. В пахотном горизонте черноземов Са2+ составляет 70-95 % емкости катионного обмена, Mg2+- 3-11 %, К+ - 0,3-5 %, Na+ - 0,2-5 %, Н++А13+ - 0-0,15 %, а у кислых подзолистых почв, напротив, Са2+ - 5-25 %, Mg2+ - 0,2-3 %, К+ - 0,2-3 %, Na+ - следы, Н++А13+ - 70-90 %. Высокое насыщение многих почв кальцием обусловлено легким выветриванием кальцийсодержащих минералов, меньшей мобильностью его двухвалентного катиона по сравнению с одновалентными ионами.
Обменный кальций находится в равновесии с кальцием почвенного раствора, и это равновесие регулируется относительной силой его закрепления в ППК, которая, в свою очередь, зависит от природы катионообменных участков, дополнительных катионов и концентрации анионов в почвенном растворе. Содержание ионов кальция в почвенном растворе во много раз превосходит концентрацию других катионов. Оно составляет 100-300 мг/кг, что почти в 2 раза выше концентрации Mg2+, в 10 раз - К+. Высокое насыщение многих почв кальцием обусловливает практически всегда полное обеспечение растений этим элементом. Недостаток кальция возникает очень редко. Но все же такое явление можно ожидать в солонцеватых почвах, где поступление этого элемента в растения сильно задерживается присутствием значительного количества поглощенного натрия (Кауричев И.С., Александрова Л.Н., Гречин И.П. и др., 1982).
Велика роль кальция в регулировании реакции почвенного раствора, формировании структуры почвы и содействии деятельности микроорганизмов.
В почвах избыточное количество кальция не может сохраняться в необменной, но потенциально доступной форме, таким же образом, каким большинство почв "фиксирует" калий в межпакетном пространстве кристаллической решетки, и тем самым предотвращает его вымывание. Однако некоторое количество кальция может быть удержано в почвенных минералах.
Размер потерь кальция из почв, обусловленных вымыванием, зависит от количества атмосферных осадков, удобренности, валовых запасов элемента, характера рельефа и механического состава и варьирует от 50 до 350 кг/га. Как свидетельствуют результаты исследований И.Г. Юлушева (1985), полученные в лизиметрическом опыте, за год из дерново-подзолистой почвы кальция вымывалось 120-160 кг/га.
Таблица 6. Концентрация и вынос веществ с талыми водами на черноземах
в зависимости от их использования (Иванов, 1977)
Показатели |
Зябь |
Озимая пшеница |
Клевер |
Водосбор (зябь, клевер) |
Пруд Спартак |
Сухой остаток |
192 77 |
150 75 |
199 89 |
172 86 |
172 0 |
Прокаленный остаток |
145 58 |
96 48 |
117 70 |
116 58 |
96 0 |
Нитратный азот |
3,0 1,2 |
5,3 2,6 |
5,5 3,3 |
4,9 2,4 |
2,6 0 |
Аммиачный азот |
2,8 1,1 |
1,7 0,9 |
2,6 1,6 |
2,7 1,3 |
7,0 0 |
Нитратный + + аммиачный азот |
5,8 2,3 |
7,0 3,5 |
8,1 4,9 |
7,6 3,7 |
9,6 0 |
Общий фосфор |
0,6 0,2 |
0,2 0,1 |
3,0 1,8 |
2,8 1,4 |
1,2 0 |
Общий калий |
2,0 0,8 |
1,6 0,8 |
6,4 3,8 |
4,9 2,4 |
5,2 0 |
Общий кальций |
50 20 |
60 30 |
71 42 |
87 33 |
65 0 |
Общий магний |
12 5 |
17 10 |
19 11 |
22 11 |
20 0 |
Примечание: В числителе - концентрации в мг/л; в знаменателе - вынос веществ в кг/га.
В табл. 6 приводятся сведения о средней концентрации химических элементов и выносе их с единицы площади в период весеннего половодья 1976 года в ОПХ ВНИИ защиты почв от эрозии Медвенского района Курской области.
Смыв веществ с единицы площади рассчитывался нами (Иванов,1977) по величинам жидкого стока с зяби, озимых и многолетних трав, соответственно равного 40; 50 и 60 мм, которые были приняты за норму стока.
Для сравнения приводим концентрацию отдельных веществ в воде пруда рыбхоза Спартак (колхоз «Красный Октябрь»), граничащего непосредственно с ОПХ ВНИИ защиты почв от эрозии.
Прежде чем приступить к анализу экспериментального материала, обратимся к обстоятельным исследованиям Хармса, Дорнбуша и Андерсена [1974], проведенным в США (табл.7).
Они показывают, что концентрация сточных вод зависит не только от вида сельскохозяйственных угодий, но и от характера стока. Концентрация химических элементов в стоке талых и ливневых вод неодинакова. На обрабатываемых землях концентрация азота и фосфора выше в стоке ливневых вод по сравнению с талыми водами. На пастбищах и травах наблюдается противоположное явление. Содержание в талых водах общего азота и фосфора на пастбищах и травах выше, чем на обрабатываемых землях.
Таблица 7. Концентрация химических элементов в жидком стоке
в зависимости от использования сельскохозяйственных земель
Показатели |
Обрабатываемые Земли |
Пастбище |
Люцерна, костер |
|||
снего- таяние |
ливни |
снего- таяние |
ливни |
снего- таяние |
ливни |
|
Сухой остаток, мг/л |
187 |
1241 |
150 |
222 |
134 |
108 |
Прокаленный остаток, мг/л |
51 |
1024 |
18 |
38 |
42 |
40 |
Общий фосфор, мг/л |
0,44 |
1,05 |
0,67 |
0,49 |
0,43 |
0,35 |
Нитраты, мг/л |
1,0 |
1,5 |
0,67 |
0,4 |
0,8 |
0,3 |
Обший азот, мг/л |
2,1 |
2,6 |
3,3 |
1,7 |
2,8 |
0,8 |
Химическая потребность в кислороде, мг/л |
49 |
148 |
69 |
49 |
62 |
22 |
Наибольший вынос основных элементов питания (азота, фосфора, калия, кальция и магния) с талыми водами в условиях ЦЧО наблюдается на полях, занятых многолетними травами (клевером). Наименьший вынос азота, кальция и магния происходит на зяби, а фосфора и калия - на озимых (см. табл. 6) .
На основании обзора имеющейся информации М.А. Бобрицкая [1975] для условий Нечерноземной зоны установила, что годовое вымывание из пахотного слоя суглинистых почв в среднем по зоне составляет, (кг/га): Са - 50; Mg - 3-7; К - до 7; азота - 1-4. На выщелоченных, типичных и обыкновенных черноземах в условиях ЦЧО при внесении удобрений с осени эти показатели будут соответственно равны: 67; 11; 2-4; 1-5 (см. табл. 1). Однако, как показал И.С. Шатилов и др. (1974), потери азота со стоковыми водами при внесении аммиачной селитры по снегу составляют половину от внесенного количества и более, а при ранневесенней подкормке озимых по черепку - около одной трети.
По исследованиям, проведенным в Нидерландах, при средней дозе внесения азота 124 кг/га с водами поверхностного стока уносится от 5 до 25% азота. На легких супесчаных и песчаных почвах США вымывается от 2 до 6% внесенного минерального азота; при высоких дозах азотных удобрений вымывание может превысить 10%; из органических удобрений азота вымывается больше 10-30%. На Северном Кавказе нсследовання Гидрохимического института показали, что в сбрасываемых орошаемых водах концентрация азота удобрений достигает в летний период иногда 10 мг/л. Весной 1975 г. в воде р. Кочеты его содержалось до 16 мг/л, а в грунтовой воде - до 81,6 мг/л (Толстоусов, Алексеев, 1975).
Обращает на себя внимание повышенная концентрация аммиачного азота, фосфора и калия в воде пруда «Спартак», что создает неблагоприятные условия выращивания рыбы. Подсчитано, что поступление 1 мг фосфора вызывает продуцирование 100 мг водорослей: на разложение 100 мг водорослей требуется 140 мг кислорода (Покровская, 1975). Попадающие в воды неочищенные стоки вызывают, таким образом, значительное уменьшение в воде содержания кислорода.
Фильтрующиеся через почву осадки обогащены продуктами постоянно протекающих в ней физико-химических, химических и биологических процессов, а также водорастворимыми солями удобрений и мелиорантов, причем на долю кальция приходится по эквиваленту 50-65% всех вымываемых катионов (Ягодин, Жуков, Кобзаренко, 2002). Чем больше кальция содержится в почве, тем легче он теряется вследствие вымывания. На величину его потерь оказывают влияние и вносимые на поля удобрения. Аммонийные формы азотных удобрений способствуют вытеснению обменного кальция из почвенных коллоидов, и он теряется с просачивающейся водой, сопровождаемый подвижным анионом для поддержания электрической нейтральности. Ион аммония впоследствии нитрифицируется, и образовавшиеся нитраты нейтрализуют вытесненные из ППК ионы кальция.
По данным Дж.У. Кука (1970), внесение 1 ц сульфата аммония влечет за собой потерю кальция, эквивалентную примерно 1 ц карбоната кальция. Применение фосфатов аммония вызывает меньше потерь, поскольку фосфаты фиксируются почвой. Калийные удобрения также способствуют потере кальция из почвы. Его вымывание уменьшается с увеличением глубины слоя почвы, причем часть вымытых из пахотного горизонта почвы катионов в сухие периоды года возвращается с восходящими токами воды по капиллярам. По данным исследований Б.А. Ягодина, Ю.П. Жукова и В.И. Кобзаренко (2002) с хроматографическими колонками, в пахотный слой почвы поднималось 14-35% утраченного кальция.
