
- •Введение
- •Общее понятие об экосистемах
- •1.1. Экосистема и плодородие
- •Биотехнология
- •Плодородие
- •2. Химическая природа кальция
- •0,560 СаО СаСо3 1,785
- •2,497 СаСо3 Са 0,400
- •3. Кальций в земной коре
- •4. Кальций в почвах
- •4.1. Цеолиты и специфическая роль в них кальция
- •4.2. Активность ионов кальция и водорода в мощном черноземе
- •4.3. Кальций и фосфаты в почвах и растениях
- •4.4. Гипсование и известкование почв
- •5. Кальций в природных водах
- •5.1. Состав и свойства воды как растворителя по а.М. Никанорову и др.
- •5.2. Химизм природной воды
- •6. Кальций в организмах
- •6.1. Кальций в растениях
- •6.1.1. Влияние кальция на корневую систему растений и рН
- •6.1.2. Соединения кальция в растениях
- •6.1.3. Питательная среда и специфическая роль кальция
- •6.1.4. Повышение устойчивости растений под влиянием кальция
- •6.1.5. Кальций в жизни растений
- •6.2. Кальций в организме человека и животных
- •6.2.1. Транспорт ионов кальция, мембранные рецепторы и внутриклеточный кальций
- •6.2.2. Значение кальция в жизни организмов
- •7. Экологические функции кальция
- •7.1. Сорбирование урана поверхностью карбонатов
- •Заключение
- •Литература
6.2. Кальций в организме человека и животных
Перечислим лишь некоторые функции кальция в организме:
Опорная. Кальций входит в состав скелета, зубов, ногтей, волос.
Нервно-мышечная. Кальций обеспечивает передачу нервного возбуждения, с чем связаны работа головного мозга, память, ритмичность сердечных сокращений, тонус кровеносных сосудов, реакция и работоспособность скелетных и гладких мышц внутренних органов.
Один из факторов свертывания крови, играет важную роль в процессе регуляции проницаемости клеточной мембраны.
Уменьшает уровень холестерина, способствует понижению артериального давления.
Повышает защитные силы организма, т.к. участвует в процессах образования энергии, в синтезе РНК и ДНК, активизации ряда ферментов.
Способствует поддержанию здорового состояния кожи, снижению проявления аллергических реакций, болевого синдрома и воспалительных процессов, т.к. обеспечивает функционирование клеточных мембран, тормозит высвобождение гистамина, влияет на кислотно-щелочное равновесие организма.
Обеспечивает энергией мужские половые клетки.
Потребность в кальции составляет у детей 15 лет: 800-900 мг., 6-17 лет: 1000-1200 мг., у взрослых: 800 мг., у беременных: 1000 мг., у кормящих женщин: 1200 мг. в сутки.
6.2.1. Транспорт ионов кальция, мембранные рецепторы и внутриклеточный кальций
Используя различные методы, удалось установить, что при гидролизе одной молекулы АТФ Са-АТФаза СР переносит 2 иона кальция из окружающей среды внутрь везикул, как это показано на рис. 21.

Рис. 21. Схематическое изображение везикулы саркоплазматического ретикулума со встроенной молекулой Са-АТФазы во внешнюю среду (цитоплазму) обращена головка фермента, диаметром около 9 нм. С ней связываются АТФ и ионы кальция. Мембрану пронизывает канал, по которому, как полагают, кальций переносится при гидролизе АТФ (Владимиров, 1999).
Перенос ионов кальция сопровождается переносом электрических зарядов, но разность потенциала на мембране не удерживается, потому что мембрана СР хорошо проницаема для других ионов. Для того чтобы перенести через мембрану 2 грамм-эквивалента ионов кальция из клеточного сока, где его концентрация Ci = 1·10-7 М, во внутреннюю полость саркоплазматического ретикулума, где концентрация кальция близка к одному мМ (Co = 1·10-3) требуется затратить энергию, равную:
G = 2 = 2 [o + RT ln(Ci/Co) + zF].
Поскольку внутри саркоплазматического ретикулума потенциал равен внутриклеточному ( = 0), а величина µo примерно одинакова для ионов кальция в водных растворах (µo = 0), можно считать, что изменение свободной энергии при переносе двух молей Ca2+ равно при 37 оС (310 К):
G = 2RTln (Ci/Co) = 4 7,5 кДж/моль.
Это приблизительно равно энергии гидролиза макроэргической связи АТФ при физиологических концентрациях АТФ, АДФ и ортофосфата. Таким образом, транспорт кальция через мембрану саркоплазматического ретикулума осуществляется с высоким коэффициентом полезного действия, без потерь энергии. Помимо прочего, это предполагает обратимость работы Са-АТФазы. И действительно, было показано, что можно получить синтез АТФ из АДФ и фосфата, если нагрузить изолированные везикулы СР кальцием, а затем убрать кальций из окружающей среды, добавив туда комплексон - соединение, связывающее Ca2+. Заметим, что обратимо могут работать также и другие транспортные АТФазы: Na/K-АТФаза цитоплазматических мембран и H+- АТФаза митохондрий.
В морской воде, где, вероятно, зарождалась жизнь, ионы Са++ и Mg++ присутствуют в сравнительно близких концентрациях (соответственно 11 и 55 мМ). Близко их содержание и в плазме крови человека (соответственно 2,5 и 0,9 мМ). При этом около половины кальция в плазме связано с органическими фосфатами и белками, поэтому свободных ионов Са++ в крови оказывается только 1,2 мМ. Внутри же клетки, в ее цитоплпзме, концентрация ионов Са++ в 10 000 раз меньше – около 100 нМ.
Кальций в цитоплазме не может образовывать комплексы с метаболитами, так как его концентрация очень низка. Он редко является кофактором ферментативных реакций, хотя может регулировать многие метаболические процессы, активизируя специфические Са-связывающие белки. Основная функция Са2+ заключается в передаче регуляторных сигналов (Ткачук, 2001).
Клетка не может жить как без Mg2+, так и без Са2+, однако продолжительное в, в течение десятков минут, повышение уровня Са2+ в цитоплазме (от10-7 до 10-5 М и выше) приводит к гибели клеток. В мембранах клетки функционируют сложно организованные белковые структуры, обеспечивающие взод Са2+ в цитоплазму по градиенту концентрации (Са2+-каналы), а также селективные системы активного транспорта Са2+ против градиета его концентрации, использующие для этого либо энергию АТФ (Са-насос), либо градиенты других ионов (например, Na/Са –переносчик). Согласованное функционирование систем пассивного и активного транспорта Са2+ через цитоплазматическую и внутриклеточные мембраны обеспечивает так называемое транзиторное повышение концентрации Са2+, то есть способность цитоплазматического кальция возвращаться к базальному уровню вне зависимости от того, продолжает ли действовать сигнал, вызвавший вход Са2+ в клетку (Ткачук, 2001).
Ионы кальция, вышедшие из ретикулума или вошедшие в клетку извне, взаимодействуют со специфическими Са-связывающими белками, тем самым влияя на метаболическое и функциональное состояние клетки (см. рис. 22). С помощью этого механизма уровень Са2+ в цитоплазме обычно возрастает от 10-7 до 10-6 М. Повышение концентрации Са2+ в клетках вызывают два класса регуляторов, стимулирующих разные изофрмы фосфолипазы С: гармоны и факторы роста.
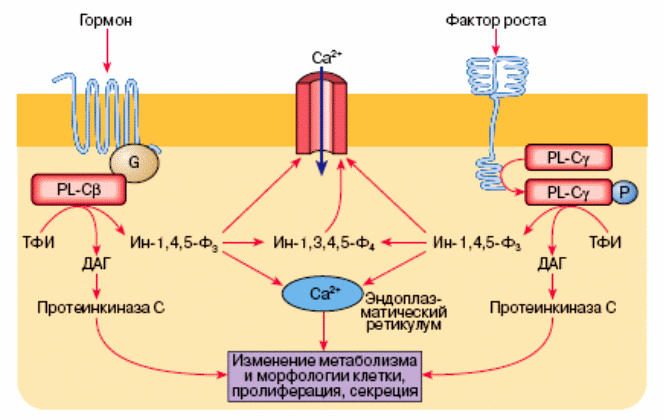
Рис. 22. Механизмы активации фосфолипазы С (PL-C) гормонами и факторами роста. G – ГТФ-связывающий G-белок, Р – неорганический фосфат, Ин-1,3,4,5-Ф4 – инозитолтетроксифосфат.
Фосфорилирование γ-изоформы фосфолипазы С по тирозиновому остатку приводит к ее активации, в результате чего из ТФИ образуются Ин-1,4,5-Ф3 и ДАТ (рис. 22).
Возбудимые клетки (нейроны, мышечные волокна) также воспринимают регуляторное влияние Са-мобилизующих гормонов и факторов роста, однако помимо фосфоинозитидного пути регуляции уровня Са2+ они имеют потенциалзависимые Са2+-каналы (рис. 23), благодаря чему происходит вход Са2+ в клетку при деполяризации мембраны. Снижение потенциала покоя в возбудимой мембране, равного около -70 мВ, воспринимается специальным сенсором в составе Са2+-канала и при некоторой пороговой величине приводит к изменению конформации потенциалзависимого Са2+-канала, в результате он открывается и через пору размером 5 Ǻ внутрь клетки устремляются ионы Са2+ со скоростью около миллиона ионов в секунду.
Следует отметить, что в некоторых тканях, например в сердце, потенциалзависимый Са-канал может регулироваться также G-белками или путем фосфорилирования (не по тирозиновым, а по сериновым и треониновым остаткам; такое фосфорилирование катализирует цАМФ-зависимая протеинкиназа). Как фосфорилирование, так и взаимодействие с G-белком не могут вызвать открывание потенциалзависимого Са2+-канала, но увеличивают время существования этого канала в открытом состоянии, иными словами, изменяют количество ионов Са2+, вошедших в клетку при деполяризации мембраны. Этот канал имеет три разных участка связывания, через которые он тормозится так называемыми Са-антагонистами, лекарствами (верапамил, дилтиазем и дигидропиридины), широко используемыми в последнее десятилетие для лечения кардиологических, психотропных, аллергических и других заболеваний.
Удаление Са2+ из цитоплазмы. При входе Са2+ в цитоплазму через Са2+-канал включаются системы обратных связей, которые блокируют работу этих каналов. Инактивацию каналов могут вызывать ионы Са2+, протеинкиназа С и другие регуляторные системы клетки. Удаление Са2+ из клетки осуществляет Са-насос плазматической мембраны. При повышенной концентрации Са2+ в цитоплазме работа этого насоса ускоряется за счет более полного насыщения переносчика ионами Са2+.
В мембранах эндоплазматического ретикулума также функционирует Са-насос. По кинетическим свойствам он подобен насосу цитоплазматической мембраны: чем выше уровень Са2+ в цитоплазме (вплоть до 5 · 10-6 М), тем быстрее Са2+ удаляется в цистерны ретикулума. Внутри этих цистерн Са2+ связывается с кальсеквестрином, белком, имеющим большое число Са-связывающих участков. Концентрация свободных ионов Са2+ внутри ретикулума может достигать 1 мМ.
Митохондриальная система устранения Са2+ из цитоплазмы имеет значение только при крайне высоком уровне Са2+ в цитоплазме – 10-5 М и выше, что наблюдается при некоторых патологиях или других критических ситуациях в жизни клетки (перекисное окисление липидов, механическое повреждение мембраны). Переносчик Са2+ в митохондриях, имеющий очень низкое сродство к Са2+, функционирует за счет электрохимического градиента, генерируемого переносом протонов. В митохондриальном матриксе Са2+ может накапливаться до концентрации 0,5 мМ.

Рис. 23. Четыре типа Са-каналов в цитоплазматической мембране. Левый верхний - потенциалуправляемый Са-канал, остальные - рецепторуправляемые Са-каналы (см. описание в тексте). И — рецептор, X - гипотетический вторичный посредник, образующийся вследствие выхода Са2+ из ретикулума (В.А. Ткачук, 2001).
Осцилляция внутриклеточного Са2+. В цитоплазматической мембране клетки обычно функционируют несколько типов Са2+-каналов. Так называемые рецепторуправляемые каналы могут быть стимулированы путем прямого сопряжения с G-белком, который переведен в активированную форму мембранным рецептором (см. рис. 23). Показано также существование в плазматической мембране Са-каналов, открываемых Ин-1,4,5-Ф3, который образуется при стимуляции фосфоинозитидного обмена. Описаны Са2+-активируемые Са2+-каналы, которые модулируются еще одним продуктом фосфоинозитидного обмена - Ин-1,3,4,5-Ф4 (см. рис. 22). Еще более загадочно функционирование в плазматической мембране Са2+-канала, активируемого путем выхода Са2+ из эндоплазматического ретикулума (см. рис. 23). Этот канал высоко селективен в отношении Са2+, но имеет в 1000 раз меньшую проводимость, чем другие каналы. Как и другие Са2+-каналы, при повышении уровня Са2+ в цитоплазме он инактивируется. Ни один из этих Са2+-каналов, управляемых рецептором, не удалось выделить в виде гомогенного белка или комплекса белков, они до сих пор не клонированы, неизвестна и структура их генов. Это объясняется крайне низким содержанием этих белков в тканях, а также, вероятно, их сложной олигомерной структурой. Наиболее изучен потенциалзависимый Са2+-канал (см. рис. 23): известна структура всех его субъединиц, участков связывания органических блокаторов, сенсора мембранного потенциала, описан механизм узнавания гидратированного Са2+ и его переноса через канал.
Все Са-каналы цитоплазматической мембраны различаются по своему вкладу в поток Са2+, селективности и проводимости, порогу активации и инактивации и т.п. От каналов внешней мембраны существенно отличаются Са-каналы, расположенные в мембране эндоплазматического ретикулума. Рецептор 1,4,5-Ф3 представляет собой тетрамер, состоящий из одинаковых субъединиц, которые формируют неспецифическую пору для катиона. Структура этого белка не имеет ничего общего со структурой потенциалзависимого Са-канала. Рецептор Ин-1,4,5-Ф3 — это каналоформер, который является Са2+-связывающим белком, причем ионы Са2+ при низких концентрациях его активируют, а при высоких ингибируют. Связывание Ин-1,4,5-Ф3 с рецептором кооперативно и завершается десенсибилизацией, то есть снижением чувствительности рецептора к своему агонисту. Этот канал связывает также АТФ и может фосфорилироваться цАМФ-зависимой протеинкиназой.
В мембранах эндоплазматического ретикулума функционирует еще один рецептор-каналоформер, через который в цитоплазму входит Са2+. Это рианодиновый рецептор, который экспрессируется в возбудимых клетках и может функционировать согласованно с рецептором Ин-1,4,5-Ф3. Как и последний, рианодиновый рецептор является тетрамером, формирует неселективную катионную пору, через которую Са2+ может выходить из ретикулума. Этот канал активируется микромолярными и ингибируется миллимолярными концентрациями Са2+, зависит также от содержания АТФ и Мg2+. Широко известным лигандом этого рецептора является кофеин, метилксантин растительного происхождения. Эндогенным лигандом этого рецептора, по-видимому, является циклическая АДФ-рибоза. Локальное повышение концентрации Са2+, вызванное его входом извне, также способно активировать рианодиновый Са2+-канал.
Взаимодействие между Са2+-каналами внешней и внутренних мембран, Са-насосами, а также Са-связывающими белками, локализованными как в мембранах, так и в цитоплазме клетки, приводит к так называемым осцилляциям Са2+, то есть периодическим флуктуациям его концентрации в цитоплазме (рис.24).
В невозбудимых клетках основным триггером кальциевых осцилляции является Ин-1,4,5-Ф3, который образуется из ТФИ при активации фосфолипазы С гормонами или факторами роста. Ин-1,4,5-Ф3 способен диффундировать от плазматической мембраны, где он образуется, до мембран эндоплазматического ретикулума за десятки секунд. Количество и концентрация образующегося Ин-1,4,5-Ф3 достаточно высоки, чтобы оккупировать все молекулы соответствующих рецепторов, однако выход Са2+ происходит только в так называемых горячих участках. Это участки переменной локализации в клетке, возникающие, как пузырьки в закипающей воде, в разных участках за счет высокой локальной концентрации Са2+, Ин-1,4,5-Ф3 или его рецептора. Согласно существующим в настоящее время представлениям, вышедший в "горячем" участке в цитоплазму Са2+ диффундирует вдоль ретикулума и повышает в его мембранах чувствительность рецептора к Ин-1,4,5-Ф3, а также облегчает открывание канала, тем самым вызывая перемещение фронта Са-волны. Локальное повышение концентрации Са2+ в этом участке мембраны приводит к инактивации Са-канала, в результате чего горячая точка гасится, а диффузия Са2+ генерирует новые точки выброса Са2+ из ретикулума. В гашении горячих точек участвуют также Са-насосы, транспортирующие Са2+ в ретикулум или межклеточное пространство.
В возбудимых тканях основной вход Са2+ внутрь клетки происходит через потенциалуправляемые Са2+-каналы, которые функционально сопряжены с риано-диновыми рецепторами. В участке сопряжения этих двух типов каналов выход Са2+ приводит к распространению Са2+-волны возбуждения рианодиновых рецепторов вдоль мембран ретикулума. За фронтом Са-волны происходит снижение уровня Са2+ вследствие того, что ретикулум в этом участке уже опустошен, поэтому не выбрасывает Са2+, а Са-насос удаляет Са2+ из цитоплазмы. В возбудимых клетках частоту осцилляции Са2+ могут повышать как Ин-1,4,5-Ф3, так и циклическая АДФ-рибоза или кофеин.
Интересно, что во многих типах клеток волна кальциевой осцилляции распространяется от клеточного ядра и может приобретать форму сфер или сложных спиралей. В некоторых тканях (сердце, мозг) Са-осцилляции, возникшие в одной клетке, могут вызывать осцилляцию Са2+ в соседних клетках, причем с той же частотой, что и в клетке, инициировавшей этот процесс. По-видимому, в этих тканях Са-волна может распространяться через межклеточные контакты, обладающие высокой ионной проводимостью.
В цитоплазме одиночной клетки гормоны и факторы роста практически не влияют на амплитуду повышения концентрации Са2+, но увеличивают частоту его флуктуации (см. рис. 24). Обычно уровень Са2+ в цитоплазме изменяется от 10-7 до 5 • 10-7 М, а частота от одного колебания в минуту до нескольких колебаний в секунду. Са-зависимые эффекты гормонов и факторов роста оказываются прямо пропорциональными частоте флуктуации цитоплазматического Са2+ (см. рис. 24). Это, по-видимому, можно объяснить тем, что при высокой частоте осцилляции увеличивается вероятность насыщения кальцием Са-связывающих белков. Диссоциация Са2+ из высокоаффинных участков Са-связывающих белков происходит за минуты, а Са2+ в цитоплазме осциллирует быстрее, поэтому Са-связывающие белки воспринимают частотную информацию и, подобно преобразователям переменного тока в постоянный, преобразуют ее в медленно развивающееся (за минуты или часы) изменение метаболизма, морфологии или функционального состояния клетки.

Рис. 24. Зависимость от концентрации гормона частоты флуктуации концентрации Са2+ в цитоплазме и величины биологического эффекта, вызываемого ионами Са2+
Мишени и механизмы действия Са2+. В Са-связывающих белках может быть несколько участков связывания Са2+, между которыми проявляется положительная кооперативность. При связывании Са2+ в структуре белка может увеличиваться количество а-спиралей и часто на поверхности экспонируются функциональные группы, участвующие во взаимодействии Са-связывающего белка с так называемыми эф-фекторными белками. Таким образом, Са2+ вызывает взаимодействие двух белков, что приводит к изменению их активности или локализации в клетке.
Ниже приведены наиболее изученные Са-связывающие белки млекопитающих.
Белок |
Функция в клетке |
Кальмодулин |
Активатор аденилатциклазы, фос-фодиэстеразы циклических нуклео-тидов, киназы легких цепей миозина и др. |
Тропонин С |
Регулятор сокращения скелетных и сердечной мышц |
Фосфолипаза С, специфичная в отношении фосфоинозитидов |
Образует инозитол-1,4,5-трисфос-фат и диацилглицерин |
Кальцинейрин В |
Фосфатаза фосфобелков |
Кальпаин |
Протеаза |
α-Актинин |
Актинсвязывающий белок |
Парвальбумин |
Буфер Са2+ |
Фосфолипаза А2 |
Образует арахидоновую кислоту |
Киназа С |
Сериновая и треониновая протеин-киназа |
Аннексин |
Регулятор экзо- и эндоцитоза, ингибитор фосфолипазы А2 |
Са2+-активируемый К-канал |
Вызывает гиперполяризацию мембраны |
Рецептор инозитол-1,4,5-трисфосфата |
Вызывает выход Са2+ из эндоплазматического ретикулума |
Рецептор рианодина |
Вызывает выход Са2+ из эндоплазматического ретикулума |
Na+/Са2+-обменник |
Осуществляет выход Са2+ из клетки в обмен на вход Na+ |
Са2+-АТФаза |
Осуществляет активный транспорт Са2+ из клетки или в цистерны эндо-плазматического ретикулума |
Гельзолин |
Изменяет структуру актина |
Виллин |
Структурирует актиновые филаменты Буфер Са2+ |
Кальсеквестрин |
Буфер Са2+ |
Кальретикулин |
Регулятор глюкокортикоидных рецепторов |
Знакомство с этим списком позволяет заключить, что Са2+ активирует многие катаболические процессы (гликогенолиз, липолиз, протеолиз), а также стимулирует синтез белка, мышечное сокращение и немышечную подвижность, экзоцитоз, ионный транспорт, секрецию нейромедиаторов. Молекулярные механизмы действия Са2+ на многие процессы изучены недостаточно. В частности, неизвестно, каким образом Са2+ влияет на дифференцировку, пролиферацию и программируемую смерть клетки. Показано, что кальмодулинзависимая протеинкиназа может фосфорилировать факторы транскрипции, а кальретикулин влияет на активность рецепторов глюкокортикоидов в ядре. Известно также, что внутриклеточный Са2+ стимулирует процессы апоптоза и это действие реализуется через активацию нуклеаз и протеаз, которые разрушают ДНК и хроматин. Отметим также, что подъем уровня Са2+ в цитоплазме является необходимым этапом в мейозе клетки. Слияние половых клеток также сопровождается подъемом уровня Са2+. Для образования зиготы необходимо связывание Са2+ с кальмодулином. Без повышения концентрации Са2+ в цитоплазме митоз останавливается, а Са2+-зависимое дефосфорилирование белков кальцинейрином переводит клеточный цикл из стадии Go в G1. Таким образом, ионы Са2+ контролируют метаболизм, функциональную активность и рост клеток, а также их рождение и смерть (Ткачук, 2001).
Многочисленные процессы, протекающие внутри клетки, находятся под постоянным контролем специальных регуляторных систем. Эти системы ускоряют течение одних реакций и тормозят другие, способствуют или, наоборот, препятствуют движению клеток в определенном направлении, влияют на способность клеток общаться друг с другом. Внутриклеточные регуляторные системы достаточно универсальны. Эти системы спосбны воспринимать как сигналы о функционировании данной изолированной клетки, так и сигналы, приходящей к данной клетке от других органови тканей. Разнообразные внутри- и внеклеточные сигналы трансформируются регуляторными системами и преобразуются в локальные изменения концентрации ограниченного числа специальных молекул, способных кардинально влиять на функционирование клетки. К числу таких универсальных внутриклеточных регуляторов относятся ионы кальция.

Рис. 25. Участие кальмодулина (СаМ) в передаче кальциевого сигнала на различные белки-мишени (Гусев Н.Б., 1998)
В состоянии покоя специальные транспортные системы, встроенные во внешние и внутренние мембраны клетки, активно выкачивают Са2+ из цитоплазмы. Поэтому в состоянии покоя уровень свободного кальция в цитоплазме клетки составляет 10-7-10-6 М. При возбуждении проиходит резкое изменение внутриклеточной концентрации кальция. Са2+ входит внутрь клетки из внеклеточного пространства или освобождается из внутриклеточных запасов. Следствием этого является увеличение концентрации Са2+ в цитоплазме до 10-5 М. Ионы кальция связываются специальными внутриклеточными Са-связывающими белками. Часть этих белков относится к белкам семейства EF-руки. Белки этого семейства имеют специально устроенные центры связывания кальция. Центральный элемент такого центра – Са-связывающая петля, состоящая из 12 аминокислотных остатков, часть из которых содержит в своей боковой цепи атомы кислорода. Са2+ оказывается расположенным в центре октаэдра (две четырехгранные пирамиды, соединенные основаниями) и удерживаются в этом положении за счет взаимодействия с шестью кислородсодержащими лигандами, расположенными в вершинах октаэдра. С обеих сторон от Са-связывающей петли располагаются α-спиральные участки, поэтому структура изолированного Са-связывающего участка имеет вид спираль-петля-спираль. При анализе кристаллической структуры две спирали Са-связывающей петли были уподоблены указательному и большому пальцам правой руки и обозначены соответственно буквами E и F, а вся структура стала называться EF-рукой. Засчет своей структуры с правильным расположением остатков кислородсодержащих аминокислот EF-рука обеспечивает высокоэффективное и и специфичное связывание Са2+. Часть Са-связыващих белков выполняет функции переносчика кальция или функционирует в качестве своеобразного буфера, поддерживающего концентрацию кальция в цитоплазме на низком уровне. Таким белкам достаточно просто связывать кальций. Другие же белки выступают в роли регуляторов и должны в зависимости от концентрации Са2+ по-разному взаимодействовать со своими белками-мишенями, чью активность они должны регулировать.
Кальмодулин, один из наиболее подробно изученных Са-связываюших белков, широко распространен и встречается в клетках животных, растений и грибов. Широкая распространенность обусловлена, вероятно, тем, что кальмодулин способен регулировать большое количество (более 30 описанных к настояшему времени) различных процессов, происходящих в клетке. Этот факт отражен в названии. Кальмодулнн - белок, способный кальцийзависимым образом регулировать (модулировать) активность других белков.
На рис. 25 показана схема, иллюстрирующая основные пути, по которым осуществляется действие кальмодулина. При повышении внутриклеточной концентрации Са2+ происходит его связывание с кальмодулином. Кальмодулин изменяет свою структуру и оказывается способным влиять на активность белков-мишеней. В качестве мишеней могут выступать ферменты, вовлеченные в метаболизм циклических нуклеотидов - циклической АМФ и циклической ГМФ (рис. 25). При этом кальмодулнн способен влиять на активность ферментов, участвующих в синтезе циклических нуклеотидов.
Кальмодулин осуществляет регуляцию по принципу отрицательной обратной связи. Повышение внутриклеточной концентрации кальция является сигналом тревога. Как только такой сигнал поступает в клетку, необходимо задействовать системы по «уборке» Са2+. Одной из таких систем является Са-АТФаза плазматических мембран, которая активируется насыщенным кальцием кадьмодулином. Таким образом, кальмодулин является активным участником «тушения» кальциевого сигнала.
Система циклических нуклеотидов (наравне с кальцием) является универсальной управляющей системой клетки. Под контролем этой системы находятся протеинкиназы - ферменты, способные переносить остаток фосфата с молекулы АТФ на определенные участки в структуре белка и тем самым менять структуру и свойства белков-субстратов. Таким образом, кальмопулнн как бы связывает две универсальные регуляторные системы клетки: систему, зависящую от циклических нуклеотидов, и систему, управляемую ионами кальция.
Кальмодулин может регулировать активность структурных белков цитоскелета (рис. 25), связанных с микротрубочками и микрофиламентами. Таким способом кальмодулин может оказывать влияние на процессы эндо- и экзоцитоза, а также на перемещение органелл внутри клетки или изменение формы клетки.
Кальмодулнн является субъединицей и регулирует активность многих Са-зависимых протеинкиназ (рис. 25). Эти ферменты, так же как ранее упомянутые протеинкиназы. зависящие от циклических нуклеотидов, переносят остаток фосфорной кислоты от АТФ на определенные участки в структуре белков-субстратов.
Кальмодулин способен регулировать активность некоторых протеннфосфатаз (рис. 25). Эти ферменты являются антагонистами протеинкиназ. Фосфатазы узнают в структуре белка участки, фосфорилированные протеинкиназами, и удаляют из них остатки фосфата. Таким образом, фосфатазы как бы обращают эффект протеинкиназ.
Наконец, кальмодулин может взаимодействовать и активировать функционирование встроенной в наружную мембрану клетки транспортной АТФазы.
