
4613
.pdf
Министерство образования и науки Российской Федерации Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
«Хабаровская государственная академия экономики и права»
Кафедра естественнонаучных дисциплин
АНАЛИТИЧЕСКАЯ ХИМИЯ И ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Программа, тематика и методические указания по выполнению контрольной работы для студентов 2, 3-го курсов специальности 260501 «Технология продуктов общественного питания» заочной и заочной сокращённой
форм обучения
Хабаровск 2009

ББК Г 4
Х 12
Аналитическая химия и физико-химические методы исследования : программа, тематика и методические указания по выполнению контрольных работ для студентов 2, 3-го курсов специальности 260501 «Технология продуктов общественного питания» заочной и заочно-сокращённой форм обучения / Л. П. Павлюченкова. – Хабаровск : РИЦ ХГАЭП, 2009. – 52 с.
Рецензент завкафедрой фармацевтической и аналитической химии Дальневосточного государственного медицинского университета канд.фарм.наук, доцент В.Ф. Гуськов
Утверждено издательско-библиотечным советом ХГАЭП в качестве методических указаний для студентов
Павлюченкова Людмила Павловна
АНАЛИТИЧЕСКАЯ ХИМИЯ И ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Программа, тематика и методические указания по выполнению контрольной работы для студентов 2, 3-го курсов специальности 260501 «Технология продуктов общественного питания» заочной и заочно-сокращённой
форм обучения
Редактор Г. С. Одинцова
Подписано в печать ____. Формат 60 х 84/16.
Бумага писчая. Офсетная печать. Усл.печ.л. 3,0. Уч-изд.л. 2,2. Тираж 75 экз. Заказ ____.
680042, г. Хабаровск, ул. Тихоокеанская, 134, ХГАЭП, РИЦ  © Хабаровская государственная академия экономики и права, 2009
© Хабаровская государственная академия экономики и права, 2009
СОДЕРЖАНИЕ
Предисловие…………………………………………………………………………...4
Программа по дисциплине «Аналитическая химия и физико-химические методы исследования»………..………………………………………………………5
Методические рекомендации по выполнению контрольных работ... …………….7
Варианты заданий по дисциплине «Аналитическая химия и физикохимические методы исследования»…...……………………………………………11
Вопросы к зачету…………………………………………………………………….47
Приложение А. Формулы расчета массы навески и результатов титриметрического анализа при прямом титровании……………………………..49 Приложение Б. Формулы пересчета концентрации растворов………...................50
Библиографический список………..………………………………..…....................51
3
ПРЕДИСЛОВИЕ
Аналитическая химия является одной из важных химических дисциплин, необходимых для подготовки специалистов-технологов общественного питания. Данная дисциплина включает в себя теоретические основы, принципы и методы химического и физико-химического анализа веществ.
Химический анализ базируется на таких разделах химии, как строение атома, химическая связь, химическая кинетика и термодинамика, равновесие в реакциях кислотно-основного взаимодействия, комплексообразования, окисления-восстановления и осаждения.
Физические и физико-химические методы анализа основаны на законах физики, электрохимии, физической и коллоидной химии, требуют знаний по органической химии, а также математики.
В данных методических указаниях приводится программа курса «Аналитическая химия и физико-химические методы исследования», тематика контрольных заданий, вопросы для подготовки к зачёту, общие рекомендации по выполнению контрольной работы и список литературы.
Контрольная работа по аналитической химии представлена в виде ситуационной задачи. Задания для контрольной работы составлены в соответствии с программой курса для специальности 260501 «Технология продуктов общественного питания» государственного образовательного стандарта.
В методическом пособии приведены образцы решения задач, имеются необходимые справочные таблицы.
4
ПРОГРАММА ПО ДИСЦИПЛИНЕ «АНАЛИТИЧЕСКАЯ ХИМИЯ И ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ»
Раздел 1. Основные положения аналитической химии
1.1.Аналитическая химия и химический анализ.
1.2.Цели и задачи химического анализа.
1.3.Классификация методов анализа.
1.4. Характеристика методов анализа: диапазон определяемых содержаний, предел обнаружения, избирательность, воспроизводимость, правильность.
Раздел 2. Качественный химический анализ
2.1.Способы и условия проведения качественных реакций.
2.2.Специфичность, избирательность и чувствительность (предел обнаружения) качественных реакций. Способы повышения чувствительности реакций.
2.3.Классификация катионов и анионов.
2.4.Характерные реакции катионов и анионов.
Раздел 3. Количественный титриметрический анализ
3.1.Основные понятия количественного титриметрического анализа: стандартный раствор, эквивалентная точка, точка конца титрования.
3.2.Требования к реакциям в титриметрии. Классификация методов: кислотно-основное, окислительно-восстановительное, осадительное, комплексиметрические титрование (комплексонометрия).
3.3.Аналитические весы, измерительная аналитическая посуда.
3.4.Способы выражения концентрации стандартных (титрованных) растворов: молярная, нормальная (эквивалентная), титр, титр соответствия. Поправочный коэффициент. Фактор эквивалентности.
3.5.Способы приготовления титрантов. Стандартизация титрантов.
3.6.Виды (приёмы) титрования: прямое, обратное (по остатку), заместительное. Способы определения: отдельных навесок, аликвотных частей (пипетирование).
3.7.Метод кислотно-основного титрования (протолитометрия). Индикаторы. Теория кислотно-основных индикаторов. Интервал перехода окраски индикатора. Кривая титрования. Выбор индикатора. Область применения метода.
5
3.8.Окислительно-восстановительное титрование. Требования к реакциям. Условия проведения окислительно-восстановительного титрования. Классификация методов. Фиксирование точки эквивалентности.
3.9.Перманганатометрическое титрование. Условия проведения титрования. Титрант метода, его стандартизация. Фиксирование точки эквивалентности. Область применения.
3.10.Иодометрическое титрование. Условия определения восстановителей и окислителей. Титранты метода. Фиксирование точки эквивалентности.
3.11.Осадительное титрование. Аргентометрическое титрование. Метод Мора, Фаянса-Ходакова, Фольгарда. Индикаторы и условия титрования. Область применения.
3.12.Комплексонометрическое титрование. Хелатные комплексы с этилендиаминтетрауксусной кислотой. Сущность метода, металлохромные индикаторы. Условия титрования. Область применения метода.
Раздел 4. Физико-химический анализ
4.1.Классификация физико-химических методов
4.2.Методы определения количественного содержания. Прямые: метод градуировочного графика, молярного свойства (по уравнению связи), метод стандарта, метод добавок, метод косвенных определений.
4.3.Молекулярно-абсорбционная спектроскопия. Закон светопоглощения Бугера – Ламберта – Бера. Молярный и удельный коэффициент поглощения. Схема прибора. Оптимальные условия фотометрирования. Оценка метода.
4.4.Атомно-абсорбционный анализ.
4.5.Люминесцентный анализ. Флуориметрия. Правило Стокса – Люммеля. Квантовый и энергетический выход. Закон Вавилова. Виды тушения флуоресценции. Качественный и количественный флуориметрический анализ. Область применения.
4.6.Рефрактометрия. Показатель преломления. Приборы. Область применения.
4.7.Электрохимические методы анализа. Классификация. Потенциометрия (прямая и косвенная). Электроды сравнения и индикаторные. Ионоселективные электроды, их характеристики. Область применения. Кривые потенциометрического титрования.
6
4.8. Вольтамперометрия. Полярография, её достоинства и недостатки. Инверсионная вольтамперометрия. Качественный и количественнй анализ. Амперометрическое титрование. Область применения метода.
4.9. Кондуктометрия и кондуктометрическое титрование.
4.10. Хроматография. Классификация методов. Колоночная, бумажная, тонкослойная аппаратурная. Газовая хроматография. Высокоэффективная хроматография. Ионообменная хроматография. Электрофорез. Область применения.
МЕТОДИЧЕСКИЕ РЕКОМЕНДАЦИИ ПО ВЫПОЛНЕНИЮ КОНТРОЛЬНЫХ РАБОТ
К выполнению контрольной работы приступают после выполнения работы по неорганической химии и изучения программного материала по аналитической химии. Краткое изложение материала приведено в учебном пособии, разработанном на кафедре ЕНД и изданном РИЦ ХГАЭП (см. библиографический список).
Во время работы с литературой следует выделить и запомнить новые понятия, термины и формулы. Для лучшего усвоения материала следует вести краткий конспект, который будет полезен при повторении материала перед зачётом.
Задания контрольной работы представлены в виде ситуационной задачи, в которой для предложенного химического соединения (объекта исследования) необходимо привести реакции идентификации (обнаружения) ионов и составить методику количественного определения титриметрическим методом. Попутно следует ответить и на некоторые теоретические вопросы. Кроме того, следует решить задачу по титриметрии.
Задания представлены по вариантам. Номер варианта соответствует номеру фамилии в списке студентов курса. При выполнении задания по качественному анализу следует привести по 2 – 3 реакции на каждый ион. Наряду с написанием уравнения реакции обнаружения иона, необходимо указать аналитический эффект, условия и способы проведения реакции. Желательно сопоставить реакции по селективности и чувствительности.
Для выполнения задания по количественному титриметрическому анализу необходимо знать закон эквивалентов, уметь находить фактор эквивалентности по уравнению реакции, выучить определение молярной, нормальной
7
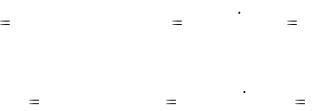
(эквивалентной) концентрации, титра и титра соответствия. Зная эти понятия, легко перейти к расчётным формулам для определения массы и массовой доли (в %) при прямом, заместительном и обратном титровании, используя приём отдельных навесок или пипетирования (см. приложения А, Б).
Так как при выполнении анализа титриметрическим методом измеряются масса и объём, необходимо познакомиться с особенностями работы с измерительной аналитической посудой и правилами взвешивания на аналитических весах.
Титриметрические методы анализа классифицируют по типу химической реакции: кислотно-основное титрование, окислительно-восстановительное, осадительное, комплексонометрическое. В каждом методе используются различные индикаторные или безындикаторные способы фиксирования точки эквивалентности. Выбор индикатора и условий титрования (чаще всего рН среды) имеет принципиальное значение для составления методики количественного определения. Каждая методика при любом титриметрическом определении сопровождается систематическими погрешностями. Следует найти и указать причины их возникновения.
При обосновании методик идентификации и количественного определения заданного объекта титриметрическим методом придерживайтесь рекомендуемого в задании алгоритма.
Решение задач по титриметрии проводится с использованием тех же формул, что и при выполнении задания по количественному анализу исследуемого объекта.
Задачи могут быть двух типов: на приготовление титранта и на определение массы или массовой доли (в %) вещества в исследуемом объекте.
Пример 1. Чему равна молярная концентрация и титр раствора HCl, если на титрование 20,00 см3 этого раствора израсходовали 15,00 см3 0,1200М раствора
NаOH?
Решение. В условии задачи даны два объёма и одна молярная концентрация раствора (f(HCI) = f(NAOH) = 1), следовательно, для решения можно воспользоваться уравнением с1V1=с2V2 и найти концентрацию HCl:
с (HCl) |
с (NaOH) V(NaOH) |
0,1200 15,00 |
0,09000моль / дм3 . |
||
|
|
|
|||
|
V(HCl) |
20,00 |
|||
|
|
|
|||
Затем находим титр HCl: |
|
|
|||
Т (HCl) |
с (HCl) M (HCl) |
0,09000 36,46 |
0,003281 г / см3. |
||
1000 |
|
1000 |
|||
|
|
|
|
||
8

Пример 2. Какова нормальная (эквивалентная) концентрация H2SO4, если на титрование 0,2156 г химически чистого Na2CO3 идет 22,35 см3 этого раствора?
Решение. Составляем уравнение реакции:
H2SO4 + Na2CO3 = Na2SO4 + H2CO3.
Стандартизация проводится методом отдельной навески. Решаем через титр соответствия T(H2SO4/Na2CO3), который находим по массе Na2CO3 и объёму
H2SO4:
|
m (Na |
CO |
) |
0,2156 |
0,009646 г / см3 . |
|
Т(H2SO4/ Na2CO3)= |
2 |
3 |
|
|
||
V (H2SO4 ) |
22,35 |
|||||
|
|
|||||
По уравнению реакции находим фактор эквивалентности для Na2CO3, который равен ½. Молярная масса Na2CO3 равна 105,989 г/моль, молярная масса эквивалентов составляет 52,994 г/моль. Затем используем формулу связи титра с нормальной концентрацией:
с (1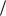 2 H2SO4 ) M 1 2Nа 2CO3
2 H2SO4 ) M 1 2Nа 2CO3 
Т(H2SO4/ Nа2CO3)= |
1000 |
|
|
|
|
, |
||||||
|
|
|
|
|
|
|||||||
с(1/ 2H2SO |
4 ) = |
Т (H2SO4 / Nа 2CO3 )1000 |
= |
|
||||||||
|
|
M(1 2 Nа |
2 |
CO |
3 |
) |
|
|
||||
|
0,009646 |
1000 |
|
|
|
|
|
|
||||
= 0,1820 моль / дм3 |
|
|
|
|
||||||||
|
52,994 |
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|||
Пример 3. Навеска химически чистого NаCl массой 2,9014 г растворена в мерной колбе на 100,0 см3. На 25,00 см3 этого раствора расходуется 25,80 см3 раствора нитрата серебра. Определите молярную концентрацию и титр раствора
AgNО3.
Решение. По условию задачи стандартизацию титранта проводят методом пипетирования. Находим титр раствора NаCl по массе и объёму колбы:
T(NаCl) = |
m NaCl |
2,9014 |
0,002901 г / см3 . |
|
V |
100,0 |
|
Из титра находим молярную (f =1) концентрацию раствора:
с(NаCl) = |
Т NaCl 1000 |
0,002901 1000 |
0,04964 моль / дм3 . |
|
M NaCl |
58,443 |
|
Затем по закону эквивалентов находим молярную концентрацию раствора
AgNO3:
с(AgNO3)= |
c NaCl V NaCl |
0,04964 25,00 |
0,04810моль / дм3. |
|
V AgNO3 |
25,80 |
|
9

Пример 4. Навеску технического сульфита натрия растворили в мерной колбе на 250,0 см3. На титрование 25,00 см3 раствора, подкисленного серной кислотой, затрачено 45,20 см3 0,05200н. раствора KMnO4. Вычислить массу (г) Na2SO3 в образце.
Решение. Составляем уравнение реакции, лежащее в основе перманганатометрического определения сульфита натрия:
5Na2SO3+ 2KMnO4+ 3H2SO4= 5Na2SO4+ 2MnSO4+ K2SO4+ 3H2O, 2 MnO4- + 8H+ + 5ē = Mn2+ + 4H2O,
5 SO32- + H2O - 2ē = SO42- + 2H+.
По последней полуреакции находим фактор эквивалентности для сульфит-иона, который равен ½. Соответственно молярная масса эквивалентов сульфита натрия равна половине её молярной массы (126,64 г/моль). Используя приём пипетирования, решаем задачу через титр соответствия по формуле
m(Na 2 SO3 ) = Т(KMnO 4 / Na 2 SO3 ) V(KMnO 4 )Vобщ Va
= с(1 / 5 KMnO 4 ) M (1/ 2 Na 2 SO3 ) V(KMnO 4 ) Vобщ =
1000 Va
= |
0,05200 63,02 |
45,20 250,0 |
=1,48 г. |
|
1000 |
25,00 |
|||
|
|
При выборе физико-химического метода анализа заданного объекта исходите из его химических свойств и области применения метода. Дайте краткое изложение сущности метода. Там где используете прямое определение приведите способы идентификации и количественного определения. Если физико-химический анализ используете только для нахождения точки эквивалентности при титровании, представьте графическое изображение кривой титрования и покажите точку эквивалентности.
10
