
4411
.pdfМинистерство образования и науки Российской Федерации Федеральное государственное образовательное учреждение высшего профессионального образования
«Хабаровская государственная академия экономики и права»
Кафедра естественнонаучных дисциплин
АНАЛИТИЧЕСКАЯ ХИМИЯ
И ФИЗИКО-ХИМИЧЕСКИЕ МЕТОДЫ ИССЛЕДОВАНИЯ
Методические указания по изучению дисциплины и задания для самостоятельной работы студентов 2-го курса направления 260800.62 «Технология продукции и организация общественного питания» очной формы обучения
Хабаровск 2014
ББК Г 4
Х 12
Аналитическая химия и физико-химические методы исследования : метод. указания по изучению дисциплины и задания для самостоятельной работы студентов 2-го курса направления 260800.62 «Технология продукции и организация общественного питания» очной формы обучения / Л. П. Павлюченкова. – Хабаровск : РИЦ ХГАЭП, 2014. – 48 с.
В учебно-методических указаниях представлены задания для самостоятельной работы по основным разделам аналитической химии и физикохимическим методам исследования, приводятся образцы решения некоторых задач, даны тестовые задания для контроля усвоения материала.
Рецензент завкафедрой фармацевтической и аналитической химии Дальневосточного государственного медицинского университета канд. фарм. наук, доцент Г.С. Сим
Утверждено издательско-библиотечным советом ХГАЭП в качестве методических указаний для студентов
© Хабаровская государственная академия экономики и права, 2014
2
СОДЕРЖАНИЕ
Предисловие……………………………………………………………………….....4
Задания по химическому анализу:
Тема 1. Качественный анализ………………………………………………………..5
Тема 2. Титриметрический анализ. Кислотно-основное титрование……...6
Тема 3. Перманганатомерия ………………………………………………...……...13 Тема 4. Иодометрия……………………………………………………………...….16 Тема 5. Аргентометрия ………………………………………….……………….…22 Тема 6. Комплексонометрия…………………………………………………...……28
Тестовый контроль знаний по химическому качественному и количественному анализу…………………………………………………………..……………………31
Физико-химические методы анализа:
Тема 7. Спектральный анализ. Фотометрия. Флуориметрия ……………….....…34 Тема 8. Электрохимический анализ. Потенциометрия и вольтамперометрия…36 Тема 9. Хроматографический анализ………………………………...…………….39
Библиографический список ..……………………………………………...……..…41 Приложения……………….…………………………………...…………...…..……42
3
ПРЕДИСЛОВИЕ
Дисциплина «Аналитическая химия и физико-химические методы исследования» входит в базовую часть математического и естественнонаучного цикла основной образовательной программы федерального государственного образовательного стандарта профессионального образования для направления 260800.62 «Технология продукции и организация общественного питания».
Учебно-методические указания являются дополнением к ранее изданным: «Аналитическая химия», «Физико-химические методы анализа».
В данных методических указаниях представлены задания для самостоятельной внеаудиторной работы по качественному анализу, титриметрии и физико-химическому анализу. Задания даны в виде задач, ситуационных заданий и тестового контроля. Выполнение индивидуальных заданий направлено на поиск необходимой информации, использование формул для расчётных задач, построение графиков, составление методик анализа, формулировку логических заключений. Каждое задание будет оценено соответствующей балльной отметкой, что способствует мотивации к качественному выполнению заданий.
Для усвоения дисциплины «Аналитическая химия и физико-химические методы исследования» необходимы знания по неорганической химии, некоторых разделов органической химии и физической и коллоидной химии, а также физики и математики.
Усвоение дисциплины начинается с изучения цели и общих принципов анализа, для чего по рекомендуемым учебникам знакомятся с основными понятиями аналитической химии и, в частности, – химического и физикохимического анализа. Вначале усваивается качественный химический анализ. На лабораторных работах по выбору выполняются некоторые реакции обнаружения катионов и анионов, учитываются условия их проведения, рассматривается аналитический эффект реакций, их специфичность и чувствительность (предел обнаружения).
Затем в соответствии со своим вариантом выполняется самостоятельная работа по теме «Качественный анализ». (Как правило, номер варианта задания соответствует номеру фамилии студента в общем списке группы.)
4
ЗАДАНИЯ ПО ХИМИЧЕСКОМУ АНАЛИЗУ
Тема 1. Качественный анализ
1.1.Как обнаружить катион аммония, используя специфическую реакцию? Составьте уравнение реакции, укажите аналитический эффект. Каков аналитический эффект обнаружения иона аммония реактивом Несслера?
1.2.Приведите уравнение реакции, лежащей в основе обнаружения иона калия микрокристаллоскопическим путём. Как обнаружить ион калия сухим путём?
1.3.Как обнаружить ион серебра с помощью реактивов HCl, KJ, K2CrO4?
1.4.Как обнаружить ион кальция с помощью реактивов H2SO4, (NH4)2CrO4; сухим путём?
1.5.Как обнаружить ион хрома (III), используя окислительновосстановительную реакцию?
1.6.Как обнаружить ион олова (II), используя его восстановительные свойства?
1.7.Приведите реакции обнаружения иона висмута (III), используя его способность к гидролизу, к комплексообразованию и окислениювосстановлению.
1.8.Как обнаружить ион магния?
1.9.Приведите реакции обнаружения иона Fe3+.
1.10.Приведите реакции обнаружения иона Cu2+, используя его способность к восстановлению, комплексообразованию, осаждению.
1.11.Как обнаружить сульфат-ион в присутствии сульфит-иона?
1.12.Как обнаружить сульфитион, используя его способность к осаждению, окислению, выделению газа?
1.13.Как отличить тиосульфат-ион от сульфит-иона?
1.14.Как обнаружить хлорид-ион?
1.15.Как обнаружить ион свинца по реакции «золотого дождя»?
1.16.Как обнаружить ион йода, используя его способность к осаждению, окислению?
1.17.Как обнаружить фосфат (гидрофосфат)-ион?
1.18.Какими реакциями обнаруживают нитрат- и нитрит-ионы. Какой реакцией их можно различить?
1.19.Как обнаружить ацетат-ион?
1.20.Как обнаружить бромид-ион?
5
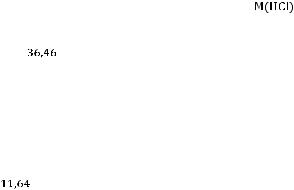
Тема 2. Титриметрический анализ. Кислотно-основное титрование
По типу аналитической реакции различают методы кислотно-основного титрования, осаждения, комлексообразования и окисления-восстановления (редоксиметрия). В раздел титриметрического анализа включены задания по составлению необходимых уравнений реакций, определению фактора эквивалентности. Выбору индикатора, расчёту объёмов концентрированных растворов или массы твёрдого вещества для приготовления и стандартизации титрантов. Подготовки образца к анализу, расчёту массовой доли определяемого компонента. В задания включены задачи на прямое, заместительное и обратное (по остатку) титрование с использованием методов отдельных навесок или пипетирования (равных долей). Индивидуальные задания выполняются по вариантам. Теоретический материал и расчётные формулы представлены в учебном пособии «Аналитическая химия», необходимые справочные данные имеются в Приложениях данных методических указаний.
2.1.Приготовление титрантов кислотно-основного титрования
Вметодике кислотно-основного титрования в качестве титрантов чаще всего применяют растворы HCl, H2SO4 и KOH. Стандартные растворы обычно готовят разбавлением концентрированных кислот или щелочей водой до требуемой концентрации. Концентрация раствора, приготовленного таким образом, будет лишь приблизительной, затем необходимо провести стандартизацию с помощью первичных стандартных веществ (ПСВ).
Пример 1. Требуется приготовить 500 см3 0,1 М раствора HCl из концентрированного (ρ = 1,179 г/см3). Указанной плотности соответствует 36% раствора HCl.
Решение. Вычисляют, какова молярная концентрация этого раствора по формуле
с(HCl) = 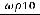 ;
;
с(HCl) = 



 = 11,64 моль/дм3.
= 11,64 моль/дм3.
Рассчитывают объём 11,64 М раствора, необходимый для приготовления 500 см3 0,1 М раствора HCl, по формуле
сконц ∙ Vконц = сразб ∙ Vразб;
Vразб = 

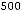 = 4,30 см3.
= 4,30 см3.
6
Этот объём отмеривают при помощи цилиндра при градуированной пробирке, помещают в склянку с водой, объём доводят до 500 см3 . Затем необходимо выбрать первичное стандартное вещество (ПСВ) и установить точную концентрацию раствора.
Задания по вопросу 2.1 представлены в таблице 1.1.
Рассчитайте объём концентрированного раствора кислоты или щёлочи, необходимый для приготовления титранта заданной концентрации и объёма; подберите ПСВ для стандартизации; запишите соответствующее уравнение реакции; укажите индикатор для фиксирования точки эквивалентности.
Таблица 1.1 – Приготовление титранта из концентрированного раствора
№ задания/ |
Название и |
Объём |
Плотность |
Массовая |
|
варианта |
концентрация |
титранта |
концентрированного |
доля ω (%) |
|
|
титранта |
(дм3) |
раствора (г/см3) |
|
|
1.1.1. |
0,2 |
М HCl |
0,50 |
1,030 |
6,433 |
|
|
|
|
|
|
1.1.2. |
0,05 М NaOH |
3,00 |
1,445 |
41,55 |
|
|
|
|
|
|
|
1.1.3. |
0,1 |
М HCl |
2,50 |
1,080 |
4,878 |
|
|
|
|
|
|
1.1.4. |
0,1 |
М KOH |
1,00 |
1,370 |
37,65 |
|
|
|
|
|
|
1.1.5. |
0,25 М HCl |
0,50 |
1,155 |
31,14 |
|
|
|
|
|
|
|
1.1.6. |
0,1 |
М NaOH |
1,50 |
1,345 |
31,62 |
|
|
|
|
|
|
1.1.7. |
0,1 |
М HCl |
1,00 |
1,130 |
26,20 |
|
|
|
|
|
|
1.1.8. |
0,05 М KOH |
3,00 |
1,505 |
49,53 |
|
|
|
|
|
|
|
1.1.9. |
0,2 |
М HCl |
1,50 |
1,095 |
19,41 |
|
|
|
|
|
|
1.1.10. |
0,05 М NaOH |
3,00 |
1,380 |
35,01 |
|
|
|
|
|
|
|
1.1.11. |
0,2 |
М NaOH |
0,50 |
1,185 |
16,89 |
|
|
|
|
|
|
1.1.12. |
0,1 |
М NaOH |
2,50 |
1,155 |
14,18 |
|
|
|
|
|
|
1.1.13. |
0,1 н. H2SO4 |
1,00 |
1,540 |
63,81 |
|
1.1.14. |
0,05 н. H2SO4 |
0,50 |
1,285 |
37,95 |
|
1.1.15. |
0,2 |
М HCl |
0,50 |
1,100 |
20,39 |
|
|
|
|
|
|
1.1.16. |
0,1 |
М KOH |
1,50 |
1,295 |
30,68 |
|
|
|
|
|
|
1.1.17. |
0,2 |
М NaOH |
2,00 |
1,050 |
4,65 |
|
|
|
|
|
|
1.1.18. |
0,1 |
М HCl |
2,50 |
1,185 |
37,27 |
|
|
|
|
|
|
1.1.19. |
0,025 н. H2SO4 |
1,50 |
1,180 |
25,21 |
|
1.1.20 |
0,1 |
М HCl |
0,50 |
1,060 |
10,06 |
|
|
|
|
|
|
|
|
|
7 |
|
|
2.2.Расчётные задачи
2.2.1.Вычислите молярную концентрацию 10% раствора NH3 ∙ H2O (ρ = 0,958 г/см3).
2.2.2.Какой объём (см3) 20% раствора HCl (ρ = 1,098 г/см3) необходимо взять для приготовления 5 дм3 0,1 М раствора?
2.2.3.Какую массу навески буры Na2B4O7 ∙ 10H2O следует взять для приготовления 200,0 см3 0,05 н. раствора?
2.2.4.Чему равен титр 0,1205 н. раствора H2SO4?
2.2.5.Сколько граммов KOH содержится в 200 см3 0,09200 М его раствора?
2.2.6.Чему равна молярная концентрация и титр раствора НNO3, если на титрование 20,00 см3 его израсходовали 15,00 см3 0,1200 М раствора NaOH?
2.2.7.Какова молярная концентрация соляной кислоты, если на 0,1734 г химически чистого Na2СО3 пошло 20,54 см3 этого раствора?
2.2.8.Навеску химически чистой (х. ч.) Н2С2О4 ∙ 2 H2O массой 0,6000 г растворили в мерной колбе вместимостью 100,0 см3. На титрование 20,00 см3 полученного раствора израсходовали 18,34 см3 NaOH. Определите молярную
концентрацию и титр раствора NaOH.
2.2.9.Определите молярную концентрацию раствора KOH, если на титрование 15,00 см3 его израсходовали 18,70 см3 раствора HCl, титр которого равен
0,002864 г/см3.
2.2.10.На титрование 50,00 см3 раствора Na2СО3, полученного растворением навески (х. ч.) его массой 0,5000 г в мерной колбе ёмкостью 200,0 см3 раствора
серной кислоты. Вычислите: а) нормальную (эквивалентную) концентрацию раствора Н2С2О4; б) его титр; в) его титр по NaOH.
2.3.Расчёт массы навески исследуемого образца и результатов анализа
Для анализа методом кислотно-основного титрования предлагаются твёрдые образцы (содержание 90 – 100%) кислот, оснований и гидролизующихся солей. Необходимо составить уравнение реакции взаимодействия определяемого компонента и соответствующего титранта, определить фактор эквивалентности, рассчитать массу навески для титрования указанным способом, подобрать индикатор для фиксирования точки эквивалентности. По рассчитанной (до четвёртого десятичного знака) массе навески, затраченному объёму и концентрации титранта с учётом поправочного коэффициента нужно рассчитать массовую долю (в %) определяемого вещества.
Задания по вопросу 2.3 представлены в таблице 1.2.
8
Таблица 1.2 – Расчёт массы навески и результатов анализа
№ |
Определяемое |
Концен- |
«К» |
Приём |
Израсхо- |
задания/ |
соединение. |
трация |
титранта |
титрования. |
дованный |
вариан- |
Молярная масса |
титранта |
|
Объёмы колб |
объём |
та |
(г/моль) |
с(1/z) |
|
(Vобщ),аликвот |
титранта |
|
|
(моль/дм3) |
|
(Vп), бюретке |
|
|
|
|
|
(Vт)(см3) |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
|
|
1.2.1. |
Н2С2О4 |
0,1 |
0,9960 |
Пипетирование |
19,62 |
|
щавелевая |
|
|
Vобщ = 200,0 |
|
|
кислота |
|
|
Vп = 20,00 |
|
|
М = 90,035 |
|
|
|
|
|
|
|
|
|
|
1.2.2. |
Н2С2Н4О4 |
0,05 |
1,005 |
Пипетирование |
14,75 |
|
янтарная |
|
|
Vобщ = 250,0 |
|
|
кислота |
|
|
Vп = 15,00 |
|
|
|
|
|
|
|
1.2.3. |
К2СО3 |
0,1 |
1,009 |
Пипетирование |
14,65 |
|
М = 138,206 |
|
|
Vобщ = 200,0 |
|
|
|
|
|
Vп = 15,00 |
|
|
|
|
|
|
|
1.2.4. |
Ва(ОН)2 ∙ 8Н2О |
0,1 |
0,9982 |
Отдельные |
14,90 |
|
М = 315,48 |
|
|
навески |
|
|
|
|
|
Vт = 15,00 |
|
|
|
|
|
|
|
1.2.5. |
Н2С4Н4О6 |
0,1 |
0,9910 |
Пипетирование |
10,03 |
|
винная кислота |
|
|
Vобщ = 100,0 |
|
|
М = 150,087 |
|
|
Vп = 10,00 |
|
|
|
|
|
|
|
1.2.6. |
Na2В4О7 |
0,2 |
1,008 |
Отдельные |
14,70 |
|
М = 201,22 |
|
|
навески |
|
|
|
|
|
Vт = 15,00 |
|
|
|
|
|
|
|
1.2.7. |
Н2С4Н4О5 |
0,2 |
1,003 |
Отдельные |
19,83 |
|
яблочная |
|
|
навески |
|
|
кислота |
|
|
Vт = 20,00 |
|
|
М = 134,089 |
|
|
|
|
|
|
|
|
|
|
1.2.8. |
КНСО3 |
0,2 |
0,9910 |
Пипетирование |
20,05 |
|
М = 100,115 |
|
|
Vобщ = 200,0 |
|
|
|
|
|
Vп = 20,00 |
|
|
|
|
|
|
|
|
|
|
9 |
|
|
Продолжение таблицы 1.2.
№ |
Определяемое |
Концен- |
«К» |
Приём |
Израсхо- |
задания/ |
соединение. |
трация |
титранта |
титрования. |
дованный |
вариан- |
Молярная масса |
титранта |
|
Объёмы колб |
объём |
та |
(г/моль) |
с(1/z) |
|
(Vобщ),аликвот |
титранта |
|
|
(моль/дм3) |
|
(Vп), бюретке |
|
|
|
|
|
(Vт)(см3) |
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
|
|
1.2.9. |
С6Н5СООН |
0,1 |
0,9880 |
Пипетирование |
14,95 |
|
бензойная |
|
|
Vобщ = 200,0 |
|
|
кислота |
|
|
Vп = 15,00 |
|
|
М = 122,12 |
|
|
|
|
|
|
|
|
|
|
1.2.10. |
Са(ОН)2 |
0,1 |
0,9912 |
Пипетирование |
19,93 |
|
М = 74,09 |
|
|
Vобщ = 250,0 |
|
|
|
|
|
Vп = 20,00 |
|
|
|
|
|
|
|
1.2.11. |
НС3Н5О3 |
0,2 |
0,9982 |
Пипетирование |
14,95 |
|
молочная |
|
|
Vобщ = 200,0 |
|
|
кислота |
|
|
Vп = 15,00 |
|
|
М = 90,08 |
|
|
|
|
|
|
|
|
|
|
1.2.12. |
NaНСО3 |
0,2 |
1,010 |
Пипетирование |
9,73 |
|
М = 84,007 |
|
|
Vобщ = 100,0 |
|
|
|
|
|
Vп = 10,00 |
|
|
|
|
|
|
|
1.2.13. |
Н2NС6Н4СООН |
0,2 |
0,9735 |
Отдельные |
20,12 |
|
аминобензой- |
|
|
навески |
|
|
ная кислота |
|
|
Vт = 20,00 |
|
|
М = 137,0 |
|
|
|
|
|
|
|
|
|
|
1.2.14. |
Na2СО3 ∙ 10Н2О |
0,2 |
1,007 |
Отдельные |
19,65 |
|
М = 286,141 |
|
|
навески |
|
|
|
|
|
Vт = 20,00 |
|
|
|
|
|
|
|
1.2.15. |
КНС8Н4О6 |
0,1 |
0,9931 |
Отдельные |
14,95 |
|
гидрофталат |
|
|
навески |
|
|
калия |
|
|
Vт = 15,00 |
|
|
М = 286,141 |
|
|
|
|
|
|
|
|
|
|
10
