
4411
.pdfдобавлении к этому раствору КJ выделился йод, на титрование которого пошло 13,80 см3 тиосульфата натрия с титром по меди 0,006500 г/см3.
4.3.17.Рассчитайте массу КJО3 в растворе, если на титрование йода, выделившегося в растворе при добавлении иодида калия и кислоты, затрачено 20,75 см3 0,1012 М раствора Na2S2О3.
4.3.18.Рассчитайте массу йода в анализируемом растворе, если на титрование затрачено 19,50 см3 раствора тиосульфата натрия, 1,00 см3 которого эквивалентен 0,001270 г йода.
4.3.19.Рассчитайте эквивалентную концентрацию раствора йода, если для титрования раствора, приготовленного из 0,2539 г чистого оксида мышьяка (III), требуется 37,12 см3 раствора йода.
4.3.20. Реакция между гипохлорит- и иодид-ионами в кислой среде СlО– + 2J– + 2Н– = Сl– + J2 + Н2О
лежат в основе методики определения «свободного» хлора в отбеливающих порошках и растворах. Пробу раствора отбеливателя массой 2,6220 г обработали избытком КJ, подкислили серной кислотой и образующийся J2 оттитровали 0,1109 М раствором тиосульфата натрия, для чего потребовалось 35,58 см3 титранта. Рассчитайте массовую долю «сводного» хлора в пробе отбеливателя.
4.3.21.Пробу инсектицида, содержащего мышьяк массой 0,4192 г, обработали соляной кислотой и восстановителями; мышьяк перегнали в виде АsСl3 с дистиллированной водой; кислоту нейтрализовали содой; раствор оттитровали 37,06 см3 0,08978 н. раствором йода. Рассчитайте массовую долю (в %) Аs2О3 в пробе.
4.3.22.Аскорбиновую кислоту во фруктовом напитке определяли методом йодометрии. К подкисленной пробе объёмом 100,00 см3 добавили 20,00 см3 0,01041 н. раствора йода, через 2 минуты аскорбиновая кислота окислилась до
дегидроаскорбиновой кислоты:
С6Н8О6 + J2 = С6Н6О6 + 2Н+;
С6Н8О6 – 2 = С6Н6О6 + 2Н+.
= С6Н6О6 + 2Н+.
Избыток йода, не вступившего в реакцию, оттитровали 0,009744 М раствором тиосульфата натрия в количестве 5,25 см3. Рассчитайте массу (в мг) аскорбиновой кислоты в 100 см3 фруктового напитка.
4.3.23. Для установки титра тиосульфата натрия взята навеска х.ч. меди массой 0,1125 г, медь превратили в раствор CuSO4, который обработали иодидом калия
2CuSO4 + 4КJ = 2CuJ↓ + J2 + 2К2SO4.
21
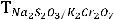
Выделившийся йод оттитровали исследуемым раствором тиосульфата натрия, которого израсходовано 18,99 см3. Вычислите: а) титр тиосульфата натрия; б) титр его по Cu; в) титр его по J2.
4.3.24.К 5,00 см3 раствора Н2О2 (ρ = 1,0102 г/см3) добавили КJ и кислоту, выделившийся йод оттитровали 0,1208 М раствором тиосульфата натрия, которого пошло 18,70 см3. Какова массовая доля (в %) Н2О2 в образце?
4.3.25.К 10,00 см3 подкисленного раствора Н2S (ρ = 1,022 г/см3) добавили 25,00 см3 0,1005 н раствора йода. Избыток йода оттитровали тиосульфата натрия («К» 0,998 к 0,1 М раствору), на титрование затрачено 15,00 см3. Определите массовую долю (в %) Н2S в образце.
4.3.26.Навеску иодида калия массой 4,3780 г растворили в мерной колбе вместимостью 200,0 см3. На титрование 20,00 см3 полученного раствора после обработки окислителем израсходовали 23,16 см3 раствора тиосульфата натрия с
титром по дихромату калия |
0,005248 г/см3. Рассчитайте |
массовую долю KJ в образце.
4.3.27.При установке титра раствора тиосульфата натрия навеску х.ч. K2Cr2O7 массой 1,1780 растворили в мерной колбе вместимостью 250,0 см3. На титрование 25,00 см3 приготовленного раствора после добавления KJ и кислоты затрачено 23,36 см3 раствора тиосульфата натрия. Рассчитайте эквивалентную
концентрацию и титр раствора тиосульфата натрия.
4.3.28.К подкисленному раствору Н2О2 прибавили избыточное количество KJ, выделившийся J2 оттитровали 22,40 см3 0,1010 М Na2S2О3. Какая масса Н2О2 содержалась в растворе?
4.3.29.Навеску технического FeCl3 массой 4,2081 г растворили в мерной колбе вместимостью 250,0 см3. К 20,00 см3 полученного раствора добавили KJ и кислоты, выделившийся йод оттитровали 22,10 см3 0,09320 М раствора Na2S2О3. Вычислите массовую долю (в %) FeCl3 в образце.
4.3. 30. Навеску тиосульфата натрия Na2S2О3 ∙ 5Н2О массой 1,1252 г растворили в мерной колбе вместимостью 100,0 см3 раствора тиосульфата натрия. Рассчитайте массовую долю (в %) Na2S2О3 ∙ 5Н2О в образце.
Тема 5. Аргентометрия
Аргентометрическое титрование основано на реакциях осаждения галогенидов и тиоцианата серебра. В качестве титрантов используют AgNO3 и NH4NCS. В зависимости от способа фиксирования точки эквивалентности различают методы Мора, Фольгарда и Фаянса. Определение галогенидов по
22

Мору и Фаянсу проводят прямым титрованием, по Фольгарду-обратным (по остатку).
5.1. Составьте методику количественного определения соединения указанным методом, для чего: а) запишите соответствующие уравнения реакций с титрантом и индикатором; б) рассчитайте массу навески (m) до четвёртого десятичного знака по способу пипетирования; в) определите массу практической навески (mпр) с учетом поправки; г) составьте расчётную формулу и определите массовую долю (в %) определяемого вещества по данным таблицы 3.
Таблица 3 – Расчёт массовой доли (в %) вещества по результатам аргентометрического титрования
№ п/п |
Вещест |
Метод |
Концен- |
Объём |
Раз- |
Объём |
Объём |
|
-во и |
|
трация |
мерной |
ность |
али- |
титран- |
|
его |
|
титранта |
колбы |
между |
квоты |
тов (см3) |
|
моляр- |
|
с(В) |
Vобщ |
mпр и mт |
Va |
|
|
ная |
|
моль/дм3 |
(см3) |
( или |
(cм3) |
|
|
масса |
|
и «К» |
|
) в г |
|
|
|
|
|
|
|
|
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
3.1.1. |
KBr |
Мора |
0,1 |
100,0 |
0,0030 |
10,00 |
10,05 |
|
119,00 |
|
К=0,9961 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.2. |
KJ |
Фольгарда |
0,05 |
200,0 |
0,0012 |
20,00 |
V1=40,00 |
|
166,00 |
|
К1=1,009 |
|
|
|
V2=20,72 |
|
|
|
К2=0,9920 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.3. |
NaCl |
Фаянса |
0,1 |
250,0 |
0,0009 |
20,00 |
19,95 |
|
58,44 |
|
К=1,003 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.4. |
BaCl2 ∙ |
Фаянса |
0,05 |
200,0 |
0,0015 |
15,00 |
14,85 |
|
2H2O |
|
K=0,9950 |
|
|
|
|
|
244,27 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1.5. |
LiCl |
Мора |
0,1 |
250,0 |
0,0018 |
20,00 |
20,21 |
|
42,39 |
|
К=1,004 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.6. |
NaBr |
Фольгарда |
0,1 |
100,0 |
0,0022 |
10,00 |
V1=20,00 |
|
102,89 |
|
К1=0,9912 |
|
|
|
V2=10,25 |
|
|
|
К2=1,003 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
23 |
|
|
|
|

Продолжение таблицы 3.
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
3.1.7. |
KCl |
Мора |
0,5 |
250,0 |
0,0014 |
20,00 |
20,15 |
|
74,55 |
|
K=1,008 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.8. |
CaCl2 ∙ |
Мора |
0, 02 |
200,0 |
0,0018 |
15,00 |
15,12 |
|
6H2O |
|
K=1,010 |
|
|
|
|
|
219,08 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1.9. |
NaJ |
Фольгарда |
0,05 |
200,0 |
0,0011 |
10,00 |
V1=20,00 |
|
149,89 |
|
К1=0,9890 |
|
|
|
V2=10,20 |
|
|
|
К2=0,9910 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.10. |
KBr |
Фольгарда |
0,1 |
200,0 |
0,0016 |
10,00 |
V1=20,00 |
|
119,00 |
|
К1=1,003 |
|
|
|
V2=10,30 |
|
|
|
К2=0,9930 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.11. |
KJ |
Фаянса |
0,05 |
250,0 |
0,0017 |
15,00 |
15,08 |
|
166,00 |
|
K=1,002 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.12. |
NaBr |
Мора |
0, 05 |
200,0 |
0,0031 |
20,00 |
19,73 |
|
102,89 |
|
K=0,9930 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.13. |
NH4Cl |
Мора |
0,1 |
250,0 |
0,0016 |
15,00 |
14,78 |
|
53,49 |
|
К=0,9820 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.14. |
NH4Br |
Фольгарда |
0,1 |
250,0 |
0,0022 |
15,00 |
V1=30,00 |
|
97,94 |
|
К1=1,002 |
|
|
|
V2=16,10 |
|
|
|
К2=0,9957 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.15. |
CaCl2 |
Мора |
0, 05 |
200,0 |
0,0018 |
20,00 |
V=19,75 |
|
110,89 |
|
K=0,9895 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.16. |
LiJ |
Фольгарда |
0,05 |
250,0 |
0,0014 |
10,00 |
V1=20,00 |
|
133,84 |
|
К1=0,9972 |
|
|
|
V2=11,43 |
|
|
|
К2=1,0042 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.17. |
NaBr ∙ |
Фаянса |
0,1 |
100,0 |
0,0021 |
15,00 |
V=14,65 |
|
2H2O |
|
К=0,9935 |
|
|
|
|
|
138,924 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1.18. |
BaCl2 |
Фаянса |
0,1 |
100,0 |
0,0019 |
10,00 |
V=10,05 |
|
208,92 |
|
К=1,002 |
|
|
|
|
|
|
|
|
|
|
|
|
24

Окончание таблицы 3.
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
|
|
|
|
|
|
3.1.19. |
CaBr2 ∙ |
Мора |
0, 025 |
200,0 |
0,0019 |
10,00 |
V=9,32 |
|
6H2O |
|
K=0,9971 |
|
|
|
|
|
307,98 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1.20. |
NH4J |
Фаянса |
0,05 |
250,0 |
0,0018 |
20,00 |
V=19,12 |
|
144,94 |
|
K=1,007 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.21. |
MgBr2 |
Фольгарда |
0,05 |
200,0 |
0,0014 |
10,00 |
V1=20,00 |
|
184,11 |
|
К1=1,022 |
|
|
|
V2=10,95 |
|
|
|
К2=1,005 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.22. |
SrCl2 |
Мора |
0,1 |
100,0 |
0,0021 |
15,00 |
V=14,12 |
|
158,53 |
|
К=1,005 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.23. |
LiBr |
Фольгарда |
0,1 |
250,0 |
0,0019 |
15,00 |
V1=30,00 |
|
86,84 |
|
К1=1,003 |
|
|
|
V2=15,92 |
|
|
|
К2=0,9975 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.24. |
CaBr2 |
Фаянса |
0,05 |
200,0 |
0,0019 |
20,00 |
V=18,95 |
|
199,89 |
|
K=1,002 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.25. |
SrCl2 ∙ |
Фаянса |
0,05 |
100,0 |
0,0015 |
10,00 |
V=9,92 |
|
6H2O |
|
K=0,9953 |
|
|
|
|
|
266,62 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3.1.26. |
NaCl |
Мора |
0, 05 |
200,0 |
0,0018 |
15,00 |
V=13,98 |
|
58,44 |
|
K=1,007 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.27. |
KJ |
Фаянса |
0,1 |
100,0 |
0,0021 |
15,00 |
V=14,35 |
|
166,00 |
|
К=1,002 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.28. |
NaBr |
Мора |
0, 005 |
250,0 |
0,0018 |
20,00 |
V=20,12 |
|
102,89 |
|
K=0,9983 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.29. |
KCl |
Фаянса |
0,1 |
100,0 |
0,0016 |
10,00 |
V=10,08 |
|
74,55 |
|
К=0,9895 |
|
|
|
|
|
|
|
|
|
|
|
|
3.1.30. |
LiCl |
Фаянса |
0,2 |
200,0 |
0,0013 |
15,00 |
V=14,17 |
|
42,39 |
|
К=1,005 |
|
|
|
|
|
|
|
|
|
|
|
|
25
5.2. Расчётные задачи
5.2.1. Рассчитайте массовое содержание (r) KJ в образце, если на титрование его навески, растворённой в произвольном объёме воды, затрачено 19,56 см3 нитрата серебра (TAgNO3/NaCl = 0,004596 г/см3).
5.2.2. Для анализа рассола 10,00 см3 его разбавили в мерной колбе вместимостью 500,0 см3. На титрование аликвоты 25,00 см3 затрачено 22,38 см3 0,1 М раствора AgNO3. Вычислите концентрацию (г/дм3) NaCl в рассоле.
5.2.3. К раствору вещества массой 0,3850 г, содержащему хлориды, прибавили 25,00 см3 0,1200 М раствора AgNO3. На титрование избытка AgNO3 затрачено 3,50 см3 0,1120 М раствора NH4NCS. Рассчитайте массовую долю (в %) Cl в навеске образца.
5.2.4. Навеска серебряного сплава массой 1,7450 г. растворена в азотной кислоте, раствор разбавлен водой в колбе на 200,0 см3. На титрование 10,00 см3 полученного раствора расходуется 11,75 см3. На титрование 10,00 см3 полученного раствора расходуется 11,75 см3 0,04672 М раствора NH4NCS. Какова массовая доля (в %) Ag в сплаве?
5.2.5. Навеска х.ч. NaCl массой 2,9014 г. растворена в мерной колбе на 1000,0 см3. На 25,00 см3 этого раствора расходуется 25,80 см3 раствора AgNO3. Определите молярную концентрацию и титр нитрата серебра.
5.2.6. Проводилось определение хлоридов по методу Фольгарда. К определяемому раствору прибавлено 25,00 см3 раствора AgNO3. На титрование избытка AgNO3 пошло 10,00 см3 0,05 М раствора КNCS. Рассчитайте массу хлоридов в титруемом растворе, если Т AgNO3/Cl = 0,001790 г/см3.
5.2.7. Навеска бромида натрия массой 2,4896 г растворена в мерной колбе вместимостью 250,0 см3. К 25,00 см3 приготовленного раствора прилито из бюретки 40,00 см3 0,1019 М раствора нитрата серебра. Избыток AgNO3 оттитровали 17,04 см3 0,09882 М раствора NH4NCS. Определите массовую долю (в %) NaBr в образце.
5.2.8. Какова массовая доля (в %) серебра в сплаве, если после растворения навески массой 0,3000 г в НNO3 на титрование полученного раствора израсходовано 23,80 см3 0,1000 М раствора NH4NCS?
5.2.9. Сколько граммов KCl содержится в 250,0 см3 раствора, если на титрование 25,00 см3 его растрачено 34,00 см3 0,1050 М раствора AgNO3?
26
5.2.10. Сколько граммов хлора содержит исследуемый раствор NH4Сl, если на титрование его затрачено 30,00 см3 раствора AgNO3, титр которого по хлору равен 0,003512 г/см3?
5.2.11. Сколько граммов BaCl2 содержится в 250,0 см3 раствора, если после прибавления к 25,00 см3 его 40,00 см3 0,1020 М раствора AgNO3 на обратное титрование израсходовано 15,00 см3 0,09800 М раствора NH4NCS?
5.2.12. На титрование раствора, полученного растворением 0,1204 г х.ч. NaCl, расходуется 21,12 см3 раствора AgNO3. Определите Т AgNO3/NaCl, с (AgNO3),
К(AgNO3).
5.2.13. Навеску технического NaBr массой 0,2058 г растворили в произвольном количестве воды. К раствору добавили 40,00 см3 0,9980 М раствора AgNO3. На титрование избытка затрачено 21,20 см3 раствора NH4NCS. Вычислите массовую долю (в %) примесей в образце, если 1,00 см3 раствора AgNO3 эквивалентен 1,06 см3 раствора NH4NCS.
5.2.14. Навеску КBr массой 1,2030 г растворили в мерной колбе вместимостью 200,0 см3. К 15,00 см3 этого раствора прибавлено 25,00 см3 раствора AgNO3 с титром 0,008358 г/см3. Избыток AgNO3 оттитрован 9,85 см3 раствора NH4NCS (Т NH4NCS/Ag = 0,005406 г/см3). Рассчитайте массовую долю (в %) КВr в образце.
5.2.15. Навеску ВaCl2 растворили в мерной колбе вместимостью 200,0 см3. К 10,00 см3 этого раствора прибавлено 25,00 см3 0,1 М раствора AgNO3, остаток которого оттитрован 11,22 см3 0,011982 М раствора NH4NCS. Определите массовое содержание ВаСl2 в мерной колбе.
5.2.16. Навеску х.ч. КСl массой 3,8460 г растворили в мерной колбе вместимостью 500,0 см3. На титрование 20,00 см3 полученного раствора затрачено 18, 40 см3 раствора AgNO3. Вычислите молярную концентрацию, титр и поправочный коэффициент AgNO3.
5.2.17. Навеску, содержащую NaCl, массой 1,8234 г, растворили в мерной колбе вместимостью 500,0 см3. К 20,00 см3 полученного раствора прибавили 25,00 см3 0,05110 М раствора AgNO3. На титрование остатка AgNO3 затратили 5,18 см3 раствора NH4NCS с титром 0,003722 г/см3. Вычислите массовую долю (в %) NaCl в образце.
5.2.18. Навеску КJ массой 0,8225 г растворили в мерной колбе вместимостью 100, 0 см3. К 10,00 см3 полученного раствора добавлено 20,00 см3 стандартного
27
раствора AgNO3 с титром 0,008293 г/см3. Вычислите массовую долю (в %) КJ в образце.
5.2.19. При стандартизации раствора нитрата серебра по стандартному раствору хлорида натрия на титрование 20,00 см3 AgNO3 затрачено 19,85 см3 раствора NaCl с молярной концентрации 0,05121 моль/дм3. Вычислите молярную концентрацию, титр и массу AgNO3 в анализируемом растворе.
5.2.20. Раствор нитрата серебра объемом 20,00 см3 оттитрован 21,45 см3 0,05000 М раствора NH4NCS. Рассчитайте молярную концентрацию, титр и массу серебра в анализируемом растворе.
Тема 6. Комплексонометрия
Метод основан на реакции образования комплексных соединений при взаимодействии катионов металлов с комплексонами. В титриметрическом анализе чаще всего применяют комплексон III Na2H2Y ∙ 2H2O (динатриевую соль этилендиаминтетрауксусной кислоты), который иногда называют трилоном Б или ЭДТА (этилендиаминтетраацетат). Взаимодействие ионов металлов и комплексона происходит в мольном соотношении 1:1.
В качестве титрантов метода применяют стандартные растворы комплексона III, сульфата магния и цинка, обычно с концентрацией 0,05; 0,025 и 0,01 моль/дм3.
6.1. Расчётные задачи
6.1.1. Вычислите массу навески х.ч. ZnSO4 ∙ 7H2O, необходимую для стандартизации 0,05 М раствора комплексона III методом пипетирования (объём мерной колбы 200,0 см3).
6.1.2. На титрование раствора CaCl2 затрачено 12,35 см3 раствора комплексона III с титром по сульфату цинка 0,01695 г/см3. Определите массу CaCl2 в образце.
6.1.3. Какая масса ртути содержалась в 250,0 см3 раствора, если после прибавления к 50,00 см3 его раствора 25,00 см3 0,01000 М раствора комплексона III избыток последнего оттитровали 0,01000 М раствором MgSO4 (на титрование затратили 10,50 см3)?
6.1.4. На титрование 200,00 см3 раствора NiCl2 израсходовано 21,22 см3 0,02065 М раствора комплексона III. Определите концентрацию (г/дм3) раствора соли никеля.
28
6.1.5. При определении железа в воде объёмом 200,0 см3 его окислили до Fe3+, осадили аммиаком, отделили от раствора и после растворения в НСl оттитровали 5,14 см3 0,005 М (К = 1,101) раствора комплексона III. Найдите массу (в мг) железа в 1 дм3 воды.
6.1.6. К 10,00 см3 раствора NiCl2 добавили аммиачный буферный раствор и 20,00 см3 0,01085 М раствора комплексона III. Избыток комплексона оттитровали 0,01292 М раствора MgCl2, на титрование израсходовали 5,47 см3. Рассчитайте концентрацию (г/дм3) раствора NiCl2.
6.1.7. Какова молярная концентрация и поправочный коэффициент раствора комплексона III, если на титрование 25,00 см3 раствора, полученного растворением 3,1281 г х.ч. сульфата цинка в мерной колбе вместимостью 1 дм3, израсходовано его 23,80 см3?
6.1.8. Концентрация стандартного раствора комплексона III была установлена по раствору, содержащему в 1 дм3 24,0000 г Fe (NH4)(SO4)2 ∙ 12 H2O (марки х.ч.). На 10,00 см3 этого раствора пошло 10,30 см3 раствора комплексона. Рассчитайте молярную концентрацию и титр по CaO раствора комплексона III.
6.1.9. Рассчитайте массовую долю (в %) цинка в руде, если на титрование раствора, приготовленного из её навески массой 0,9003 г, затрачено 19,51 см3 0,1015 М раствора комплексона III.
6.1.10. Чему равна молярная концентрация цинка в растворе, если при титровании 20,15 см3 этого раствора пошло 9,35 см3 0,0500 М раствора комплексона III?
6.1.11. Для определения содержания сульфат-ионов в воде минерального источника к 150,0 см3 прибавили 25,00 см3 0,1115 М раствора BaCl2. Не фильтруя осадок сульфата бария, остаток хлорида бария оттитровали 14,00 см3 0,01242 М раствора комплексона III. Вычислите концентрацию сульфат-ионов в мг/дм3.
6.1.12. Навеска CaCl2 массой 1,1187 г растворена в мерной колбе вместимостью 100,0 см3. 10 см3 приготовленного раствора оттитровано 9,45 см3 стандартного раствора комплексона III с титром по сульфату цинка 0,01695 г/см3. Вычислите массовую долю (в %) CaCl2 в образце.
6.1.13. Для комплексонометрического анализа соли висмута (III) приготовили 200,0 см3 раствора, в котором растворили 0,1100 г соли. На титрование 20,00 см3
29
этого раствора израсходовано 7,55 см3 комплексона III с титром по Bi2O3 0,001165 г/см3. Рассчитайте массовую долю (в %) Bi2O3 в образце.
6.1.14. Навеску соли алюминия массой 1,0000 г растворили в мерной колбе вместимостью 200, 0 см3. К 25,00 см3 анализируемого раствора добавили 25,00 см3 0,05 М раствора комплексона III, остаток которого оттитровали 16,83 см3 0,05 М раствора ZnSO4. Определите массовую долю (в %) алюминия в образце.
6.1.15. На титрование 50,00 см3 соли кальция затрачено 22,45 см3 стандартного раствора комплексона с титром по кальцию 0,002004 г/см3. Определите молярную концентрацию, титр и массу катионов кальция в анализируемом растворе.
6.1.16. Из 100,0 см3 анализируемого раствора соли свинца (II) отобрали для анализа 10,00 см3 раствора, добавили 20,00 см3 0,025 М раствора комплексона III, избыток которого оттитровали 12,00 см3 0,0259 М раствора MgSO4. Рассчитайте молярную концентрацию, титр и массу свинца в анализируемом растворе.
6.1.17. При анализе пробы производственных сточных вод объёмом 100,0 см3 сульфат-ионы осадили раствором ВаCl2, осадок сульфата бария отфильтровали, промыли и растворили в 30,00 см3 0,025 М раствора комплексона III (К=1,001). Избыток комплексона III оттитровали 15,00 см3 0,025 М (К=0,99987) раствора MgCl2. Определите концентрацию сульфат-ионов в мг/дм3.
6.1.18. Определите содержание массовой доли (в %) индифферентных примесей в MgSO4 ∙ 7Н2О, если после растворения его навески массой 0,1882 г на титрование затрачено 15,08 см3 стандартного раствора комплексона III с титром
0,01675 г/см3.
6.1.19. Рассчитайте массовую долю (в %) оксида кальция в образце, если навеску массой 1,0455 г растворили в мерной колбе вместимостью 250,0 см3. На титрование 25,00 см3 раствора затрачено 18,15 см3 стандартного раствора комплексона с титром 0,03780 г/см3.
6.1.20. Стандартный раствор хлорида кальция был приготовлен растворением 1,1200 г х.ч. СаСО3 в соляной кислоте. Раствор прокипятили для удаления СО2 и разбавили до 250,0 см3 в мерной колбе. На 25,00 см3 раствора СаСl2 затратили 22,62 см3 раствора комплексона III. Рассчитайте молярную концентрацию раствора комплексона III.
30
