
5604
.pdfдешёвом сырье, позволяет выявить факт замены им полноценного белка мяса. Жиры, определяемые по триглециридному составу методом ГХ, могут дать информацию о количестве жира и добавках постороннего жира. По определению жирно-кислотного состава можно сделать вывод о замене какао-масла гидрожиром в шоколаде и т.п.
Следует отметить, что в настоящее время некоторые виды хроматографии используют не как самостоятельные методы анализа, а как методы предварительного исследования или как методы подготовки пробы к последующему определению другими методами, в том числе хроматографическими. Так, при определении аминокислот в гидролизате белков мяса или крови методом БХ, проводят предварительную очистку гидролизата на колонках с ионитами. Аналогично поступают при определении летучих оснований и свободных жирных кислот в мясе и рыбе. Методом ТСХ устанавливают наличие в исследуемом образце хлорорганических пестицидов, количественное определение которых затем проводят методом ГЖХ.
Особенно эффективным оказалось применение независимой аналитической идентификации и определение продуктов хроматографического разделения при сочетании ГХ и ВЖХ с другими методами исследования: инфракрасной спектроскопией и масс-спектрометрией. Методом масс-спектрометрии можно проводить непрерывный анализ компонентов смеси, причем для небольших количеств веществ. Такой комбинированный (гибридный) метод получил название хромато-масс-спектрометрии. Например, определение пестицидов, остатков лекарственных веществ (пенициллинов, сульфаниламидов и др.) проводят, используя комплекс: ГХ (или ВЖХ) – масс-спектрометрия. Возможно сочетание хроматографии с методами ядерного магнитного резонанса, пламенной фотометрии, абсорбционной спектрометрии и др.
Применение хроматографии наряду с другими физико-химическими методами, а также их взаимное сочетание, является тенденцией в разработке методик исследования качества потребительских товаров.
Происходит пересмотр государственных стандартов. Так, введены новые стандарты по исследованию качества воды питьевой на содержание хлорорганических пестицидов и этилового спирта и водки на содержание токсичных микропримесей методом газожидкостной хроматографии. На рисунке 4.7.3 представлена хроматограмма токсичных микропримесей водки и этилового спирта из которой видно, что методом ГЖХ с использованием
91
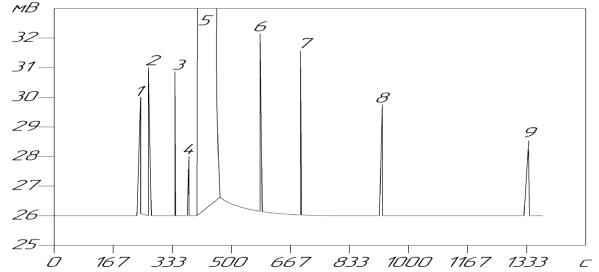
капиллярной колонки возможно раздельное определение всех компонентов (в отличие от методик предшествующего ГОСТа).
Рисунок 4.7.3 – Хроматограмма градуировочной смеси, полученная на хроматографе, оснащённом капиллярной колонкой HP-FFAP (США):
1 – уксусный альдегид; 2 – метиловый эфир уксусной кислоты; 3 – этиловый эфир уксусной кислоты; 4 – метиловый спирт; 5 – этиловый спирт;
6 – пропанол-1; 7-изобутиловый спирт; 8 – н-бутанол-1; 9 – изоамиловый спирт
Методы хроматографии обладают большой аналитической ёмкостью и, как уже было отмечено выше, находят самое широкое применение.
4.8. Примеры определения методом хроматографии
Работа № 1. Определение хлорида натрия в смеси с уксусной кислотой методом ионного обмена
Определение основано на том, что при пропускании исследуемого раствора через колонку с сильнокислотным катионитом в Н-форме в результате реакции ионного обмена
R – SO3H + NaCl + (CH3COOH) = R – SO3Na + HCl + (CH3COOH) получается смесь HCl и CH3COOH (элюат). Содержание свободной уксусной кислоты предварительно находят титрованием пробы исходного анализируемого раствора щёлочью. Титруя элюат раствором щелочи, определяют суммарное количество кислот, эквивалентное содержанию NaCl и CH3COOH. Содержание NaCl определяют по разности.
92
Подготовка катиона
В стакан помещают 15 г. воздушно-сухого сильнокислого катионита, заливают дистиллированной водой и оставляют на 30 мин для набухания. Затем катионит отмывают от пыли декантацией дистиллированной водой. Набухший катионит переносят в стеклянную колонку (диаметр 12 – 20 мм, высота 300 мм), в которую предварительно на 1/3 высоты наливают воду. Над слоем ионита всё время должна находиться жидкость. Если в колонку попали пузырьки воздуха, ионит надо взрыхлить стеклянной палочкой.
Для переведения катионита в Н-форму через колонку пропускают 2М раствор соляной кислоты. Для обработки 15 г катионита достаточно 200 – 300 см3 2 М рствора HCl. Кислоту пропускают через ионит со скоростью 10 см3/мин. (примерно 2 капли в 1 с). Окончив пропускание кислоты, жидкость в колонке опускают до верхнего слоя катионита и промывают катионит водой. Полноту отмывания катионита от кислоты проверяют по метиловому оранжевому. Для этого отбирают каплю вытекающего из колонки раствора на предметное стекло и добавляют каплю индикатора. Если окраска раствора станет жёлтой, то считают, что катионит полностью отмыт от кислоты.
Подготовленный таким образом Н-катионит можно использовать для ионного обмена и хроматографических разделений.
Внимание!
1.Над слоем ионита всё время должна находиться жидкость. В случае образования пузырьков воздуха катионит следует взрыхлить стеклянной палочкой.
2.Регулирование скорости фильтрации осуществляют зажимом в нижней части хроматографической колонки.
Методика определения
Полученный от преподавателя анализируемый раствор не требует разбавления.
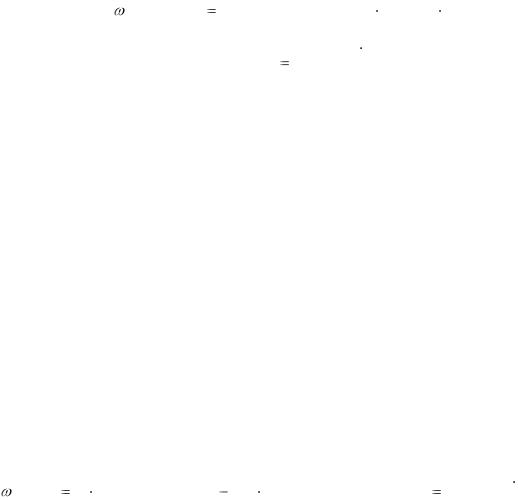
1. Определение содержания уксусной кислоты. 10,00 см3 (Vа) исследуемого раствора переносят в коническую колбу для титрования, добавляют 5 – 6 капель индикатора фенолфталеина и титруют 0,1 М раствором NaОН до получения устойчивого в течение 30 с малинового окрашивания. Титрование повторяют до трёх сходящихся результатов (V1). Массообъёмную долю уксусной кислоты рассчитывают по формуле
93
|
КТ NaOH /CH COOH VNaOH |
100 |
, |
|||
СH COOH |
|
Va |
|
|||
3 |
|
3 |
|
|
||
|
|
|
|
|
||
где TNaOH /CH COOH |
c(NaOH ) M (CH3COOH ) |
; |
||||
1000 |
|
|
|
|||
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
К– поправочный коэффициент.
2.Проведение ионного обмена. С помощью пипетки вносят 10,00 см3
анализируемого раствора в подготовленную колонку. После впитывания катионитом 8 – 9 см3 раствора через колонку пропускают дистиллированную воду со скоростью 1 капля/с; вытекающий из колонки элюат собирают в коническую колбу для титрования. Для полного вымывания выделившихся кислот (полноту вымывания проверяют с каплей раствора на предметном стекле
по индикатору метиловому оранжевому) через колонку необходимо пропускать около 100 см3 дистиллированной воды, тщательно собирая элюат в ту же колбу. Новую порцию воды прибавляют после того, как жидкость в колонке достигнет уровня 1 – 2 см над слоем ионита.
3.Определение содержания NaCl. Титруют элюат, содержащий смесь HCl и CH3COOH 0,1 М, раствором NaОН, используя в качестве индикатора фенолфталеин. Опыт повторяют 3 раза. Рассчитывают средний объём щёлочи (V2), пошедший на титрование смеси кислот. Массообъёмную долю NaCl в анализируемом растворе рассчитывают по формуле
/ NaCl |
К Т |
|
(V |
V ) |
100 |
|
, где T |
|
c(NaOH ) M (NaCl) |
. |
NaOH / NaCl |
|
|
NaOH / NaCl |
|
||||||
|
|
1 |
2 |
Va |
|
1000 |
|
|||
|
|
|
|
|
|
|
|
|||
Внимание: по окончании работы зажим закрывают, над ионитом оставляют 2 – 3 см жидкости.
Работа № 2. Определение поваренной соли в капустном рассоле методом ионного обмена
Хлорид натрия, проходя через хроматографическую колонку в Н-форме, как и в первой работе, переходит в HCl.
Имеющиеся в рассоле свободные кислоты проходят через колонку с катионитом без изменения, собираются в элюате и вместе с выделившейся соляной кислотой будут оттитрованы щёлочью. Поэтому для определения объёма щёлочи, пошедшего на титрование свободных кислот, необходимо провести контрольный опыт в аналогичной пробе.
Методика определения
20,00 см3 (Vконц) исследуемого раствора (рассола) с помощью пипетки переносят в мерную колбу (Vобщ) вместимостью 100,00 см3, объём доводят дистиллированной водой до метки и тщательно перемешивают.
94

1.Определение свободных кислот (контрольный опыт). Из мерной колбы отбирают пипеткой 10,00 см3 разбавленного раствора рассола, переносят в коническую колбу для титрования, добавляют 5 – 6 капель индикатора фенолфталеина и титруют 0,1 М раствора NaОН до появления устойчивой бледно-малиновой окраски. Титрование повторяют до трёх сходящихся результатов. Находят средний объём щелочи (V1).
2.Определения хлорида натрия. Отбирают пипеткой 10.00 см3 полученного раствора из мерной колбы и помещают в подготовленную колонку с катионитом
вН-форме. Раствор пропускают через катионит со скоростью 2 капли в 1 с вытекающий из колонки раствор собирают в коническую колбу вместимостью 250 – 300 см3. Затем через катионит пропускают 80-100 см3 дистиллированной воды, наливая её порциями по10 см3. Новую порцию воды наливают тогда, когда уровень жидкости в колонке достигает поверхности катионита.
Полноту вымывания выделившейся кислоты проверяют в капле фильтрата на предметном стекле с индикатором метиловым оранжевым (см. выше). Промывание заканчивают, когда цвет индикатора станет жёлтым. Кран в колонке перекрывают, а всё содержимое колбы оттитровывают 0,1 М раствором гидроксида натрия.
Титрование проводят в присутствии 5 – 6 капель фенолфталеина до появления бледно-малиновой окраски (находят объём щелочи V2). Определение проводят 2 – 3 раза, пропуская исследуемый раствор через ту же колонку.
Массо-объёмную долю NaCl рассчитывают по формуле
/ NaCl |
K T |
|
(V |
V ) |
|
Vобщ. 100 |
(%). |
|
|
|
|
||||||
|
|
NaOH / NaCl |
2 |
1 |
V |
V |
|
|
|
|
|
|
|
|
a |
конц. |
|
Регенерация катионита
После окончания определения катионит регенерирует, т.е. снова переводят в Н-формулу. Для этого через колонку с катионитом пропускают 20 см3 2М раствора HCl для извлечения поглощённых катионов, затем отмывают катионит от кислоты дистиллированной водой и до следующего определения катионит сохраняют в колонке, заполненной водой.
95
Библиографический список
1.Васильев В. П. Аналитическая химия : в 2 кн. Кн. 2. Физико-химические методы анализа / В. П. Васильев. – М. : Дрофа, 2002. – 384 с.
2.Дорохова Е. Н. Аналитическая химия. Физико-химические методы анализа / Е. Н. Дорохова, Т. В. Прохорова. – М. : Высш. шк., 1991. – 256 с.
3.Золотов Ю. А. Основы аналитической химии / Золотов Ю. А., Дорохова Е. Н., Фадеева В. И. – М. : Высш. шк., 2000. – 845 с.
4.Инверсионная вольтамперометрия : практическое руководство. – Томск : Издание ТПУ, 1995. – 67 с.
5.Лебухов В. И. Физико-химические свойства и методы контроля качества потребительских товаров / В. И. Лебухов, А. И. Окара, Л. П. Павлюченкова. – Хабаровск : РИЦ ХГАЭП, 1999. – 252 с.
6.Попадич И. А. Аналитическая химия / И. А. Попадич, С. Е. Трауненберг, Н. В. Осташенкова. – М. : Химия, 1989. – 240 с.
7.Харитонов Ю. Я. Аналитическая химия. Аналитика: в 2 кн. Количественный анализ. Физико-химические (инструментальные) методы анализа / Ю. Я. Харитонов. – М. : Высш. шк., 2003. – 559 с.
96
