
5604
.pdf
/ cu |
A x |
|
|
Vобщ. |
, |
E1% |
|
|
|||
|
l |
|
Va |
||
|
1см |
|
|
|
|
где Vобщ. – объём мерной колбы, Vа – объём исследуемого раствора.
Работа № 2. Определение железа (III) в виде трисульфосалицилата железа методом дифференциальной фотометрии
Определение основано на образовании в щелочной среде окрашенного в жёлтый цвет комплексного соединения железа (III) с сульфосалициловой кислотой состава 1:3 и использовании в качестве раствора сравнения раствора салицилата железа (III) известной концентрации. Интенсивность окраски полученного раствора комплекса, а, следовательно, и оптическое поглощение пропорционально содержанию Fe (III) в растворе.
Методика определения
1. Приготовление раствора сравнения. В мерную колбу на 50,00 см3
градуировочной пипеткой отмеривают 0,25 см3 стандартного раствора соли железа (III), содержащего 0,25 мг Fe3+ в 1 см3 раствор, 10 см3 10% раствора сульфосалициловой кислоты, 10 см3 раствора аммиака, доводят дистиллированной водой до метки, перемешивают.
2. Приготовление серии стандартных растворов соли. В мерные колбы вместимостью 50,00 см3 последовательно помещают с помощью градуировочной пипетки 0,5; 0,75; 1,0; 1,25; 1,5; 2,00 см3 стандартного раствора соли Fe3+. В каждую колбу отмеривают 10 см3 10% раствора сульфосалициловой кислоты, 10 см3 10% водного раствора аммиака, доводят дистиллированной водой до метки, перемешивают.
В каждом стандартном растворе рассчитывают ω/ Fe3+ по формуле
i |
Fe3 |
Fe 3 исх. Vi |
, |
|
|||
|
Vобщ. |
||
|
|
||
Vобщ. – объём мерной колбы (50,00 см3);
Vi – объём исходного стандартного раствора Fe3+;
ωi Fe3+исх. – массообъёмная доля Fe3+ в исходном стандартном растворе (0,025%). Расчёты приведены в таблице 2.9.2.
3. Измерение оптической плотности стандартных растворов. Измеряют оптическое поглощение стандартных растворов через 15 мин после их
31
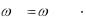
приготовления при длине волны 490 нм, в кювете с толщиной слоя 1 см3 относительно раствора сравнения. Результаты заносят в таблицу 2.9.2.
Таблица 2.9.2 – Результаты |
измерения оптического поглощения стандартных |
|||||||||
растворов |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
№ п/п |
Объём |
|
Содержание Fe3+ в растворе |
Оптическое |
|
|||||
исходного |
|
|
3 |
|
3 |
|
/ |
|
||
|
|
мг/см |
г/см |
ω |
поглощение |
|
||||
|
р-ра Fe3+ (III) |
|
|
|
|
|
||||
Р-р сравнения |
0,25 |
|
1,25∙10-3 |
1,25∙10-6 |
1,25∙10-4 |
|
|
|||
1 |
0,50 |
|
2,50∙10-3 |
2,50∙10-6 |
2,50∙10-4 |
|
|
|||
2 |
0,75 |
|
3,75∙10-3 |
3,75∙10-6 |
3,75∙10-4 |
|
|
|||
3 |
1,00 |
|
5,50∙10-3 |
5,50∙10-6 |
5,50∙10-4 |
|
|
|||
4 |
1,25 |
|
6,25∙10-3 |
6,25∙10-6 |
6,25∙10-4 |
|
|
|||
5 |
1,50 |
|
7,50∙10-3 |
7,50∙10-6 |
7,50∙10-4 |
|
|
|||
6 |
2,00 |
|
10,0∙10-3 |
10,0∙10-6 |
10,0∙10-4 |
|
|
|||
4.Построение калибровочного графика. По данным таблицы строят градуировочный график зависимости оптического поглощения (А) от концентрации Fe3+ в координатах А – ω/.
5.Определение содержания Fe3+ в анализируемом растворе. В мерную колбу на
50,00 см3 помещают 5,00 см3 исследуемого раствора соли Fe3+. Добавляют 10 см3 10% раствора сульфосалициловой кислоты, 10 см3 10% раствора аммиака, доводят дистиллированной водой до метки, перемешивают. Измеряют оптическую плотность раствора в тех условиях, что и для стандартных растворов.
5.1. Расчёт содержания Fe3+ по калибровочному графику. Определяют концентрацию Fe3+ в фотометрируемом исследуемом растворе по значению относительной оптической плотности на графике. Массообъёмную долю Fe3+ в анализируемом растворе рассчитывают по формуле
/ х |
/ граф. |
Vобщ. |
. |
|
|||
|
|
Vа |
|
2.10. Атомно-абсорбционный спектральный анализ
Метод атомно-абсорбционной спектроскопии (ААС) основан на измерении поглощения света (определённой длины волны) при прохождении его через пламя, где содержится анализируемый элемент. Поглощение происходит вследствие перехода электронов в атомах элемента, находящегося в пламени, на более высокие энергетические подуровни и поглощения при этом квантов света определённой энергии. Этим переходам в атомных спектрах соответствуют так
32

называемые резонансные линии (линии резонансного поглощения), характерные для данного элемента. В результате излучение, проходящее через атомный пар, ослабляется. Согласно закону Бугера – Ламберта – Бера, мерой концентрации элемента служит атомное поглощение А (оптическая плотность).
В качестве источника света для этих целей используются газоразрядные лампы низкого давления, которые дают резонансную линию определяемого элемента. Разработаны лампы практически для всех элементов таблицы Менделеева.
Этот анализ производится на специальных высокоатоматизированных спектрофотометрах, обеспечивающих высокую воспроизводимость условий измерений, автоматическое введение растворов и регистрацию результатов измерений. Современные модели интегрированы с ЭВМ. На рисунке 2.10.1 приведена принципиальная схема атомно-абсорбционного спектрофотометра.
Рисунок 2.10.1 – Принципиальная схема пламенного атомно-абсорбционного спектрофотометра
Для определения концентрации используют метод градуировочного графика и метод добавок.
Экспрессные методы ААС нашли широкое применение во всех отраслях науки, техники и производства. С его помощью определяют около 70 элементов, главным образом металлов.
Атомно-абсорбционная спектроскопия обладает высокой чувствительностью, поэтому её применяют преимущественно для анализа следовых количеств веществ. Предел обнаружения при электротермической атомизации составляет величину (мкг/мл) порядка 10-5 (Са, Cs, Ag, Mn и др.) или 10-6 (Ag, Cd, Zn, Cu, Fe, Ni и др.) и ещё больше (Al, Pb, Ba и др.). Погрешность определения обычно составляет примерно 5 %.
Широкое распространение этот метод нашёл в криминалистике, клинической медицине, при анализе пищевых продуктов и объектов
33
окружающей среды. Методом ААС исследуют пищевые продукты на предмет обнаружения в них минеральных элементов (Ca, Na, K, Mg, Al) и соединений тяжёлых металлов (Cu, Mn, Zn, Pb, Fe, Co, Ni, Sn, Cr, Cd, Sr и др.).
2.11. Люминесцентный анализ
Люминесцентный анализ – это совокупность оптических методов, основанных на явлении люминесценции, то есть свечении вещества, возникающим при его возбуждении различными источниками энергии.
Методы люминесцентного анализа классифицируют различным образом. Одна из классификаций основана на том, каким способом произведено
возбуждение.
Фотолюминесценция – свечение вещества, возникающее под воздействием излучения в ультрафиолетовой и в видимой области спектра.
Рентгенолюминесценция – свечение вещества под действием рентгеновских лучей.
Катодолюминесценция – свечение вещества в газовой фазе при бомбардировке его потоком электронов (катодными лучами).
Термолюминесценция – свечение вещества вследствие его возбуждения при нагревании.
Атомная флуоресценция – возбуждение атомов в плавлении. Триболюминесценция – механическое возбуждение.
Радиолюминесценция - возбуждение радиоактивным излучением и другие виды.
По второй классификации методы делятся по длительности послесвечения. Флуоресценция (спонтанная люминесценция) – свечение, прекращающиеся
сразу после прекращения действия источника возбуждения. Длительность послесвечения составляет ≈ 10-6-10-с с.
Фосфоросвечение – свечение, продолжающееся некоторое время после прекращения действия источника возбуждения. Длительность послесвечения составляет ≈ 10-2-10-3 с.
В аналитике из всех видов люминесценции наибольшее распространение получила флуоресценция, возникающая под воздействием излучения в УФ и в видимой области спектра.
Молекулы вещества, поглощая энергию ультрафиолетового света, переходят в возбуждённые энергетические состояния Ев. Поглощённая молекулой энергия
34
может быть частично израсходована на безызлучательные переходы (например, на увеличение энергии колебательных и вращательных движений, т.е. перейти в тепловую) и при обратном переходе из возбуждённого в основное состояние Ео, молекула излучит квант с меньшей энергией. При этом наблюдается свечение вещества в более длинноволновой области (обычно видимой).
Спектр люминесценции является индивидуальной характеристикой вещества. Характер спектра люминесценции определяется его природой. Энергия квантов света, излучившегося при люминесценции, всегда меньше энергии квантов, поглощаемых веществом. Это положение установлено экспериментально и известно как правило Стокса. Спектр люминесценции всегда смещён в сторону длинных волн по сравнению со спектром поглощения примерно так, как показано на рисунке 2.11.1. Чем больше стоксово смещение, тем более надёжно определение вещества люминесцентным методом.
Рисунок 2.11.1 – Спектр поглощения (1) и спектр люминесценции (2)
Эффективность преобразовании возбуждающего света в люминесцентное свечение характеризуется энергетическим и квантовым выходом люминесценции. Энергетический выход представляет собой отношение излучаемой веществом энергии люминесценции Ел к энергии поглощённого света Еn:
35
Вэн = Ел /Еn.
Квантовый выход – это отношение числа излучаемых квантов Nл к числу поглощённых квантов Nn:
Вкв = Nл /Nn.
Учитывая, что энергия кванта = hv, энергия N квантов Е = Nhv, тогда связь между Вэн и Вкв выразится:
Вэн = Nлhvл, / Nnhvп, = Вкв(vл /vn).
Энергетический выход люминесценции при возбуждении возрастает пропорционально длине волны возбуждающего света, затем остаётся постоянным и после достижения некоторой граничной длины волны резко падает (закон Вавилова).
В люминесцентном анализе о количестве вещества судят по интенсивности люминесценции Iл, которая пропорциональна числу излучаемых квантов, а их
количество |
прямо |
пропорционально |
концентрации |
вещества |
с |
(k – коэффициент пропорциональности): |
|
|
|
||
Iл = kс.
На снижение интенсивности люминесценции влияют такие факторы, как повышение температуры, изменение состава среды и вида растворителя, присутствие веществ – «тушителей» (галогены, Fe3+, Cu2+). Процессы, ведущие к снижению выхода люминесценции, называются тушением люминесценции.
Люминесцентный анализ нашёл широкое применение при исследовании пищевых продуктов. Установлено, что начало гниения бобов, белой и красной капусты, огурцов на ранней стадии можно определить по изменению цвета и интенсивности флуоресценции. Люминесценция свежего, лежалого и портящегося зерна различна. Метод позволяет обнаружить на ранних стадиях заболевание картофеля и отличать подмороженные клубни, имеющие белесовато-голубое свечение в ультрафиолете. Присутствие личинок гельминтов в мясе может быть обнаружено по их характерному розовому свечению в ультрафиолетовых лучах, а кишечная палочка обнаруживает себя свечением в зеленовато-жёлтых тонах. Широко используется метод при определении белков, которые светятся благодаря содержащимся в них ароматическим аминокислотам, так созревание сырного теста изменяет цвет флуоресценции от серо-синего до фиолетового. Свежие куриные яйца имеют интенсивно красную флуоресценцию, цвет которой при хранении меняется на голубой.
Спектральные люминесцентные характеристики используются для идентификации жиров, а по изменению положения максимума спектров
36
люминесценции жиров судят о степени их окисления. Топлёные животные жиры не флуоресцируют, маргарин светится в голубом диапазоне, а коровье масло в канареечно-жёлтом. Свечение молока от здоровых коров имеет флуоресценцию ярко жёлтого цвета, а молоко от коров с больным выменем, молоко с добавлением соды или 15 % воды флуоресцирует в бледно-жёлтых тонах. Кобылье молоко флуоресцирует в синей области спектра.
По цвету люминесценции устанавливается сорт муки и наличие в ней примесей: чем больше в ней отрубей, тем выше интенсивность синего свечения. Подробно разработаны методы качественного и количественного анализа для определения ряда витаминов (тиамина, рибофлавина, фолиевой кислоты).
2.12. Рефрактометрический анализ
К оптическим методам анализа относится и рефрактометрия. Рефрактометрический метод анализа основан на определении концентрации
вещества или природе вещества путём измерения показателя преломления. Преломлением или рефракцией называют изменение направления прямолинейного распространения света при переходе из одной среды в другую.
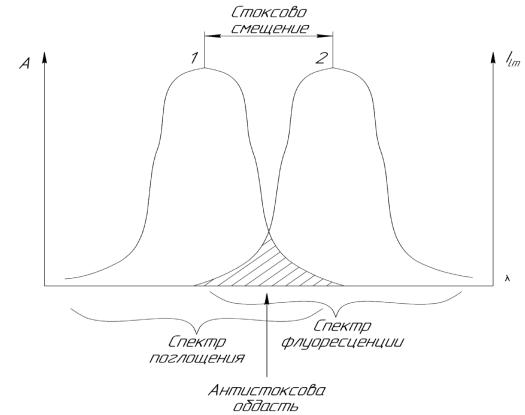
Если луч света пересекает границу раздела двух прозрачных однородных сред, то направление его изменяется, т.е. луч преломляется
(рисунок 2.12.1).
Рисунок 2.12.1 – Преломление светового луча на границы раздела двух прозрачных однородных сред
37

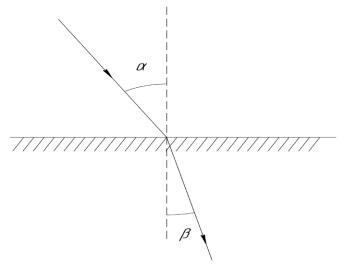
Согласно закону преломления, отношение синусов углов падения sin α и преломления sin β – есть величина постоянная для каждого вещества; её называют показателем преломления n:
sin
n . sin
Обычно используют показатели преломления, измеренные по отношению к воздуху. Показатель преломления вещества определяется его природой и зависит от температуры и длины волны падающего света. Чаще всего рефрактометрические измерения проводят при 20ºС и жёлтой линии в спектре натрия (линия Д). Соответственно они обозначают n 20Д . Показатель преломления зависит от концентрации вещества, поэтому метод рефрактометрии используют в количественном анализе. Показатель преломления можно измерять с помощью призм, при этом существуют различные варианты направления луча и измерения показателя преломления. Один из них – метод предельного угла (который заложен в основу конструкции многих типов приборов рефрактометров).
Если луч света проходит из менее плотной среды в более плотную, угол α больше угла β и n1<n2. Если угол α увеличить до максимума (90º), то падающий луч пойдёт вдоль границы раздела сред и, преломившись, образует предельный угол преломления (β) (рисунок 2.12.2).
Рисунок 2.12.2 – Предельный угол преломления
В соответствии с законом преломления
38
sin |
|
n2 |
; |
sin 90 |
|
n2 |
; |
1 |
|
n2 |
. |
|
|
|
|
|
|
|
|
||||
sin |
|
n1 |
|
sin |
|
n1 |
|
sin |
|
n1 |
|
Величина предельного угла на границе двух веществ зависит только от показателей преломления этих веществ. Следовательно, если известен показатель преломления одного вещества, то показатели преломления другого вещества можно определить, измеряя угол β. Удобство этого способа состоит в том, что требуется измерение только одного угла.
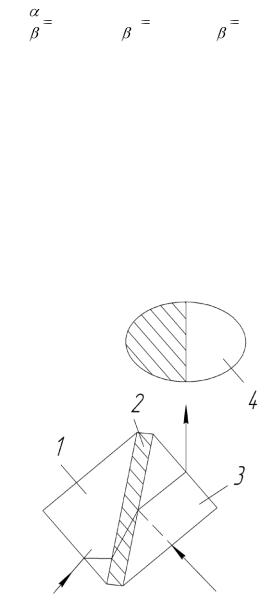
Существенной деталью большинства рефрактометров, основанных на определении предельного угла, является измерительная призма из оптического стекла с точно известным показателем преломления. Принципиальная схема рефрактометра типа Аббе приведена на рисунке 2.12.3.
Рисунок 2.12.3 – Принципиальная схема преломления лучей в призмах рефрактометра типа Аббе:
1 – осветлительная призма; 2 – слой анализируемой жидкости; 3 – измерительная призма; 4 – поле зрения в измерительной трубе
Каплю исследуемого раствора наносят на нижнюю призму и закрывают верхней. Между гранями обеих призм остаётся очень тонкий (0,1 – 0,2 мм) слой жидкости. Направленный луч света входит в осветительную призму, преломляется в ней, проходит слой анализируемой жидкости, преломляется на границе жидкости и измерительной призмы, затем на границе с воздухом и направляется в зрительную трубу. Видимое в зрительной трубе поле делится на светлую и тёмную части. При проведении измерений необходимо добиться,
39
чтобы появилась чёткая граница света и тени, разделяющая поле зрения пополам. Это достигается поворотом призмы.
Шкала рефрактометра Аббе градуирована непосредственно в значениях показателя преломления. В справочниках приводятся рефрактометрические таблицы для различных веществ, по которым, зная показатель преломления, находят массовую долю в процентах.
Лабораторный рефрактометр – сахариметр имеет дополнительную шкалу для определения сахара.
Метод рефрактометрии широко применяют для исследования таких продуктов, как жиры, варенье, джем, для контроля производства кондитерских изделий, напитков, некоторых видов консервов и т.д.
Глава 3. Электрохимические методы анализа
Методы, основанные на процессах, происходящих на электродах или межэлектродном пространстве, называются электрохимическими.
При выполнении анализа используют функциональную зависимость тока, потенциала или электрической проводимости (сопротивления) от концентрации анализируемого вещества в растворе. Несмотря на то что число параметров, характеризующих электрические свойства растворов, ограничено, известно много электрохимических методов. Дело в том, что любой из параметров (ток, потенциал) можно в процессе проведения анализа задавать или изменять. Комбинируя различными способами задаваемый и изменяемый параметр, можно иметь дело с различными электрохимическими методами анализа.
Взависимости от способа получения информации различают: прямые методы определения – в которых из измеряемых электрических величин непосредственно получают аналитическую информацию; методы индикации – (косвенные методы анализа) применяют в титриметрии для установления конечной точки титрования (потенциометрическое, амперометрическое титрование, кондуктометрическое).
Всоответствии с процессами, происходящими на электродах, электрохимические методы подразделяют на две основные группы. К первой относятся методы, основанные на протекании электродной электрохимической реакции, ко второй – методы, не связанные с протеканием подобной реакции. В свою очередь среди методов первой группы различают методы с наложением
40
