
5598
.pdf




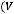




 ,
,
где Х – число омыления, мг/ 1г; 56,11 – молярная масса КОН, г/моль;
V1 – объем раствора НСI, израсходованного на титрование контрольной пробы, см3;
V2 – объём раствора НСI, израсходованного на титрование анализируемого раствора, см3;
с(НСI) – концентрация раствора НСI , моль/дм3;
m– навеска масла, г.
3.Определение йодного числа СН3(СН2)7СН=СН(СН2)7СOOH+I2→CH3(CH2)7CHI-CHI(CH2)7COOH.
Реакция протекает медленно и ускоряется при замене йода смесью растворов йода и брома (бромистый йод BrI). Избыток йода титруют раствором тиосульфата натрия. Зная введённую массу йода, находят количество йода, вступившего в реакцию с неопределёнными кислотами.
Вконическую колбу отбирают 0,2 – 0,4 г масла или жира и растворяют в 10 см3 хлороформа. Во вторую колбу помещают 10 см3 хлороформа (контрольная проба). В обе колбы вводят по 25 см3 раствора Гануса, закрывают пробками, смоченными раствором йодида калия, нагревают на водяной бане до 30 С и оставляют в затемнённом месте на 1 ч, затем в обе колбы добавляют по 10 см3 раствора йодида калия и 50 см3 дистиллированной воды, при этом образуется йод:
С и оставляют в затемнённом месте на 1 ч, затем в обе колбы добавляют по 10 см3 раствора йодида калия и 50 см3 дистиллированной воды, при этом образуется йод:
BrI+KI→KBr+I2.
Избыток йода оттитровывают раствором тиосульфата натрия до появления жёлтой окраски. К титруемому раствору добавляют раствор крахмала и продолжают титровать до исчезновения синей окраски
Йодное число (N), г I2/100г вычисляют по формуле
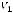

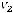

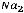




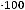 ,
,
где V1 – объём раствора тиосульфата натрия израсходованного на титрование контрольной пробы, см3;
V2 – объём раствора тиосульфата натрия израсходованного на титрование анализируемого раствора, см3;
c(Na2S2O3) – концентрация раствора тиосульфата натрия, моль/дм3; m – масса навески жира, г.
21

4. Определение перекисного числа Навеску масла 2 – 3 г растворяют в 30 мл смеси, состоящей из 12 см3
хлороформа и 18 см3 безводной уксусной кислоты, в колбе с притёртой пробкой. К полученному раствору прибавляют 1 см3 насыщенного водного насыщенного раствора калия. Через 2 минуты добавляют 50 см3 воды, добавляют 0,5 см3 крахмала до появления однородной фиолетово-синей окраски и оттитровывают раствором тиосульфата натрия 0,01 моль/дм3 до молочно-белой окраски, устойчивый в течение 5 с. Одновременно проводят контрольное определение – титрование пробы, в которую вместо масла добавляют 2 см3 воды.
Расчёт ведут по формуле


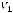
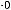

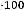 ,
,
где Х – перекисное число, г/100 г;
V1 – объём раствора тиосульфата натрия, израсходованного на титрование контрольной пробы, см3;
V2 – объём раствора тиосульфата натрия, израсходованного на титрование анализируемого раствора, см3; 0,001 269 – масса йода (г) эквивалентная 0,01 моль/дм3 раствора тиосульфата натрия;
m – масса навески жира, г.
Вопросы и задания для самоподготовки
1.Что представляют собой жиры? К какому классу соединения они относятся? От чего зависит консистенция жира?
2.Напишите структурную формулу смешанного триглицерида пальмитоолениостеарина. Проведите его омыление.
3.Какие факторы влияют на окисление масел и жиров? Приведите примеры реакций образования вторичных продуктов окисления.
4.Напишите схему получения пальмитодиолеина. Получите из него жидкое и твёрдое мыло.
5.Что представляет собой кислотное число? Навеска жира (масса 1 г) содержит 0,06 г свободной пальмитиновой кислоты. Вычислите кислотное число.
6.Что представляет собой число омыления? Вычислите массу КОН (мг), необходимую для омыления 1г триглицеоида олеиновой кислоты.
7.Что характеризует водное число? Какова его размерность? Какое количество йода (г) должно теоретически расходоваться на йодирование 1 г олеиновой кислоты?
22
ЛАБОРАТОРНАЯ РАБОТА 3.2.
АНАЛИЗ ЖИРОВ МЕТОДОМ ЛЮМИНЕСЦЕНТНОГО АНАЛИЗА
Люминесцентный метод исследования жиров и масел основан на свойствах вида жира по-своему люминесцировать в потоке ультрафиолетовых лучей. Явление люминесценции (флуоресценции) основано на способностей атомов или молекул вещества отдавать поглощённую световую энергию в виде светового излучения. Энергия квантов света, выделяющаяся при люминесценции, всегда меньше энергии квантов возбуждающего света. Если возбуждать флуоресценцию ультрафиолетовыми лучами, то излучается видимый свет. Этот метод позволяет достаточно быстро идентифицировать жир или масло. Для более точного определения желательно иметь известные образцы (стандарты) различных фидов жиров и масел.
Цель работы – произвести идентификацию жира и масла на основе данных люминесценции.
Реактивы, материалы и оборудование
Диэтиловый эфир; петролейный эфир; безводный сульфат натрия; чашки Петри; цилиндры мерные 50 см3; колба коническая с притертой пробкой на 250 см3; стаканы химические на 100 – 150 см3; воронка диаметром 4 – 5 см; стеклянная палочка; весы лабораторные; шкаф сушильный с термометром; водяная баня; установка для перегонки; люминоскоп.
Ход работы
Если исследуемый образец представляет собой растительное масло, то в кювету наливают 10 – 15 см3 и помещают в смотровую камеру. Наблюдают свечение. Подсолнечное масло рафинированное и нерафинированное даёт люминесценцию жёлто-серого цвета или светло-голубого; оливковое, рапсовое, кукурузное – 2). Минеральные масла (технические) дают сине-сиреневую люминесценцию, поэтому даже небольшая добавка минерального масла к растительным маслам меняет исходный цвет на сине-сиреневый или синий.
Если исследуемый образец представляет собой твёрдый жир, то в кювету помещают кусочек размером 3*4 см и переносят в смотровую камеру. Наблюдают свечение (таблица 1). Если имеется известный образец данного жира, то его помещают рядом с исследуемым для сравнения люминесценции.
Навеску 4 – 5 г опытного образца заливают 2 – 3 кратным объёмом петролейного или диэтилового эфира. Для удаления влаги в колбу добавляю безводный сульфат натрия. Колбу закрывают пробкой и оставляют на 15 – 20 мин, периодически взбалтывая. Жидкую часть фильтруют в стакан.
23
Растворитель отгоняют на водяной бане и жир досушивают в сушильном шкафу при температуре 102 С в течение 1 часа. Стаканы с оставшимся жиром помещают в морозильную камеру для застывания. Затем помещают жир в смотровую камеру и наблюдают люминесценцию.
С в течение 1 часа. Стаканы с оставшимся жиром помещают в морозильную камеру для застывания. Затем помещают жир в смотровую камеру и наблюдают люминесценцию.
Таблица 1 – Показатели люминесценции жиров
Вид жира |
Цвет жира при дневном свете |
Люминесценция жира в |
|
|
ультрафиолете |
|
|
|
Масло сливочное |
|
От бледнодо ярко- |
|
|
желтого |
|
|
|
Маргарин сливочный |
|
Голубоватый |
|
|
|
Маргарин столовый |
|
Голубоватый |
|
|
|
Маргарин особый |
|
Голубоватый |
|
|
|
Кулинарный жир |
|
Интенсивно-голубой |
|
|
|
Сало растительное |
|
Интенсивно-голубой |
|
|
|
Таблица 2 – Цвета растительного масла различных культур при дневном свете и в ультрафиолетовом излучении
Вид масла, название |
|
|
Цвет масла при |
Люминесценция |
|
|
|
|
|
|
дневном свете |
масла |
в |
|
|
|
|
|
ультрафиолете |
|
|
|
|
|
|
|
|
Оливковое «Olivia», Испания |
|
|
Светло-жёлтый |
Серо-голубой, |
|
|
|
|
|
|
|
светлый |
|
|
|
|
|
|
||
Оливковое очищенное (аптечное), |
|
Бесцветный |
Синий |
|
||
Испания |
|
|
|
|
|
|
|
|
|
|
|
|
|
Подсолнечное |
рафинированное |
с |
|
Бледно-жёлтый, |
Светло-голубой |
|
природным содержание витамина Е, |
|
почти |
|
|
||
без холестерина «Олейна», Франция |
|
|
бесцветный |
|
|
|
|
|
|
|
|
|
|
Подсолнечное |
нерафинированное |
|
Жёлтый |
Желто-серый |
или |
|
«Ставрополье», Россия |
|
|
|
светло-голубой |
|
|
|
|
|
|
|
|
|
Подсолнечное |
нерафинированное |
|
Жёлтый |
Желто-серый |
или |
|
«Домашнее», неароматное, Россия |
|
|
|
светло-голубой |
|
|
|
|
|
|
|
|
|
Рапсовое «Pura», |
|
|
|
Светло-жёлтый |
Молочно-голубой |
|
Англия |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
24 |
|
|
|
Вопросы и задания для самоподготовки
1.Какой из двух триглицеридов – тристеарат или триолеат – будет иметь твёрдую консистенцию? Подтвердите формулами.
2.Получите смешанный триглицерид из олеиновой, линолевой и линоленовой кислот. Проведите его гидрогенизацию. Чем отличается исходный жир от продукта реакции?
3.Какие виды порчи жиров вы знаете? Какие реакции при этом происходят? Меняется ли при этом вид люминесценции?
ТЕМА 4. МИНЕРАЛЬНЫЕ ВЕЩЕСТВА И ВОДА
ЛАБОРАТОРНАЯ РАБОТА 4.1. ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ИОНОВ КАЛЬЦИЯ (В СОКАХ,
ВИНАХ) ТИТРИМЕТРИЧЕСКИМ МЕТОДОМ
Контроль за содержанием ионов кальция имеет большое значение в производстве ряда пищевых напитков, вырабатываемых на виноградной основе: соков, вин. С увеличением содержания кальция увеличивается вероятность образования и выпадения в осадок виннокислых соединений в виде винного камня. Это требует постановки специальных тестов на склонность к помутнениям и анализа количественного содержания кальция в соках, напитках, винах.
Метод определения ионов кальция основан на осаждении ионов из пробы действием насыщенного раствора щавелевокислого аммония:
|
COOH4 |
|
COO |
||
|
Ca2+ |
|
|
|
Ca + NH3 |
|
COONH4 |
|
COO |
||
Образующийся осадок растворяют в серной кислоте: |
|||||
COO |
COOH |
||||
|
Ca + H2SO4 |
|
|
|
|
COO |
COOH + CaSO4 |
||||
И титруют перманганатом калия: |
|
|
|
||
COOH
COOH + 2KMnO4 + 3H2SO4 10CO2 + 2MnSO4 + K2SO4 + H2O
25
Цель работы – определить содержание ионов кальция в исследуемом образце вина титриметрическим методом.
Реактивы, материалы и оборудование
Баня водяная; выпарительные чашки, стеклянные стаканы; бюретка вместимостью 25 см3; пипетка; стеклянный фильтр №3; весы лабораторные аналитические; водоструйный насос; щавелевокислый аммоний (насыщенный раствор; серная кислота (1:4); перманганат калия С(1/5 КMnO4) = 0,1 моль/дм3.
Ход работы
1.Приготовление реактивов
-Раствор щавелевокислого аммония. 5,8 г щавелевокислого аммония растворяют в 100 см3 дистиллированной воды.
-Раствор серной кислоты. К 4 частям воды добавляют 1 часть концентрированной серной кислоты (осторожно!).
-Раствор перманганата калия: раствор готовится из фиксанала.
2.Проведение испытаний
25 см3 пробы исследуемого напитка помещают в выпарительную чашку или стеклянный стакан и нагревают на водяной бане до температуры 60 – 70 С, к пробе добавляют небольшими пропорциями при перемешивании 5 см3 насыщенного раствора щавелевокислого аммония и продолжают нагрев ещё 30 мин. Охлаждают.
С, к пробе добавляют небольшими пропорциями при перемешивании 5 см3 насыщенного раствора щавелевокислого аммония и продолжают нагрев ещё 30 мин. Охлаждают.
Осадок отфильтровывают на стеклянном фильтре №3 под вакуумом и промывают его 30 – 40 см3 горячей воды, при этом воду приливают пропорциями по 10 см3. Промытый осадок растворяют на фильтре в 20 см3 горячего раствора серной кислоты (1:4). Горячий раствор титруют раствором перманганата калия.
3. Содержание кальция вычисляют по формуле





 ,
,
где Х – концентрация кальция, мг/дм3;
V – объём раствора С(1/5 KMnO4) 0,1 моль/дм3 перманганата калия, пошедший на титрование, см3; 2,005 – количество кальция, соответствующее 1 см3 раствора перманганата
калия, С(1/5 KMnO4) 0,1 моль/дм3, мг; 1000 – пересчёт на 1 дм3;
Vпр – объём пробы, взятой для анализа, см3.
26
Вопросы и задания для самоподготовки:
1.Какие химические элементы относятся к макроэлементам?
2.Какие химические элементы относятся к микроэлементам?
3.Какие элементы являются токсичными? Охарактеризуйте один из них.
4.Какова роль кальция в организме?
5.Что собой представляет винный камень? Почему с увеличением содержания кальция увеличивается вероятность помутнений?
ЛАБОРАТОРНАЯ РАБОТА 4.2.
ОПРЕДЕЛЕНИЕ СОДЕРЖАНИЯ ИОНОВ ЖЕЛЕЗА (III) В БЕЛЫХ ВИНАХ МЕТОДОМ ФОТОМЕТРИИ
При избыточном содержании в вине некоторых металлов возникают пороки вина, которые называются металлическими кассами. Наиболее распространены железные кассы (белый, чёрный, синий), возникающие при содержании железа в вине более 10 мг/дм3. Железные кассы вызываются ионами Fe3+, которые образуют нерастворимые осадки. На поверхности вина появляется радужная плёнка, вина мутнеют, изменяют цвет (белые, например, становятся грязносерыми), приобретают железистый вкус и образуют тёмный осадок, который в зависимости от соотношения входящих в него железа, танинов и антицианинов имеет различную окраску – от фиолетовой до чёрной.
Метод определения содержания ионов Fe3+ в вине основан на взаимодействии железа с роданитом калия или аммония с образование комплексного соединения кроваво-красного цвета:
Fe3++n(SCN)- = Fe(SCN)n3-n.
Цель работы – определить содержание трехвалентного железа в предоставленном образце белого вина методом фотометрии.
Аппаратура, материалы, реактивы
Роданит калия или аммония, раствор 5%; стандартный раствор железоаммонийных квасцов 0,002 мг/см3; пероксид водорода, раствор 30 %; азотная кислота, плотность 1,20·103 кг/м3; серная кислота, плотность 1,54·103 кг/м3; мерные колбы вместимостью 100 см3 – 6 шт.; мерные колбы вместимостью 20 см3, 1000 см3 – по 1 шт; бюретка вместимостью 50 см3; градуированные пипетки вместимостью 2, 10, 20 см3 – по 1 шт; аналитические весы; фотоэлектроколориметр, кюветы 1 см; анализируемое вино.
27
Ход работы
1. Приготовление реактивов.
Основной реактив – стандартный раствор железоаммонийных квасцов
FeNH4(SO4)2,·12H2O
Вмерной колбе вместимость 1000 см3 растворяют 0,8936±0,0002 г квасцов в дистиллированной воде, добавляют 4 см3 серной кислоты, доводят до метки дистиллированной водой, перемешивают; 1 см3 полученного раствора содержит 0,1 мг Fe3+. В мерную колбу вместимостью 250 см3 из бюретки добавляют 50 см3 приготовленного раствора, добавляют дистиллированную воду до метки, перемешивают. В см3 полученного раствора содержится 0,02 мг Fe3+.
2.Построение градировочного графика
В4 мерные колбы на 100 см3 вносят 5; 10; 15; 20 см3 основного стандартного раствора железоаммонийных квасцов. В каждую колбу добавляют по 2,0 см3 раствора азотной кислоты, 6 капель раствора Н2О2, из бюретки вводят 40,0 см3 раствора роданида калия или аммония доводят дистиллированной водой до метки и перемешивают. Получают серию окрашенных в красный цвет растворов, содержащих в 100 см3 соответственно 0,1; 0,2; 0,3; 0,4 мг Fe3+.
Для учёта примеси Fe3+ в применяемых реактивах в мерную колбу вместимостью 100 см3 помещают 2,0 см3 раствора азотной кислоты, 6 капель раствора Н2О2, из бюретки вводят 40,0 см3 раствора роданида калия или аммония доводят дистиллированной водой до метки и перемешивают. Получают контрольный раствор.
Через 30 мин измеряют оптическую плотность растворов при длине волны 490 Нм относительно контрольного раствора.
По полученным данным строят градуировочный график в координатах: содержание Fe3+, мг/100 см3 – оптическая плотность раствора.
3.Проведение анализа на содержание железа в образце вина
Вмерную колбу вместимостью 100 см3 отбирают пипеткой 20,0 см3 анализируемого белого вина. В колбу добавляют 2, 0 см3 азотной кислоты, 6 капель раствора Н2О2, 40,0 см3 раствора роданида калия или аммония, доводят дистиллированной водой до метки и перемешивают.
Через 30 мин измеряют оптическую плотность окрашенного раствора на фотоэлектроколориметре при длине волны 490 Нм. По градуировочному графику определят концентрацию железа в исследуемом растворе, мг/20 см3 вина.
28
4. Расчет содержания железа
Содержание железа Fe3+ в анализируемом вине (Q, мг/дм3) расчитывают по
формуле: |
|
Q = |
, |
где q – найденное по градуировочному графику содержание Fe3+, мг в 20 см3 анализируемого вина Fe3+.
Вопросы и задания для самоподготовки:
1.Какие химические элементы относятся к микроэлементам? К ультрамикроэлементам?
2.Укажите причину непригодности приведенной в данной лабораторной работе методике для определения Fe3+ в красных винах?
3.Какую роль играет железо в организме человека и в каких пищевых продуктах оно содержится?
4.В каких продуктах содержится железо в легкоусвояемой форме?
ТЕМА 5. ВИТАМИНЫ
ЛАБОРАТОРНАЯ РАБОТА 5.1. ОПРЕДЕЛЕНИЕ β – КАРОТИНА В ОВОЩАХ И ФРУКТАХ
МЕТОДОМ ФОТОМЕТРИИ
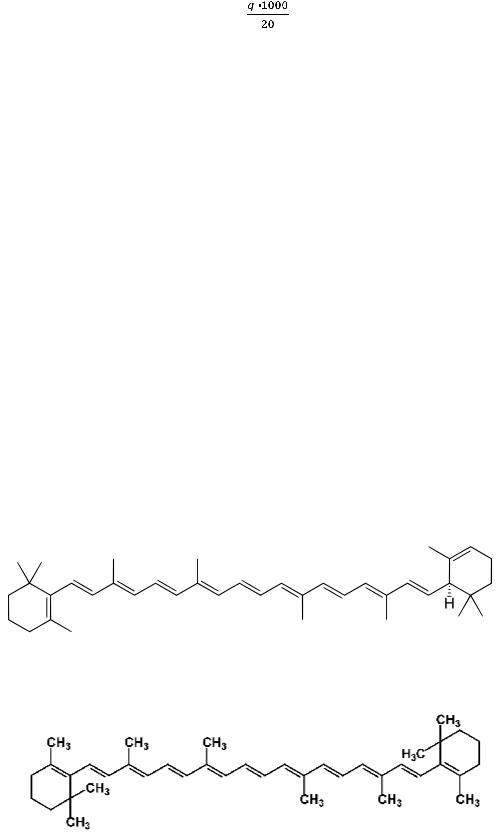
β-Каротин представляет собой пигмент оранжевого цвета и может быть определён фотометрически. β-Каротин – вещество изопреноидной структуры:
случае α-каротина:
β – каротин.
β-Каротин является провитамином А:
29
Из 1 молекулы β- каротина образуется 2 молекулы витамина А. Значительные количества β-каротина содержатся в плодах и ягодах оранжевого цвета (шиповник, морковь, хурма, облепиха):
1.Морковь – 9 мг/100 г.
2.Красный перец, шиповник – 2 – 3 мг/100 г.
3.Абрикосы, облепиха, тыква – 1,5 – 1,6 мг/100 г.
4.Помидоры – 1 мг/100 г.
5.Сельдерей, петрушка (зелень), черемша, шпинат – 4 – 5 мг/100.
Витамин А влияет на рост и развитие организма, формирование скелета и нормально существование клеток эпителия кожи и слизистых оболочек глаз, дыхательных, пищеварительных и мочевыводящих путей. Оказывает влияние на липидов. Обеспечивает функцию глаза, участвует в процессах зрения, повышает сопротивляемость инфекциям.
При небольшом дефиците витамина А появляется сухость и шелушение кожи, образование угрей, сухость волос, нарушение сумеречного зрения. При А- гиповитаминозе происходит падение аппетита, ухудшение роста у детей, исхудание, частые инфекции верхних дыхательных путей. Выраженный дефицит витамина А проявляется тяжёлыми нарушениями зрения, вплоть до слепоты.
Цель работы – определить содержание кератина в исследуемом пищевом продукте фотометрическим методом.
Реактивы, материалы и оборудование
Дихромат калия K2Cr2O7; петролейный эфир; сернокислый натрий Na2SO4 кристаллический; окись алюминия, кристаллическая; фарфоровая ступка и пестик; мерные колбы с притёртой пробкой 100 см3; весы аналитические; фотоколориметр или спектроколориметр.
Ход работы
1. Приготовление раствора стандартного образца Навеску дихромата 0,7200 г количественно переносят в мерную колбу
вместимостью 1000 см3. Растворяют в небольшом объёеме дистиллированной воды, доводят водой до метки. Срок хранения – 1 месяц со дня приготовления. 2. Построение калибровочной шкалы: в мерные колбы вместимостью 100 см3 из бюретки приливают 10; 20; 30; 40; 50 см3 стандартного раствора бихромата калия (концентрация 720 мг/дм3, оптическая плотность этого раствора равна оптической плотности раствора каротина 0,00416 мг/см3) и доводят до метки дистиллированной водой.
30
