
5422
.pdfВВЕДЕНИЕ
Химия, относящаяся к числу фундаментальных наук, всё основательнее проникает в сферу производственных технологий, в том числе и пищевой. Создание новых, совершенствование и коренное улучшение многих существующих технологических процессов сегодня невозможно без проникновения в механизм взаимодействия соответствующих компонентов, без увязывания технологических режимов.
Ещё М.В. Ломоносов в похвальном слове химии обращал внимание на то, что наука эта способствует нам в приготовлении вкусных питий и яств.
Подлинным основоположником научной кулинарии считают Д. В. Каншина. В своём капитальном труде («Энциклопедия питания»,1885 г.) им была выделена специальная глава «Кулинарная химия и физика». Особый интерес представляет попытка автора создать научные основы кулинарии. Серьёзное изучение кулинарных процессов с химической точки зрения, началось много позднее – после работ И. П. Павлова, М. Н. Шатерникова и др. Эти работы проводились под руководством Д. И. Лобанова и учёных его школы.
Питание является важнейшей биологической потребностью организма. Оно выполняет в организме ряд функций:
-покрывает энергозатраты на внутренние процессы (основной обмен) и внешнюю работу;
-доставляет организму пластический материал для построения новых тканей и восстановления отмирающих клеток;
-является поставщиком биологически активных веществ, регулирующих процессы обмена (ферментов, витаминов и т.д.), или материала для их построения;
-играет огромную роль в формировании иммунитета, т.е. защитных функций организма и т.д.
И. П. Павлов в своей нобелевской речи говорил, что пища олицетворяет собой весь жизненный процесс во всём его объёме и представляет собой ту связь, которая соединяет всё живое, в том числе и человека с окружающей природой.
5
Проблема пищи – одна из наиболее важных социально-экономических и научных проблем современности. Несмотря на все успехи науки и производства во всем мире увеличивается дефицит пищевых ресурсов вообще и качественного белка в особенности. На повестке дня остро стоят вопросы уменьшения потерь и увеличения эффективности переработки пищевых продуктов. Один из наиболее актуальных вопросов – выработка рационального режима обработки. Проблемный характер ориентации современной науки вызвал к жизни широкое развёртывание междисциплинарных и комплексных исследований, проводимых средствами нескольких различных научных дисциплин, конкретное сочетание которых определяется характером соответствующей проблемы. Примером этого является исследование проблемы обеспечения человечества пищей, находящееся на перекрестке технических наук, биохимии, химии, физики, медицины, экономики.
Удовлетворение потребностей человечества в продуктах питания является одной из наиболее важных и сложных проблем, стоящих перед обществом. Эта проблема имеет социальные, экономические, технические и гигиенические аспекты.
Общественное питание призвано обеспечить выпуск высококачественной продукции при экономном и рациональном использовании сырья и различных продуктов, организовать рациональное питание населения с учётом характера труда, быта, национальных особенностей, климатических и географических условий.
6
1 . Изменения белков и других азотистых веществ в технологических процессах производства продуктов
общественного питания
Белки являются важнейшим компонентом пищевых продуктов, определяя их биологическую ценность, а также структуру многих продуктов. В процессе кулинарной обработки пищевых продуктов белки претерпевают значительные физико-химические изменения.
1.1. Строение белков Белки – макромолекулы, которые представляют собой длинные цепи,
построенные из остатков сотен и тысяч аминокислот, соединенных пептидной связью -CO-NH. Иногда молекула белка содержит несколько цепей, соединённых друг с другом. Таким образом, белки являются своего рода полимерами аминокислот, имеющих весьма сложную пространственную структуру. Молекулы многих белков состоят не из одной, а из нескольких соединённых полипептидных цепей.
Продукт соединения аминокислот называется пептидом. Различают дипептиды, трипептиды и т.д. Продукты соединения многих аминокислот называют полипептидами. Белок можно, таким образом, рассматривать как высокомолекулярный полипептид.
Структура белка определяется не только химическим составом, но и порядком чередования различных аминокислотных остатков в полипептидной цепи, а также расположением этих цепей в пространстве, что обусловливает существование практически необозримого множества белков с разнообразными свойствами.
Различают четыре порядка морфологической организации белка или четыре структуры. Белки характеризуются прежде всего первичной структурой, т.е. последовательностью остатков аминокислот (первый порядок).
Второй порядок – та пространственная конфигурация, которую принимает сама полипептидная цепь.
7
Более устойчивой и более распространённой в белках является α-спираль.
Третичная структура белковой молекулы образуется при свёртывании полипептидной цепи в компактную трёхмерную систему, например в сферическую глобулу. Третичная структура более жёсткая и поддерживается связями различного характера (ионные, водородные, солевые) между боковыми группами пептидных цепей. При этом наибольшее значение имеют дисульфидные связи (-S-S-)между двумя половинками остатка цистина.
В зависимости от третичной структуры различают глобулярные и фибриллярные белки.
Четвёртый порядок – объединение нескольких частиц с третичной структурой в одну более крупную частицу. Наличие таких четырёх порядков организации макромолекулы не является обязательным для всех белков. Например, четвертичная структура может отсутствовать.
Пространственная структура белков задаётся их первичной структурой т.е. последовательность аминокислотных остатков в полимерной цепи определяет тип вторичной, третичной и высших структур белка.
1.2. Классификация белков Белки отличаются друг от друга по химическому (аминокислотному)
составу, по порядку чередования аминокислот в полипептидных цепях , по величине молекул и их пространственной структуре, по биологической ценности и функциям, которые они выполняют.
Все белки делят на группы: 1) простые; 2) сложные; 3) производные белков. К простым или протеинам относятся такие, которые при полном гидролизе дают только аминокислоты. Их делят на следующие группы: альбумины, глобулины, проламины, гистоны, склеропротеины, глютелины.
Альбумины – белки, растворимые в воде, свертываются при нагревании. Представители − альбумины молока, яйца, сыворотки крови; белки ферментов и семян растений.
8
Альбумины богаты серосодержащими и дикарбоновыми аминокислотами. В живых тканях альбумины обычно находятся в соединении с липидами, углеводами и другими белками.
Глобулины – белки, нерастворимые в воде, но растворимые в разбавленных солевых растворах, кислотах, щелочах; свёртываются при нагревании. Представители − глобулины молока, яйца, крови; белки мышц (миозин), семян растений(особенно бобовых и масличных культур).
Проламины – белки семян различных злаковых растений, растворимые в 60 − 80% спирте, нерастворимые в воде, хорошо растворимые в разбавленных растворах кислот и щелочей. При кипячении не свёртываются. Проламин из семян пшеницы и ржи называется глиадином, кукурузы – зеином и т.д.
Проламины выделяются из семян злаков, в которых содержится около 5% проламина. Значение проламина определяется тем, что они являются белковым пищевым компонентом хлебных злаков.
Гистоны – белки основного характера, содержат большое количество лизина и аргинина. Растворимы в кислых и нейтральных растворах, осаждаются аммиаком. Входят в состав клеточных ядер.
Склеропротеины – белки, резко отличающиеся от других белков по свойствам. Они растворяются лишь при длительной обработке концентрированными кислотами или щелочами, причём с расщеплением молекул. В животных организмах выполняют опорные и покровные функции; в растениях не встречаются. Представители – кератин − белок волос, шерсти, рогового вещества, эпидермиса кожи; эластин – белок стенок кровеносных сосудов, сухожилий; коллаген – белковое вещество кожи, костей, хрящей, соединительных тканей.
Глютелины – растительные белки, растворяются только в разбавленных растворах щелочей. Содержатся главным образом в семенах злаков (глютелин пшеницы образует основную массу клейковины).
Ксложным белкам, или протеидам, относят комплексы простых белков
снебелковыми компонентами (например, углеводами, фосфорной
9
кислотой, гетероциклическими соединениями, нуклеиновыми кислотами и т.п.).
Протеиды делят на ряд групп.
Фосфопротеиды – содержат остатки фосфорной кислоты, связанной эфирной связью с оксигруппой аминокислот серина и треонина. Представители − казеин – белок коровьего молока; вителлин – белок, входящий в состав желтка куриного яйца.
Нуклеопротеиды − белки, в которых собственно белковая часть связана с нуклеиновыми кислотами. Входят в состав ядер растительных и животных клеток.
Нуклеопротеиды входят в состав структурных элементов ядер клеток , обусловливающих передачу наследственных признаков, они являются специализированными нутриклеточными структурами.
Набухание белков и крахмала в водной среде сопровождается поглощением воды. Различают две формы существования воды в набухших полимерах – связанную, или гидратационную, и свободную, или капиллярную. Последняя в этом случае играет роль среды.
1.3. Гидратация и дегидратация белков Гидратацией называют способность белков связывать воду. При этом
основная часть воды связывается с белками адсорбционно. Различают два вида адсорбции − ионную и молекулярную.
Ионная адсорбция – связывание воды ионизированными свободными полярными группами (-NH3+,-COO-). Величина ионной адсорбции зависит от pH среды. Сдвиг pH среды в ту или иную сторону от изоэлектрической точки приводит к усилению диссоциации основных (NH2) или кислотных (COOH) групп белка, к увеличению заряда белковых молекул и усилению гидратации белка. В изоэлектрической точке (когда заряд белковой молекулы близок к нулю) способность белка связывать воду наименьшая.
Молекулярная адсорбция − присоединение молекул воды засчёт связанных полярных групп (пептидных групп полипептидных цепей –NH-
10
CO-, гидроксильных, сульфогидрильных и т.д.)Величина молекулярной адсорбции постоянна для каждого вида белка.
В растворах с малой концентрацией (молоко, жидкое тесто) белки полностью гидратированы и больше связывать воду не могут. Способность белков к дополнительной гидратации имеет большое значение в кулинарной практике. Дополнительная гидратация имеет место при добавлении воды к рубленому мясу (котлеты, биточки, бифштексы, фрикадельки, фарш для пельменей и т.д.), при добавлении молока к яйцам (изготовление омлетов), при изготовлении теста, при замачивании бобовых и т.д.
Для увеличения водосвязывающей способности белков в ряде случаев увеличивают заряд белковой молекулы путем сдвига рН от изоэлектрической точки (маринование мяса, рыбы и т.д.). От степени гидратации во многом зависят органолептические показатели качества готовой продукции − сочность, консистенция, вкус.
Дегидратация – потеря белками связанной воды при сушке продуктов, замораживания и размораживания мяса и рыбы, при тепловой обработке полуфабрикатов и т.д. От степени дегидратации зависит такой важный показатель, как выход готовых изделий.
1.4. Денатурация и свёртывание белков Белки природных продуктов называют нативными (натуральными). Под
действием различных факторов (физических, химических, биологических) происходит изменение природных свойств белков. Денатурация − нарушение нативной пространственной структуры белковой молекулы под влиянием внешних воздействий.
К числу таких воздействий можно отнести нагревание (тепловая денатурация), встряхивание, взбивание или другие резко механические воздействия (поверхностная денатурация), высокую концентрацию водородных или гидроксильных ионов (кислотная, щелочная денатурация). При кулинарной обработке денатурацию белков вызывает чаще всего нагревание.
11
При денатурации белков наиболее важную роль играет вода, добавленная извне или содержащаяся в составе самих пищевых продуктов. Известно, что такие продукты, как мясо, рыба, овощи и другие, содержат значительное количество влаги.
Роль и значение воды для денатурации белков легко объяснимы. При повышении температуры молекулы воды приобретают кинетическую энергию и в определённый момент эта энергия станет больше энергии связей, удерживающих белковую молекулу в нативном состоянии.
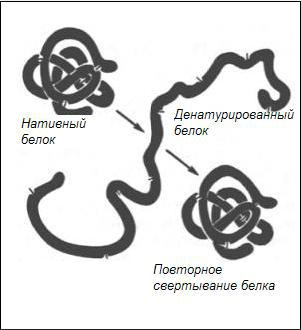
Агрегаты воды, имеющие при высокой температуре меньшие размеры и большую скорость диффузии, чем молекула белка, проникают во внутрь последних и постоянно ударяются о полипептидные цепи. При этом складки полипептидных цепей глобулярных белков начинают отходить друг от друга. Кроме того, молекулы белков постоянно испытывают движение, в результате чего разрываются солевые мостики, водородные, эфирные, ионные связи и гидрофобные взаимодействия. В результате разрыва этих связей, поддерживающих белковую молекулу в свёрнутом состоянии, полипептидная цепь разворачивается с потерей глобулярной формы, то есть денатурирует. Схема свёртывания денатурированного белка показана на рисунке 1.
Рисунок 1 − Схема свёртывания денатурированного белка
12
Впроцессе разворачивания цепи разорванные внутренние водородные связи во вторичной и третичной структурах нативного белка заменяются внешними водородными связями с водой, что обусловливает разрыхление структуры денатурированных белков глобул.
В«мягких» условиях денатурированный белок может обратно восстанавливать своё нативное состояние. Однако в условиях кулинарной обработки продуктов, в связи с проведением её в «жёстких» условиях, это явление исключено.
Взависимости от свойств нативных белков денатурация наступает при температуре 50 − 600С и ускоряется с повышением температуры.
При тепловой кулинарной обработке фибриллярные белки подвергаются денатурации. Однако характер денатурации зависит от особенностей их нативного строения. Например, в горячей воде эластин только набухает, а с коллагеном происходят более глубокие изменения, результатом которых является образование студня. И для денатурации фибриллярных белков решающую роль также играет вода. Однако при глубокой денатурации коллагена (кроме воды) важным фактором является продолжительность воздействия тепла.
Вколлагеновой молекуле под действием горячей воды происходит разрыв связей как внутри цепочек, так и между ними. Обычно выделяют три стадии глубокой денатурации коллагена. В первой стадии разрываются водородные связи внутри полипептидных цепочек коллагена, во второй происходит разрыв боковых связей, удерживающих полипептидные цепи молекулы коллагена в компактном состоянии, а в третьей – разрыв водородных связей между карбоксильными группами пептидных цепей и молекулами воды. Разделение процесса денатурации на стадии условное, т.к. в первую очередь должны разрываться слабые водородные связи.
Имеются данные, что в результате разрыва внутри- и межцепочечных связей из тройной спирали коллагена образуется двойная и одинарная спирали. При этом последняя приобретает форму клубка. Затем переходят
вклубок полипептидные цепочки двойной спирали.
13
Сокращение коллагеновых волокон при тепловой обработке обусловлено, вероятно, переходом тройной спирали молекулы коллагена в клубок.
Превращение ассоциированных длинных полипептидных цепочек молекулы коллагена в клубок заканчивается при температуре 62 − 650С, так как в этом интервале температур коллагеновые волокна сокращаются по длине в 3 − 4 раза и при дальнейшем нагревании существенных изменений не претерпевают.
При денатурации коллагена возможен разрыв и поперечных межмолекулярных ковалентных связей, если учесть, что при длительной гидротермической обработке коллаген распадется с образованием водорастворимых полимеров (глютинов) за счёт гидролиза лабильных пептидных связей в первичной структуре белка. Денатурация коллагена также необратима, как и глобулярных белков.
Если исходить из общего понятия денатурации, то более глубокие изменения коллагена с образованием водорастворимых глютинов также можно рассматривать как результат его денатурации. Отдельные приёмы первичной обработки также могут вызывать денатурацию белков пищевых продуктов. Изменение нативного состояния претерпевают белки при механическом способе замешивания, перемешивании измельчённых богатых белком продуктов и взбивании белковых веществ.
Белки зерномучных продуктов находятся в высохшем состоянии, при добавлении воды они сильно гидратируются за счёт образования водородных связей между молекулами белка и воды.
При перемешивании теста белок клейковины сильно вытягивается, что приводит к разрыву водородных, гидрофобных связей и солевых мостиков.
Следовательно, белковые вещества муки при замесе теста в результате механического вытягивания и разрыва нативных связей претерпевают денатурационные изменения.
Отдельные водорастворимые белки при взбивании способны образовывать на поверхности пузырьков воздуха мономолекулярные тонкие плёнки. Пептидные цепи молекулярного белка при механическом
14
