
- •Министерство образования Российской Федерации
- •Хабаровская государственная академия экономики и права
- •Кафедра естественнонаучных дисциплин
- •Химия
- •Учебное пособие
- •Хабаровск 2003
- •Министерство образования Российской Федерации
- •Хабаровская государственная академия экономики и права
- •Кафедра естественнонаучных дисциплин
- •И.А. Жарская
- •Н.Л. Мара
- •Химия
- •Часть 1
- •Химия. Часть 1. Общая химия: Пособие для абитуриентов и учащихся школы «Юный товаровед-эксперт» очной и заочной форм обучения/ И.А. Жарская, Н.Л. Мара. – Хабаровск: РИЦ ХГАЭП, 2003. – 91с.
- •Утверждено издательско-библиотечным советом академии в качестве учебного пособия для абитуриентов
- •Редактор Г.С. Одинцова
- •Уч.-изд. _____. Тираж_______экз. Заказ №_____
- •Обучающая задача 2
- •Решение:
- •Из закона Авогадро следует, что при одном и том же давление и одинаковых температурах массы (m) равных объемов газов относится как их молярные массы (М).
- •Форма и ориентация электронных орбиталей
- •Обучающая задача 1
- •Электронные
- •ХИМИЧЕСКАЯ СВЯЗЬ
- •ковалентная
- •связь
- •CuOHCl
- •основные
- •Способы выражения состава раствора
- •Важнейшие индикаторы
- •Твердый
- •Жидкий
- •Разбавленный
- •1 - 20. Написать уравнения диссоциации следующих электролитов
- •Тест 2
- •ТЕМА 2. СТРОЕНИЕ АТОМОВ
- •Тест 3
- •Тест 4
- •Тест 5
- •Тест 6
- •Тест 7
- •Тест 8
- •Тест 9
- •Тест 10
- •Тест 11
- •Тест 12
- •Тест 12
- •Тест 14
- •Тест 15
- •Кислоты
- •Тест 16
- •Соли
- •Тест 17
- •Тест 18
- •Тест 19
- •Тест 20
- •Тест 21
- •Тест 22
18
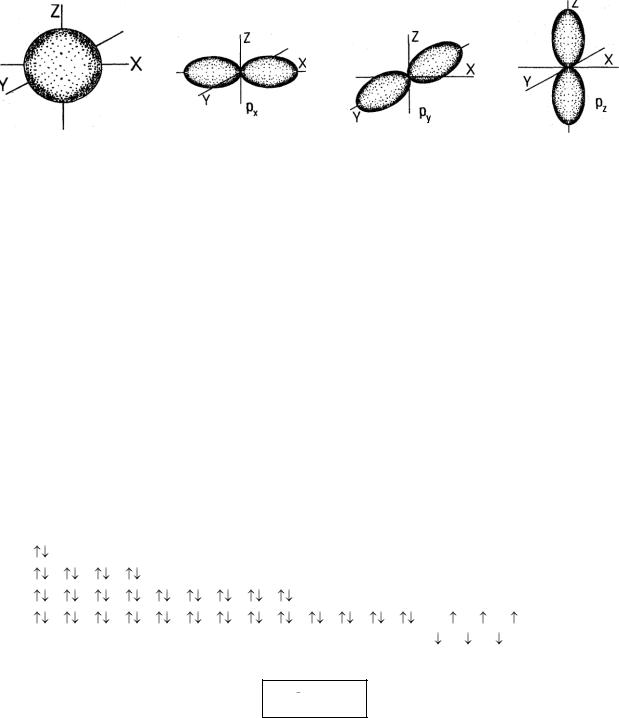
Форма и ориентация электронных орбиталей
S- электронная |
Px- электронная |
Py – электронная |
Pz - электронная |
орбиталь |
орбиталь |
орбиталь |
орбиталь |
Электронные формулы показывают распределение электронов по энергетическим уровням и подуровнями.
Ряд последовательного заполнения электронами орбиталей.
1s2| 1s2 2p6| 3s2 3p6| 4s2 3d10 4p6| 5s2 4d10 5p6| 6s2 4f14 5d10 6p6| 7s2 5f14 6d10 7p6|
Графическое изображение электронных структур атомов
– графические электронные формулы
|
S |
|||||||||||||||
n=1 |
|
|
P |
|||||||||||||
|
|
|||||||||||||||
n=2 |
|
|
|
|
|
|
d |
|||||||||
|
|
|
|
|
|
|||||||||||
n=3 |
|
|
|
|
|
|
|
|
|
|
|
|
f |
|||
|
|
|
|
|
|
|
|
|
|
|
|
|||||
n=4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
N( е ) = 2n2
N = наибольшее число электронов на энергетическом уровне;
n = номер уровня (главное квантовое число) соответствует номеру периода периодической системы элементов.
19
Тип элементов (электронное семейства) – зависит от того, какой под-
уровень последним заполняется электронами.
S-элементы – заполняется электронами s-подуровень внешнего уровня (первые 2 элемента каждого периода периодической системы Д.И. Менделеева – истинные металлы).
Р-элементы – заполняется р-подуровень внешнего уровня (последние 6 элементов каждого периода, кроме первого и седьмого периода - неметаллы).
d-элементы – заполняется d-подуровень второго снаружи уровня, а на внешнем уровне остается 1 или 2 электрона (элементы вставных декад больших периодов, расположенные между s и р-элементами – переходные элементы - металлы).
f-элементы – заполняется f-подуровень третьего снаружи уровня, а на внешнем уровне остается 2 электрона (лантаиды и актиноиды).
Структура периодической системы элементов Д.И. Менделеева
Порядковый номер |
|
Номер периода |
|
Номер группы |
|
Атомная |
элемента указывает |
|
соответствует |
|
характеризует |
|
масса равна |
на заряд ядра и |
|
количеству |
|
максимальное |
|
сумме про- |
общее число элек- |
|
энергетических |
|
число валент- |
|
тонов и |
тронов |
|
уровней |
|
ных электронов |
|
нейтронов |
|
|
|
|
|
|
|
Периодический закон: свойства простых веществ, а также формы и свойства соединений элементов находятся в периодической зависимости от зарядов ядер элемента.
Обучающая задача 1
Сколько протонов и нейтронов содержится в ядре ванадия ставьте электронную формулу атома ванадия и электронографическую схему. К какому электронному семейству относится этот элемент?
20
Решение:
Порядковый номер элемента в периодической системе элементов совпадает с величиной заряда ядра (индекс внизу слева символа элемента) следовательно, в ядре атома ванадия 23 протона. Верхний левый индекс у символа элемента указывает на величину массового числа А. Тогда число протонов Z = А – N = 50 – 23 = 27. Значит в ядре атома ванадия 27 нейтронов.
Электронная формула атома ванадия согласно шкале энергий (т. е. электрон занимает тот энергетический подуровень, на котором он будет обладать наименьшей энергией) будут иметь следующий вид:
23V 1s2 2s2 2p6 3p63s23p6 4d3 4s2.
Электрографические схемы отражают распределение электронов атомов по квантовым (энергетическим) ячейкам. В каждый квантовой ячейке может быть не более двух электронов. Орбитали данного подуровня заполняются сначала по одному электрону с одинаковыми спинами, а затем по второму электрону с противоположными спинами (правило Хунда). Так как последним заполняется, согласно «принципу минимума энергии», 3d подуровень, то элемент ванадий относится к d-электронному семейству.
Обучающая задача 2
В каком периоде, группе и подгруппе находится элемент, атом которого имеет следущее строение последнего и предпоследнего электронных уровней: 4s2 3d5? К какому электронному семейству относится этот элемент? Какова высшая степень окисления этого элемента в соединениях? Составьте формулы оксидов и гидроксидов этого элемента, отвечающих высшей степени окисления?
Решение:
Электроны атома расположены на четырех энергетических уровнях, следовательно, данный элемент находится в 4 периоде. Общее число s- электронов внешнего уровня и незавершенного d-подуровня равно семи, следовательно, элемент расположен в 7 группе побочной подгруппе. В периодической системе элементов в 7 группе побочной подгруппы 4 периода находится элемент Mn – это d-элемент, с высшей степенью окисления +7. Оксид отвечает формуле Mn2O7, гидроксид HMnO4.
21
Задания для самоподготовки
1.Приведите современную формулировку периодического закона. Как изменяются свойства у элементов IА группы. Ответ мотивируйте строением атомов элементов.
2.Как изменяются свойства элементов III периода слева направо. Ответ мотивируйте.
3– 12.Сколько протонов и нейтронов содержат ядра изотопов следующих элементов (см. табл. 1). Составьте электронную формулу и электронографическую схему данного атома; подчеркните валентные электроны; определите семейство.
Таблица 1
№ задач |
Изотопы Ме |
№ задач |
Изотопы |
|||||
неМе |
|
|||||||
|
|
|
|
|
|
|
||
3 |
16 |
18 |
O |
8 |
32 |
33 |
S |
|
|
8 |
|
O и 8 |
|
16 |
S и 16 |
||
4 |
1123 Na и 1124 Na |
9 |
1327 Al и 1326 Al |
|||||
5 |
30 |
|
28 |
Si |
10 |
39 |
40 |
К |
14 |
Si и 14 |
19 |
К и 19 |
|||||
6 |
56 |
|
54 |
Fe |
11 |
30 |
32 |
Р |
26 |
Fe и 26 |
15 |
Р и 15 |
|||||
7 |
199 |
F и 189 |
F |
12 |
1735 Cl и 1737 Cl |
|||
13 – 22. В каком периоде, группе и подгруппе находятся элементы, атомы которых имеют следующее строение предпоследнего и последнего электронного уровней (см. табл. 2) К какому электронному семейству относится данный элемент? Укажите эти элементы.
|
|
|
|
|
Таблица 2 |
|
|
|
|
|
|||
№ задач |
Строение |
№ за- |
Строение |
|||
электрона уровней |
дач |
электронных уровней |
||||
|
||||||
13 |
3s3 |
3p1 |
18 |
3s2 3p2 |
||
14 |
5s2 |
5p6 |
19 |
3s2 |
3p5 |
|
15 |
4s2 |
4p6 |
20 |
4s2 |
3d1 |
|
16 |
2s2 |
2p5 |
21 |
4s1 |
3d5 |
|
17 |
2s2 |
2p1 |
22 |
4s2 |
3d6 |
|
