
- •ГЛАВА 1. ОБЩИЕ ПРИНЦИПЫ АНАЛИЗА
- •1.1. Предмет и задачи аналитической химии
- •1.2. Классификация и общая характеристика методов анализа
- •1.3. Аналитические реакции
- •1.4. Химические методы качественного анализа
- •Классификация катионов по кислотно-основному методу
- •ГЛАВА 2. ПРАКТИКА КАЧЕСТВЕННОГО АНАЛИЗА
- •Оформление лабораторных работ
- •2.1. Первая группа катионов
- •2.2. Вторая группа катионов
- •2.3. Третья группа катионов
- •2.4. Четвертая группа катионов
- •2.5. Пятая группа катионов
- •2.6. Шестая группа катионов
- •2.7. Анионы
- •2.8. Анализ солей
- •Библиографический список
42
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Какими свойствами обладают гидроксиды катионов V группы?
2.Какие катионы V группы можно обнаружить дробным методом?
3.Какие катионы V группы можно обнаружить с помощью окислительновосстановительных реакций?
4.При действии щелочей на смесь катионов V группы выпал белый осадок. Какие катионы отсуствуют в исследуемом растворе?
5.Какова роль нитрата серебра AgNO3 при окислении Mn2+ пероксодисульфатом аммония (NH4)2S2O8?
6.Какой ион образуется при окислении Mn2+ сильными окислителями в кислой среде? Какова его окраска?
2.6.Шестая группа катионов
Кшестой аналитической группе относятся катионы d-элементов – Cu2+, Hg2+, Cd2+, Co2+, Ni2+. Хотя их элементы расположены в разных груп-
пах периодической системы Д. И. Менделеева – медь в первой, кадмий и ртуть во второй, кобальт и никель в восьмой, все эти катионы характеризуются способностью к комплексообразованию.
В водных растворах катионы VI группы находятся в гидратированном
состоянии в виде аквакомплексов типа [Cu(H2O)6]2+. Аквакомплексы Co2+, Ni2+ и Cu2+ окрашены: [Co(H2O)6]2+ - розового, [Ni(H2O)6]2+ - зеленого,
[Cu(H2O)6]2+ - голубого цвета. Окраска аквакомплексов – один из характерных признаков, указывающих на наличие этих ионов в растворе. Выпаривание растворов или действие дегидратирующих веществ, например, этилового спирта, вызывает изменение окраски этих ионов. Так, розовая окраска комплекса [Co(H2O)6]2+ заменяется на синюю вследствие дегидратации комплексных ионов и замены молекул воды другими лигандами.
Щелочи (КОН, NaOH) с растворами, содержащими катионы Cu2+, Cd2+, Ni2+, дают аморфные осадки гидроксидов, с катионами Hg2+ - оксиды, с катионами Co2+ - основные соли:
CuSO4 + 2KOH = Cu(OH)2 (T) + K2SO4,
CdCl2 + 2KOH = Cd(OH)2 (T) + 2KCl,
NiCl2 + 2KOH = Ni(OH)2 (T) + 2KCl,
HgCl2 + 2KOH = HgO (T) + 2KCl + H2O, CoCl2 + KOH = CoOHCl (T) + KCl.
Все эти осадки растворимы в кислотах и в избытке аммиака, кроме оксида ртути (II), который растворяется в концентрированном растворе аммиака при добавлении солей аммония (NH4Cl, NH4NO3). Растворимость гидроксидов в аммиаке отличает катионы VI групп от катионов IV и V групп. Поэтому избыток раствора аммиака служит групповым реактивом катионов VI группы.
43
Лабораторная работа
Действие группового реактива на катионы VI группы
Раствор NH4OH, прибавленный к растворам солей катионов VI группы в эквивалентных количествах, осаждает эти катионы в виде белых или окрашенных соединений разного состава:
2СuSO4 + 2NH4OH = (CuOH)2SO4 (T) + (NH4)2SO4,
голубовато-зеленый
CoCl2 + NH4OH = CoOHCl (T) + NH4Cl,
синий
2NiSO4 + 2NH4OH = (NiOH)2SO4 (T) + (NH4)2SO4,
светло-зеленый
СdCl2 + 2NH4OH = Cd(OH)2 (T) + 2NH4Cl,
белый
HgCl2 + 2NH4OH = [HgNH2]Cl (T) + NH4Cl + 2H2O.
белый
В избытке NH4OH эти осадки растворяются с образованием комплексов аммиакатов различной окраски. Образование комплекса гексаамминкобальта (II) и тетраамминртути (II) происходит в присутствии NH4Cl при нагревании:
(CuOH)2SO4 + 10NH4OH = 2[Cu(NH3)4](OH)2 + (NH4)2SO4 + 8H2O,
ярко-синий
CoOHCl + NH4OH + NH4Cl = [Co(NH3)6]Cl2 + NH4Cl + 6H2O,
желто-бурый
(NiOH)2SO4 + 14NH4OH = 2[Ni(NH3)6](OH)2 + (NH4)2SO4 + 12H2O,
синий
Cd(OH)2 + 4NH4OH = [Cd(NH3)4](OH)2 + 4H2O,
бесцветный
[HgNH2]Cl + 2NH4OH + NH4Cl = [Hg(NH3)4]Cl2 + 2H2O.
бесцветный
Гексаамминкобальт (II) окисляется кислородом воздуха до гексааминкобальта (III) вишнево-красного цвета. В присутствии окислителей (H2O2) образование гексаамминкобальта (III) происходит мгновенно:
2CoCl2 + 10NH4OH + 2NH4Cl + H2O2 = 2[Co(NH3)6]Cl3 + 12H2O.
Опыт. В пять пробирок поместить по 3 капли растворов солей Cu2+, Ni2+, Co2+, Cd2+ и Hg2+ и прибавить в каждую 1–2 капли 2М раствора NH4OH. К полученным осадкам основных солей меди, никеля и кадмия прибавить при перемешивании несколько капель концентрированного раствора NH4OH до растворения осадков. Осадок основной соли кобальта разделить на две части. К одной прибавить 3–4 капли 3% раствора Н2О2, а затем обе части осадка растворить, прибавив несколько капель концентрированного раствора NH4OH и насыщенного раствора NH4Cl. Осадок амидокомплекса ртути растворить в нескольких каплях концентрированного раствора NH4OH и насыщенном растворе NH4Cl при нагревании.
44
Реакции катиона меди (II) Cu2+
1. Гексацианоферрат (II) калия K4[Fe(CN)6] осаждает ион Cu2+ в ви-
де гексацианоферрата (II) меди красно-бурого цвета:
2Cu2+ + Fe(CN)64- = Cu2[Fe(CN)6] (T).
Осадок не растворяется в разбавленных кислотах, но разлагается щелочами с образованием Cu(OH)2.
Опыт. К 2–3 каплям раствора CuSO4 прибавить 1- 2 капли реактива. Осадок разделить на две части, к одной прибавить 2–3 капли 2М раствора HCl, к другой – 2–3 капли 2М раствора NaOH.
2.Раствор аммиака в избытке образует с катионами Сu2+ аммиачный комплекс интенсивно синего цвета (см. реакцию с групповым реагентом).
3.Щелочи NaOH и КОН образуют с катионами Cu2+ голубой осадок Cu(OH)2, при нагревании разлагающийся с образованием CuO черного
цвета:
Cu2+ + 2OH- = Cu(OH)2 (Т),
Cu(OH)2 (Т) = CuO(Т)+ H2O.
Осадок Cu(OH)2 легко растворяется в разбавленных сильных кислотах
Cu(OH)2 + 2H+ = Cu2+ + 2H2O
и заметно растворим в растворе щелочи с образованием куприт-ионов:
Cu(OH)2 + 2OH- = CuO22- + 2H2O.
Опыт. К 4–5 каплям раствора CuSO4 прибавить 3–4 капли 2М раствора NaOH. Осадок разделить на 3 части. Одну часть прокипятить до появления осадка CuO черного цвета. Ко второй части добавить 2–3 капли 2М раствора HCl, к третьей – 3–4 капли 6М раствора NaOH.
4. Al, Zn, Fe восстанавливают ионы меди до элементной меди;
CuSO4 + Zn = Cu (T) + ZnSO4.
Опыт. Зачистить кусочки металла фильтрованной бумагой смоченной раствором соды и промыть водой. На поверхность металла нанести каплю раствора соли меди и через несколько минут наблюдать появление корич- нево-красной окраски мелкодисперсной меди.
Реакции катиона кобальта (II) Co2+
1. Тиоцианат аммония NH4NCS в присутствии амилового спирта или диэтилового эфира образует с катионами Со2+ тетратиоцианокобальтат (II) аммония синего цвета, экстрагируемый амиловым спиртом (диэтиловым эфиром):
CoCl2 + 4NH4NCS = (NH4)2[Co(NCS)4] + 2NH4Cl.
В водном растворе этот комплекс малоустойчив. Устойчивость комплексного иона повышается в органическом растворителе. Ионы Cu2+ мешают
45
реакции, образуя с реактивом комплексный ион [Cu(NCS)4]2- желто-бурого цвета.
Опыт. К 2–3 каплям раствора CоСl2 прибавить 8–10 капель насыщенного раствора NH4NCS и 5–6 капель амилового спирта, встряхнуть, наблюдать окраску в органическом растворителе.
2. Нитрозо-R-соль дает с ионами Со2+, окисляя их до Со3+, краснобурый осадок внутрикомплексной соли:
Предел обнаружения – 0,05 мкг.
Опыт. К 2–3 каплям раствора CoCl2 прибавить 1–2 капли уксусной кислоты, 5 капель свежеприготовленного реактива и нагреть на водяной бане. Если осадок не выпадает, потереть палочкой о стенки пробирки.
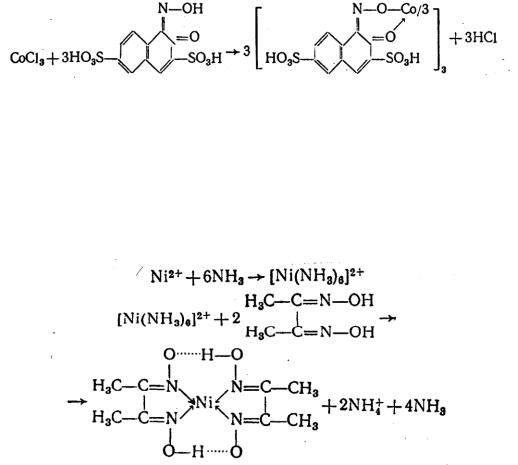
1. Реакция катиона никеля (II) Ni2+
Диметилглиоксим (реактив Чугаева) осаждает катионы в аммиач-
ной среде в виде внутрикомплексного соединения ало-красного цвета:
Осадок растворим в сильных кислотах и заметно растворим в концентрированном растворе NH4OH. Если присутствуют мешающие проведению реакции ионы Fe2+, Cu2+, их предварительно связывают в нерастворимые фосфаты.
Реакция имеет низкий предел обнаружения – 0,16 мкг.
Опыт. А). В пробирку поместить 2–3 капли раствора NiSO4, добавить равные объемы 2М раствора NH4OH и реактива Чугаева. Полученный осадок разделить на две части и исследовать его растворимость в 2М растворе HCl и концентрированном растворе NH4OH.
Б). При наличии мешающих ионов реакцию удобнее выполнять капельным методом. Для этого на фильтрованную бумагу нанести каплю раствора Na2HPO4, каплю NiSO4, а затем еще каплю Na2HPO4. Влажное пятно обработать диметилглиоксимом и парами аммиака.
46
Реакции катиона кадмия Сd2+
1. Тетраиодовисмутат (III) калия KBiJ4 при взаимодействии с соля-
ми катиона Cd2+ образует черный осадок иодида висмута BiJ3, растворимый в избытке раствора KJ:
CdCl2 + 2K[BiJ4] = 2BiJ3 (Т) + CdJ2 + 2KCl .
Опыт. Каплю раствора соли кадмия нанести на фильтрованную бумагу, затем в центр капли поместить каплю свежеприготовленного оранжевого раствора K[BiJ4] и наблюдать образование черного пятна.
2. Н2S или Na2S при взаимодействии с солями кадмия в уксуснокислой среде образует желтый осадок CdS, не растворимый в кислотах:
CdCl2 + Н2S = CdS(т) + 2НCl.
Реакции катиона Hg2+
1. Щелочи осаждают из растворов солей ртути (II) желтый осадок
HgO:
Hg2+ + 2OH- = HgO(Т) + H2O.
Опыт. К 2–3 каплям раствора Hg (II) прибавить 1–2 капли 2М раство-
ра NaOH (KOH).
2. Иодид калия KJ образует с ионами Hg2+ оранжево-красный осадок HgJ2, растворимый в избытке реактива с образованием бесцветного проч-
ного комплекса тетраиодомеркурата (II) калия:
Hg2+ + 2J = HgJ2 (Т),
HgJ2 + 2KJ = K2[HgJ4].
Образовавшийся комплекс входит в состав реактива Несслера. Обнаружению мешает катион Cu2+, реагирующий с иодид-ионами с
выделением свободного иода, для восстановления которого добавляют 1-2 капли Na2S2O3.
Опыт. К 1–2 каплям соли Hg (II) прибавить равный объем реактива, а затем избыток его до растворения образовавшегося осадка.
3. Восстановители (SnCl2, Cu) восстанавливают Hg2+ до Hg22+, а затем
Sn2+ + 2HgCl2 = Hg2Cl2 (Т) + Sn4+ + 2Cl-,
белый
Hg2Cl2 + Sn2+ = 2Hg + Su4+ + 2Cl-
черный
Hg2+ + Cu = Hg + Cu2+ .
черный
Опыт. А). К 1–2 каплям соли Hg(II) прибавить 3–4 капли раствора
SnCl2.
47
Б). На медную пластинку поместить каплю соли Hg (II), через несколько минут наблюдать черное пятно металлической ртути, которое при потирании дает блестящий налет альмагамы меди.
Действие некоторых реагентов на катионы VI группы представлено в табл. 2.6.
|
|
|
|
|
|
|
Таблица 2.6 |
|||
|
Реакции катионов VI аналитической группы |
|
|
|||||||
Реактивы |
Cu2+ |
|
Co2+ |
Ni2+ |
|
Cd2+ |
Hg2+ |
|
||
NH4OH |
(СuOH)2SO4 (Т) |
|
|
(NiOH)2SO4 |
|
|
|
|||
без избытка |
СoOHCl (Т) |
Cd(OH)2 (Т) |
[HgNH2]Cl (Т) |
|||||||
голубовато- |
(Т)светло- |
|||||||||
|
синий |
белый |
белый |
|
||||||
|
зеленый. |
зеленый |
|
|||||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||
NH4OH из- |
[Cu(NH3)4] |
2+ |
[Co(NH3)6]2+ (Т) |
[Ni(NH3)6] |
2+ |
2+ |
[Hg(NH3)4] |
2+ |
||
быток |
(Т) |
буро- |
(Т) |
[Cd(NH3)4] (Т) |
(Т) |
|||||
|
ярко-синий |
синий |
|
бесцветный |
бесцветный |
|||||
|
желтый |
|
||||||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
NaOH, KOH |
Cu(OH)2 (Т) |
Co(OH)2 (Т) |
Ni(OH)2 (Т) |
Cd(OH)2 (Т) |
HgO (Т) |
|||||
|
||||||||||
|
голубой |
розовый |
светло-зеленый |
белый |
желтый |
|||||
|
|
|
|
|
|
|
|
|
|
|
K4[Fe(CN)6] |
Cu2[Fe(CN)6] (Т) |
Зеленый |
Бледно- |
|
|
|
||||
|
|
|
|
|||||||
|
осадок пе- |
зеленый осадок |
Cd2[Fe(CN)6] (Т) |
Hg2[Fe(CN)6] (Т) |
||||||
|
красно- |
|||||||||
|
ременного |
переменного |
белый |
желтый |
||||||
|
бурый |
|
||||||||
|
|
состава |
состава |
|
|
|
||||
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
Реактив Чу- |
Растворимое |
|
|
|
|
|
|
|
||
гаева |
|
|
Ni(C4H7N2O2)2 (Т) |
|
|
|
||||
соединение |
- |
|
- |
- |
|
|||||
|
|
ало-красный |
|
|||||||
|
бурого цвета |
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
Окислители |
- |
|
Со |
3+ |
- |
|
- |
- |
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
Восстанови- |
Cu+, Cu0 |
- |
|
- |
|
- |
Hg22+, Hg0 |
|||
тели |
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Какое свойство катионов VI группы позволяет выделить их в отдельную аналитическую группу?
2.В какой цвет окрашены аммиакаты катионов VI группы?
3.Что произойдет при подкислении амминокомплекса Cu (II)? Как при этом изменится окраска раствора?
4.Каковы условия образования комплекса [Co(NCS)4]2-?
5.Каков характер взаимодействия солей ртути (II) с иодидом калия?
6.При действии концентрированного раствора аммиака на смесь катионов VI группы получили бесцветный раствор. О присутствии или отсутствии каких катионов это свидетельствует?
