
Полезные материалы за все 6 курсов / Учебники, методички, pdf / Диспансерное_наблюдение_детей_с_аллергическими_и_иммунными_заболеваниями
.pdf
■исследование ОАК с целью выявления возможного повышения уровня эозинофилов или выявления маркеров бактериального воспаления для диф. диагностики
■цитологическое исследование смывов с ВДП путей с целью выявления эозинофилии носового секрета при первичной диагностике АР, а в дальнейшем - при дифференциальной диагностике с другим хроническим ринитом и контроля эффективности терапии
> Инструментальная диагностика:
■передняя риноскопия с целью выявления характерных признаков АР, анатомических особенностей и диф. диагностики
■эндоскопическая эндоназальная ревизия полости носа, носоглотки и околоносовых пазух с целью выявления анатомических нарушений полости носа и околоносовых пазух пациентам с АР при
неэффективности стандартной терапии или при осложненных формах АР
■рентгенография придаточных пазух носа с целью исключения гнойного осложнения и определения тактики терапии при наличии маркеров бактериального воспаления
■КТ придаточных пазух носа, гортани с целью диф. диагностики и выявления др. причин назальной обструкции пациентам с выраженной и продолжительной назальной обструкцией
■исследования ФВД при наличии жалоб на кашель, приступов затруднения дыхания, одышку. Классификация аллергического ринита В зависимости от этиологического фактора:
• сезонный (САР),
• круглогодичный / бытовой (КАР),
• профессиональный АР.
По характеру и длительности течения:
• интермиттирующий АР - менее 4 дней в нед. или менее 4 нед. в году;
• персистирующий АР - более 4 дней в неделю и более 4 нед. в году. По степени тяжести:
• легкая степень - слабовыраженные симптомы АР, не нарушающие активность и сон;
• средняя степень - симптомы АР препятствуют работе, учебе, занятиям спортом, нарушают сон
пациента;
•тяжелая степень - симптомы значительно ухудшают качество жизни пациента, который в отсутствие терапии не может нормально работать, учиться, заниматься спортом; нарушается ночной сон.
По стадии заболевания:
•обострение,
•ремиссия.
По уровню контроля:
•контролируемый,
•неконтролируемый. Клинические рекомендации по АР ARIA - 2020
Allergic Rhinitis and its Impact on Asthma - Аллергический ринит и его влияние на астму
(международные клинические рекомендации)
Разработчик клинической рекомендации: Российская ассоциация аллергологов и клинических иммунологов Национальная медицинская ассоциация оториноларингологов Союз педиатров России Цель терапии АР - достижение контроля симптомов
|
Критерии контроля аллергического ринита |
Критерии контроля |
Контролируемый |
ринита |
|
Симптомы |
Нет симптомов (заложенность, ринорея, чихание, зуд, назальный затек) |
Качество жизни |
Нет нарушений сна |
|
Нет нарушений дневной активности (учеба, работа, занятия в свободное |
|
время) |
Объективные |
Нормальная назальная пиковая скорость выдоха Нормальный тест |
измерения |
«дыхание с закрытым ртом» |
|
Если доступны объективные тесты для оценки нормальной назальной |
|
проходимости |
•Критерии оцениваются за последние 4 недели до консультации
•Следует учитывать наличие сопутствующих заболеваний (астма, синусит и т.д.)
•Повышение потребности в препаратах скорой помощи указывает на утрату контроля
•Любое отклонение от этих критериев указывает на потерю контроля, и терапия step-up может быть рассмотрена
•Решение о терапии step-down следует принимать, учитывая клинически предшествующей
терапии Уменьшение объема терапии
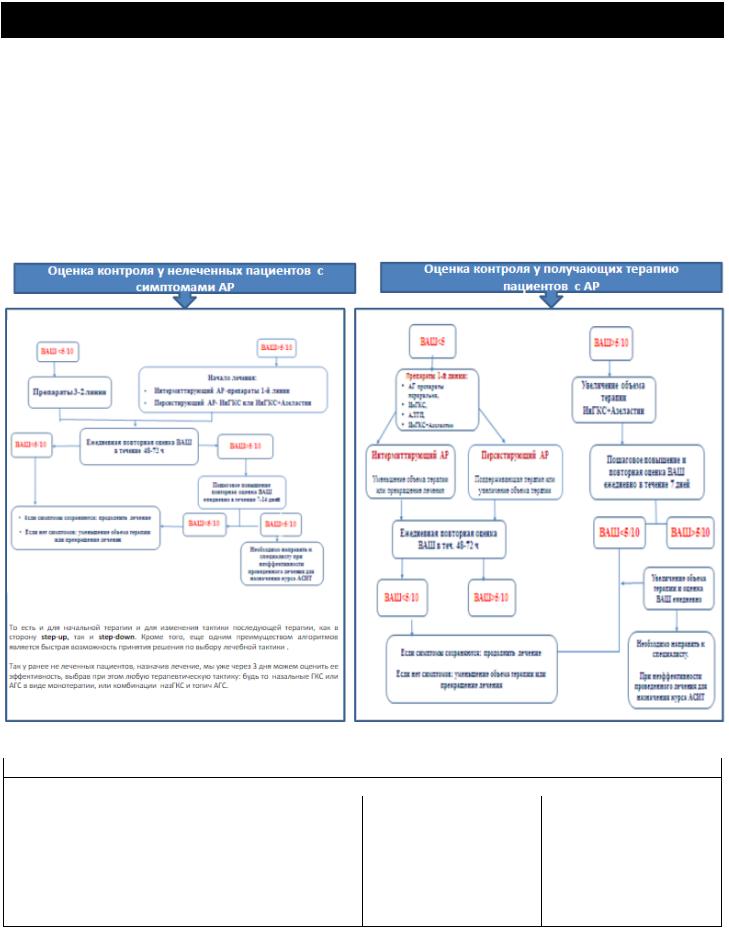
Увеличение объема терапии ВАШ - оценка эффективности лечения АР - Удобный инструмент для мониторинга контроля
симптомов АР Визуальная аналоговая шкала (ВАШ) - оценка симптомов АР в баллах
ВАШ отвечает на вопрос «в целом насколько симптомы АР беспокоят Вас сегодня?»:
от «совсем не беспокоят» до «выражено беспокоят» Валидизация результатов оценки ВАШ:
Не контролируемый АР - ВАШ >= 5 см Частично-контролируемый АР - ВАШ >2 или < 5 Хорошо-контролируемый АР - ВАШ < 2 см
Алгоритм выбора фармакотерапии в зависимости от уровня контроля симптомов АР по ВАШ у подростков и взрослых (ARIA - 2020)
Ступенчатый подход к терапии АР |
|
|
|
|
Контроль окружающей среды |
|
|
|
Контролирующая фармакотерапия |
|
|
1-я ступень |
2-я ступень |
3-я ступень |
4-я ступень |
|
|
|
(проводится только |
|
|
|
специалистами) |
Один из: |
Один из: |
Комбинация назальных |
Рассмотреть |
- пероральные АГП |
- назальные ГКС |
ГКС с одним из: |
применение |
-назальные АГП |
- пероральные АГП |
-назальные АГП |
смализумаба у больных |
|
-назальные АГП |
- пероральные АГП |
с тяжелым АР и |
- назальные |
-антагонисты рец |
-антагонисты рец |
сопутствующей БА (не |
кромоны/недокромил |
лейкотриенов |
лейкотриенов |
одобрен при АР без |
-антагонисты рец |
|
|
БА). Рассмотреть хир |
лейкотриенов |
|
|
лечение сопут |
|
|
|
патологии |
 Симптоматическая терапия - деконгенсанты (пероральные/назальные) ГКС пер ос - антихолинергетики (назальные)
Симптоматическая терапия - деконгенсанты (пероральные/назальные) ГКС пер ос - антихолинергетики (назальные)
Перепроверьте диагноз т/или приверженность и оцените наличие сопутствующих заболеваний и/или анатомических аномалий перед переходом на следующую ступень терапии  АР-аллергич ринит, АГП-антигистамин препараты
АР-аллергич ринит, АГП-антигистамин препараты
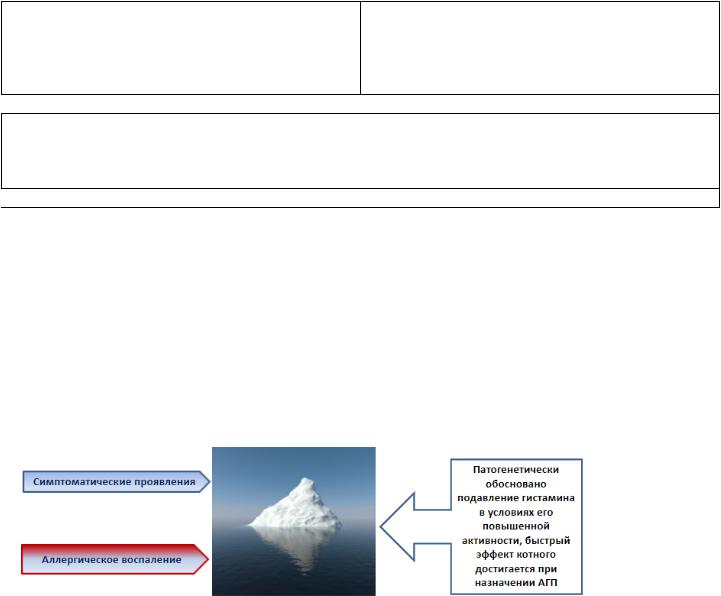
АГ 2 поколения Блокирует раннюю фазу аллергической реакции
Острые проявления аллергии:
•Зуд
•Ринорея
•Чихание
•Отечность (назальная) -
Блокирует позднюю фазу аллергической реакции Хроническое аллергическое воспаление:
•Хроническая заложенность носа
•Гиперреактивность бронхов
•Зуд и шелушение кожи
Врачу необходимо правильно выбрать препарат для лечения пациентов При выборе антигистаминного препарата необходимо учитывать: быстроту наступления эффекта, продолжительность действия,
частоту приема препарата (в итоге приверженность пациента лечение), выраженность тахифилаксии, безопасность препарата.
Диспансерное наблюдение детей с иммунными заболеваниями Виды ИДС
>Первичные ИДС (ПИД) - генетически детерминированные врожденные дефекты иммунитета
>Вторичные (транзиторные функциональные) нарушения иммунной системы
S ??? Часто и длительно болеющие дети (ВтИДС)
S Дети с переиетирующими инфекциями (активность ПГВИ) S Дети с рецидивирующими респираторными инфекциями
S Дети с хроническими заболеваниями органов дыхания ^ Дети с аллергическими заболеваниями (! АР, БА)
АЛГОРИТМ ДИАГНОСТИКИ ПЕРВИЧНЫХ ИММУНОДЕФИЦИТОВ для врача-педиатра первичного звена
Оценка анамнестических данных (какие клинические симптомы изменения е анализах были у ребенка ранее, семейный анамнез). Осмотр Предварительный диагноз
Далее совместно с врачом аллергологом-иммунологом:
>Иммунологическое обследование.
>Верификация диагноза.
>Молекулярно-генетическое обследование.
>Заключительный диагноз.
Оценка иммунологического анамнеза включает анализ 4 основных синдромов:
SАутоиммунный
SЛимфопролиферативный
SАллергический
^ Инфекционный: необходимость оценки не только частоту, но и длительность и тяжесть течения эпизодов ОРИ, развитие хронических форм респираторных инфекций
Клинические проявления иммуносупрессии:
♦не менее 12 эпизодов рецидивирующих респираторных инфекций;
♦> рецидивирующи еинфекции кожи и ПЖК (фурункулёз, абсцесс);
♦> 3-4 эпизодов острого среднего отита в течение года;
♦> 2 эпизода тяжелых инфекции пазух в течение года;
♦> 1-2 эпизода острой пневмонии в течение года;
•часто рецидивирующие, стойкие грибковые поражения кожи и слизистых оболочек ротовой полости и наружных половых органов:
•>2 эпизодов ОКИ в течение года;
•необходимость проведения нескольких курсов лечения антибактериальными препаратами часто с недостаточным эффектом пли требующих их замены;
•необходимость парентерального введения антибиотиков. Первичные иммунодефициты (ПИД)
Первичные иммунодефициты (ПНД) — заболевания, которые развиваются в результате генетически обусловленного блока молекулярных или клеточных компонентов адаптивного или врожденного иммунитета. Реализация генетического дефекта обусловливает широкий спектр клинических проявлений (инфекции, предрасположенность к аутоиммунным и онкологическим заболеваниям, а также аллергические реакции).
Изучение первичных иммунодефицитов началось в 50-х годах XX в., когда применение антибиотиков и иммуноглобулинов обеспечило выживание детей с пороками развития иммунитета, страдающих тяжелыми, нередко не совместимыми с жизнью инфекциями.
Внастоящее время известно около 250 клинических форм генетически опосредованной иммунной недостаточности, примерно в 170 из них открыты генные дефекты.
Вбольшинстве стран Европы уже существуют национальные регистры больных ПНД, в России над ним работают с 19S9 г. Общеевропейский регистр больных ППД создан в 1994 г. (штаб-квартира в Швеции). В российском регистре к 2009 г. зарегистрировано 604 пациента. Регистры больных во всех странах постоянно пополняются. Наиболее часто встречается селективный дефицит IgA (1:300-700), другие формы ППД встречаются реже: общая вариабельная иммунная недостаточность (ОВИН) — 1:7000-200 000. Х-сцепленная агаммаглобулннемия — 1:50 000-1 000 000).
Классификация первичных иммунодефицитов Согласно современной классификации, принятой в 2017 г., генетически опосредованные
иммунодефициты разделены на 9 групп:
♦ группа 1 — дефекты клеточного и гуморального звена ♦ группа 2 — комбинированные ПНД. ассоциированные с синдромальными проявлениями ♦ группа 3 — гуморальные дефекты ♦ группа 4 —нарушения иммунной регуляции
♦ группа 5 — врожденные дефекты фагоцитов ♦ группа б — дефекты врожденного иммунитета и сигнальных компонентов ♦ группа 7 — аутовоспалительные синдромы ♦ группа 8 — дефициты системы комплемента:
♦ группа 9 — фенокопии ПИД Диагностика первичных иммунодефицитов
Признаки, настораживающие в отношении ПИД
Согласно международным рекомендациям, следует помнить настораживающие и при этом диагностически значимые признаки распознавания ПИД (по сути, это признаки иммунной недостаточности; табл. 2.1):
•частые отиты (4 раза в год и чаше);
•синусит (более 2 раз в год);
•пневмония (2 раза в год и чаще);
•абсцессы кожи и внутренних органов, особенно повторные и так называемые холодные абсцессы без классических признаков воспаления (негорячие на ощупь, без покраснения и т. д.);
•отсутствие или минимальный эффект от длительной пероральной антибактериальной терапии, необходимость назначен™ внутривенных форм для купирования инфекции;
•не менее двух перенесенных инфекций, таких как менингит, остеомиелит, сепсис;
•отставание ребенка в росте и массе в сравнении с возрастной нормой;
•рецидивирующие длительные эпизоды диареи;
•персистирующая молочница шли грибковые поражения кожи в возрасте старше 1 года;
•указание на наличие в семье больных ПНД. ранние смерти детей от тяжелых инфекций. ОБЩАЯ КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА ПЕРВИЧНЫХ ИММУНОДЕФИЦИТОВ С
ПРЕИМУЩЕСТВЕННЫМ ПОРАЖЕНИЕМ Т ЛИМФОЦИТОВ Появление симптомов в грудном возрасте (4-5 месяцев).
Повторные инфекционные заболевания, вызываемые вирусами, грибами, микобактериями. Инфекционные заболевания, вызываемые оппортунистическими микроорганизмами (например.
Pneumocystis jirovecii).
Фатальные инфекционные заболевания, развившиеся в результате вакцинации живыми вирусными вакцинами, в т. ч. введения БЦЖ.
Болезнь «трансплантат против хозяина» в результате трансфузии продуктов крови, содержащих лимфоциты, или внутриутробного попадания лимфоцитов матери.
Увеличение риска машинизации.
ОБЩАЯ КЛИНИЧЕСКАЯ ХАРАКТЕРИСТИКА ПЕРВИЧНЫХ ИММУНОДЕФИЦИТОВ С ПРЕИМУЩЕСТВЕННЫМ ПОРАЖЕНИЕМ В ЛИМФОЦИТОВ
•Появление симптомов в возрасте 7-9 месяцев после исчезновения материнских антител.
•Повторные инфекционные заболевания, вызванные инкапсулированными бактериями.
•Хронические очаги инфекции (синуситы, отиты, пневмонии, бронхоэктазы). гнойные лимфадениты, абсцессы.
•Менингиты, септицемия, остеомиелиты, возникшие в результате гематогенного распространения патогена.
•Редкая заболеваемость грибковыми п вирусными инфекциями (за исключением энтеровпрусов).
•Выживаемость до зрелого возраста при проведении адекватного лечения.
•Гипоплазия периферических лимфатических узлов и назофарингеальной лимфоидной ткани (характерно для Х-сцепленной агаммаглобулинемип Брутона).
•Лимфоидная гиперплазия (гепатоспленомегалия при ОВИН).
•Повышенная частота аллергических и аутоиммунных заболеваний.
ОБЩИЕ ПРИНЦИПЫ ЛЕЧЕНИЯ БОЛЬНЬЕХ С ПЕРВИЧНЫМИ ИММУНОДЕФИЦИТАМИ Неотъемлемой частью терапии должно быть ее раннее начало.
•Лечение и профилактика бактериальных, грибковых, мнкобактерпальных инфекций.
•Заместительная терапия (препараты иммуноглобулинов, ферментов).
•Трансплантация костного мозга и стволовых клеток.
•Генотерапия.
Тяжелый комбинированный иммунодефицит
У пациентов с тяжелой комбинированной иммунной недостаточностью (TKIIH). как правило, обращает внимание задержка физического развития, среди наиболее частых заболеваний — пневмоцнстная пневмония. диарея, распространенный микоз слизистых оболочек на 2-7-м месяцах жизни, тяжелые бактериальные инфекции и диссеминированная БЦЖ-инфекция. Дети с TKIIH умирают в течение первых 2 лет, если не попадают в условия строгого стерильного режима, в котором проводится адекватная терапия, и не подвергаются трансплантации гемопоэтических стволовых клеток или терапии, замещающей дефектный ген или его продукт.
Х-сцепленная агаммаглобулинемия с дефицитом В клеток (болезнь Брутона)
Наследственная гипогаммаглобулинемпя. при которой Х-сцепленньтй вариант встречается в S5% случаев. В основе заболевания лежит нарушение процессов днфференцировкп и созревания В лимфоцитов.
Впервые заболевание описано в 1952 г. О. Брутоном. Встречается с частотой 1-5 на 1 000 000 новорожденных. Х-сцепленную форму заболевания вызывает мутация гена Btk на Х-хромосоме, кодирующего специфичную для В лимфоцитов протеинкиназу (названную в честь Брутона брутоновской тирозинкиназой Btk). Ген Btk экспрессируется во всех гемопоэтических клетках за исключением плазматических п Т лимфоцитов. В результате мутации задерживается созревание В клеток на уровне пре-В лимфоцитов. Выраженность иммунодефицита может варьировать от полного отсутствия иммуноглобулинов в крови до их сниженной концентрации п уменьшения количества зрелых В лимфоцитов.
Влечении больных с гипо- и агаммаглобулинемней применяют пожизненную заместительную терапию иммуноглобулинами. Для лечения острых бактериальных инфекций используют антибиотики широкого спектра действия.
Общая вариабельная иммунная недостаточность (ОВИН)
По данным современных исследований, гены, ответственные за ОВИН, располагаются на 6-й хромосоме. Мутации затрагивают гены, кодирующие белки, вовлеченные в В лимфопоэз и гомеостаз В клеток.
• начало болезни в возрасте старше 2 лет;
• отсутствие изогемагглютининов и или плохой ответ на вакцинацию;
• исключение других хорошо известных причин агаммаглобулинемии.
У большинства пациентов с ОВИН иммунодефицит распознается в течение второго, третьего или четвертого десятилетия жизни, после того как уже развились тяжелые инфекции (например, пневмония). Кроме бактериальных инфекций, при ОВИН нередко развиваются вирусные, грибковые и паразитарные. Уровень сывороточного IgM сохраняется в пределах нормы в среднем у половины пациентов. Нарушения Т-клеточного иммунитета отмечаются у всех больных. Примерно у 50% больных имеются аутоиммунные проявления. Повышен риск развития онкологических болезней.
Атаксия-телеангиэктазия (синдром Луи-Бар)
В1995 г. был картирован ген, расположенный на длинном плече хромосомы 11. Продукт этого гена
—белок АТМ, ответственный за контроль клеточного роста, распознавание клеткой поврежденной ДНК и ее репарацию или блокирование клеточного цикла в таких клетках. Заболевание выявляют с одинаковой частотой у мальчиков и девочек (1:500 000-1 000 000).
Диагноз достоверен у пациентов женского или мужского пола с повышенным уровнем хромосомных аберраций и ломкости хромосом при цитогенетическом исследовании, прогрессирующей мозжечковой атаксией, имеющих серьезные мутации в обеих аллелях ATM, а также задержку роста, отсутствие сывороточных IgA, IgM, в возрасте от 2 до 6 лет — телеангиэктазии на конъюнктиве, открытых участках тела, слизистых оболочках.
Клинические проявления. Атаксия-телеангиэктазия — прогрессирующее неврологическое заболевание. У большинства пациентов изменения походки начинаются к концу первого года жизни и к подростковому возрасту вызывают стойкую инвалидизацию (невозможность самостоятельно ходить). Глазные или лицевые телеангиэктазии обычно формируются к 3-6 годам жизни. У многих больных развиваются повторные инфекции респираторного тракта. Лейкозы и лимфомы наблюдаются у 10-15% пациентов. У большинства больных увеличено количество циркулирующих Т клеток с преобладанием незрелых Т лимфоцитов.
Для лечения атаксии-телеангиэктазии применяют заместительную терапию иммуноглобулинам, гормонами тимуса, также используют антибиотики широкого спектра действия, противогрибковые препараты.
Синдром Ди Джорджи ППД с аутосомно-доминантным типом наследования, клинически характеризующийся гипоили
аплазией тимуса, множественными дефектами артериального ствола, гипопаратиреозом. Причина синдрома — гомозиготная деления хромосомы 22ql 1.2, выявляемая приблизительно у 90% больных с синдромом Ди Джорджи. В результате мутации стволовые клетки не дифференцируются в Т лимфоциты. Это изолированный Т-клеточный иммунодефицит. Способность к синтезу антител у больных сохранена, но на более низком уровне.
У пациентов обнаруживают дефекты артериального ствола (общий артериальный ствол, тетрада Фалло, стеноз душ аорты (аплазия)), порок сердца, гипокальциемию, лицевой дисморфизм или дефекты твердого нёба.
Пациенты нуждаются в назначении противомикробной и противовирусной терапии, особенно при повышенной склонности к инфекциям. Без терапии продолжительность жизни короткая. Трансплантация костного мозга (ТКМ) не эффективна, т.к. при синдроме Ди Джорджи нарушено созревание Т клеток из-за отсутствия эпителия тимуса. Оправданным является трансплантация эпителиальной ткани тимуса. После пересадки эпителиальной ткани тимуса отмечено восстановление количества и функциональной активности Т клеток.
Синдром Вискотта-Олдрича Диагноз достоверен у пациентов мужского пола с врожденной тромбоцитопенией (количество
тромбоцитов меньше 70x109/л). уменьшенным диаметром тромбоцитов.
Клинические проявления. Врожденная тромбоцитопення с уменьшенным размером тромбоцитов является главным диагностическим признаком. У многих пациентов болезнь дебютирует диареей с кишечным кровотечением на первом месяце жизни. Экзема, развивающаяся у многих, но не у всех больных, может быть преобладающим клиническим признаком. Характерны отиты, синуситы, тяжелые инфекции, вызванные Herpes simplex и ЭБВ. У многих пациентов повышены концентрации сывороточных IgE и IgA и снижена концентрация IgM. Количество и функциональная активность Т лимфоцитов с возрастом снижаются. При синдроме Вискотта-Олдрича повышена частота развития аутоиммунных заболеваний (васкулит, гемолитическая анемия, нефротический синдром) и опухолей (лейкоз, лимфома. ЭБВассоциированная опухоль головного мозга). Очень редко пациенты с синдромом ВискоттаОлдрича имеют умеренную тромбоцитопенню (50 000-100 000 тромбоцитов в микролитре) без каких-либо других проявлений.
Единственным методом излечения больных с синдромом Вискотта-Олдрича является ТКМ или гемопоэтических стволовых клеток, но обязательно от HLA идентичного донора. Спленэктомия значительно снижает геморрагический синдром. Кроме этого, необходима постоянная противопневмококковая терапия (антибиотиков пенициллинового ряда, заместительная терапия в в иммуноглобулинами, постоянно сульфаметоксазол / триметоприм. ацикловир, флуконазол). Используются кортикостероиды, азатиоприн. циклоспорин А. Необходима терапия экземы. Противопоказаны в м инъекции из-за опасности развития гематом. Вакцинация возможна только инактивированными вакцинами и анатоксинами.
ДИАГНОСТИКА ВТОРИЧНЫХ ИММУНОДЕФИЦИТНЫХ состояний Иммунологический анамнез отличается от других видов анамнеза своими целями и задачами. Целью
такого анамнеза является попытка установить наличие нарушений функционирования иммунной системы у конкретного больного, выявить врожденный либо приобретенный характер этих нарушений, а также дать ориентировочную оценку нарушений в отдельных звеньях иммунной системы.
Основные признаки вторичных иммунодефицитов
♦Отсутствие генетического дефекта развития иммунной системы.
♦Возникновение иммунодефицита на фоне ранее нормально функционировавшей иммунной системы.
♦Устойчивое сохранение возникших нарушений иммунитета после устранения причины.
♦Наличие нескольких клинических проявлений иммунодефицита у больного в виде очагов хронической инфекции в разных органах и системах.
♦В иммунограмме изменения показателей адаптивного и врожденного иммунитета носят непостоянный характер, одновременно отмечаются в разных звеньях иммунной системы.
♦Возможность достижения клинико-иммунологического эффекта при проведении адекватной терапии или спонтанное выздоровление.
«Болезни-маски» нарушений гуморального иммунитета включают: генерализованные бактериальные инфекции (сепсис, менингиты и т. п.);
рецидивирующие и хронические бактериальные заболевания ЛОР-органов (синуситы, отиты); повторные бактериальные поражения органов дыхания (пневмонии, плевриты, бронхоэктатическая болезнь); хронические бактериальные инфекции кожи и подкожной клетчатки (фурункулы, абсцессы,
пиодермии, флегмоны, парапроктиты и др.); другие хронические бактериальные очаги поражения органов и систем (мочевыделительная, ЖКТ
идр.).
«Болезни-маски» преимущественно Т-клеточных иммунодефицитов:
грибковые заболевания кожи, слизистых оболочек, в т. ч. системные формы (кандидозы. аспергиллез и др.); паразитарные инвазии;
хронические вирусные инфекции (герпетическая, цитомегаловирусная. ЭБВ и др.); туберкулез; «Болезни-маски» нарушений врожденного иммунитета (например, дефекты фагоцитоза): фурункулы, карбункулы, абсцессы; повторные ангины, фарингиты, тонзиллиты; другие хронические локализованные очаги поражения (хронический пиелонефрит, аднексит,
гайморит, отит и др.).
