
Lyubimenko_V.A._Raschet_ravnovesnogo_sostava_idealnoy_gazovoy_reakcionnoy_smesi
.pdf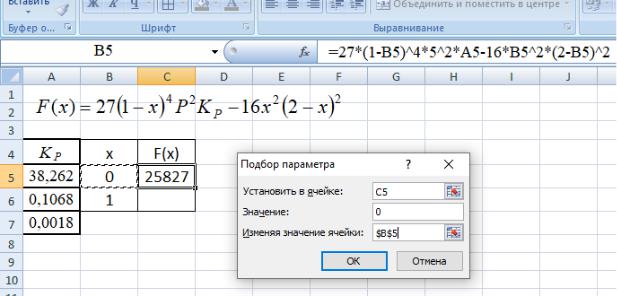
В ячейки B5 и B6 введены минимальное и максимальное значения x, в
ячейку C5 введено выражение функции F(x), в которое подставлены значение заданного давления (P=5 атм) и значение KP=36,262 (ячейка A5). В качестве x
используем его первоначальное значение в ячейке B5. Значение F(x) при x=0
появляется в ячейке C5, оно, как видно, значительно отличается от нуля.
Теперь переходим к поиску значения x, при котором F(x)=0. Нажав кнопку
Анализ “что-если” и выбрав пункт меню Подбор параметра в появившемся окне вводим необходимые данные (рисунок 5) и нажимаем OK, результат поиска значения x, при котором F(x)=0, появляется в ячейке B5, а значение F(x) близкое к 0, в ячейке C5 (рисунок 6).
Рисунок 6 – Заполнение окна Подбор параметра для поиска решения уравнения
(6.4)
21

Рисунок 7 – Результат поиска решения уравнения (4.4): x=0,844, F(x)=3·10-5 (точнее 2,5·10-5)
Если в качестве исходного значения x вводить его значение в ячейке B6, то результат будет такой же.
С помощью функции Подбор параметра находим значения x при других температурах, и рассчитываем состав равновесной реакционной смеси для всех выбранных температур (таблица 10).
Таблица 10 - Состав равновесной реакционной смеси N2+3H2 2NH3
T, K |
x |
|
Содержание, мольн. доли |
|
||
|
|
|
|
|
||
N2 |
|
H2 |
|
NH3 |
||
|
|
|
|
|||
400 |
0,844 |
0,0675 |
|
0,2024 |
|
0,7301 |
500 |
0,434 |
0,1807 |
|
0,5421 |
|
0,2771 |
600 |
0,115 |
0,2347 |
|
0,7042 |
|
0,0610 |
По данным таблицы 10 строим диаграмму зависимости состава равновесной реакционной смеси от температуры, на которой при каждой температуре суммарное содержание всех реагентов в мольных долях равно 1, а
содержание каждого реагента в отдельности равно величине соответствующего отрезка (рисунок 8).
22

Состав, мольные доли
1 |
|
|
0,9 |
NH3 |
|
0,8 |
|
|
0,7 |
|
|
0,6 |
H2 |
|
0,5 |
||
|
0,4
0,3
0,2
0,1 |
|
|
N2 |
|
|
|
|
|
|
0 |
|
|
|
|
400 |
450 |
500 |
550 |
600 |
T, K
Рисунок 8 – Зависимость состава равновесной смеси для реакции синтеза аммиака при P=5 атм от температуры
Из данных таблицы 10 и рисунка 8 следует, что выход аммиака с ростом температуры от 400 до 600 K уменьшается от 73 % мольн. до 6,1 % мольн.
Реакция протекает с уменьшением числа молей веществ, поэтому при постоянной температуре выход аммиака должен увеличиваться с ростом давления реакционной смеси.
ВАРИАНТЫ ДОМАШНЕГО ЗАДАНИЯ 2
Часть 1
1.Рассчитайте тепловой эффект реакции (таблица 1), протекающей в газовой фазе при T=298 К.
2.Выведите уравнение зависимости ∆ С° и теплового эффекта реакции от температуры.
3. |
Рассчитайте значения ∆ |
|
С° |
и ∆ |
° |
в интервале 300 -1000 К с шагом 100 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
градусов и постройте графики этих зависимостей. Необходимые данные для |
|||||||||
|
расчета возьмите в справочнике. |
|
|
|
|
|
||||
4. |
Проанализируйте полученные зависимости ∆ |
|
С° |
и ∆ |
° от температуры. |
|||||
|
|
|
|
|
|
|
|
|
|
|
23
Часть 2
1.Рассчитайте зависимость ∆ ° реакции (таблица 1) от температуры методом Темкина-Шварцмана и методом Гиббса-Гельмгольца. Сравните результаты, полученные этими методами. Сравните результаты расчета со значениями ∆ ° , полученными по литературным величинам ∆ ° и ° для веществ, участвующих в реакции [4].
2.Вычислите состав идеальной газовой смеси для реакции при атмосферном давлении (P=1 атм и при P, указанном преподавателем) в заданном диапазоне температур с шагом 100 или 50 К (по указанию преподавателя).
Используйте зависимость ∆ ° = ( ), полученную методом ТемкинаШварцмана.
3.Постройте графики зависимостей ∆ ° = ( ).
4.Постройте диаграмму зависимости состава равновесной реакционной смеси от температуры при P=const или от давления при T=const (давление и
температура указаны в скобках для каждого варианта). Если зависимости изменения энергии Гиббса от температуры практически совпадают между собой, для расчета состава равновесной смеси используйте результаты, полученные методом Темкина-Шварцмана. (В противном случае используйте те результаты, наиболее близкие к результатам, полученным на основе литературных данных).
!Перед выполнением 4 пункта задания убедитесь в том, что зависимости
∆ ° = ( ), полученные методами Гиббса-Гельмгольца, ТемкинаШварцмана и на основе литературных данных, имеют небольшие расхождения.
При выполнении расчетов используйте данные, приведенные в справочной литературе и сборниках примеров и задач [5-8].
В зависимости от условий проведения реакции, указанных в варианте, выполните следующие расчеты (п. А или п. Б).
А). Рассчитайте зависимость энергии Гиббса для реакции в интервале температур 300-1000 К с шагом 100 К методами Гиббса-Гельмгольца, ТемкинаШварцмана и по литературным данным. Рассчитайте состав равновесной реакционной смеси при указанной в задании температуре и давлениях. Постройте диаграмму зависимости состава равновесной реакционной смеси от давления при Т=const. Сделайте выводы о влиянии температуры и давления на состав равновесной реакционной смеси.
24
Б). Рассчитайте состав равновесной реакционной смеси при указанном в задании давлении и температурах. Постройте диаграмму зависимости состава равновесной реакционной смеси от температуры при P=const. Сделайте выводы о влиянии температуры и давления на состав равновесной реакционной смеси.
Рассчитайте состав равновесной реакционной смеси при указанном в задании давлении и температурах. Постройте диаграмму зависимости состава равновесной реакционной смеси от температуры при P=const. Сделайте выводы о влиянии температуры и давления на состав равновесной реакционной смеси.
Таблица 1 – Химические реакции и условия их протекания для расчета состава равновесной идеальной газовой смеси
№ |
|
Реакция, условия |
|
|
|
|
варианта |
|
|
|
|
|
|
|
|
|
|
|||
1. |
CH4 + СО2 2CO + 2H2 |
(T=900 K; P= 1; 0,5 и 0,1 атм) |
||||
2. |
2 C2H5OH бутадиен-1,3 +2H2O+H2 (T=400 K; P= 1; 0,5 и 0,1 атм) |
|||||
3. |
6H2 +2CO2 C2H5OH + 3H2O |
(Т=500 К и P=1, 5 и 10 атм) |
|
|||
4. |
C2H4 + C2H2 бутадиен-1,3 |
(Т=1000 К и P=1, 5 и 10 атм) |
|
|||
5. |
C2H5OH C2H4 + H2O |
|
(T=400 K; P= 1; 0,5 и 0,1 атм) |
|||
6. |
C6H6 + C2H4 C2H5C6H5 |
(Т=900 К и P=1; 5 и 10 атм) |
|
|||
7. |
i-C3H7OH C3H6 +H2O |
|
(Т=400 К и P=1; 0,5 и 0,1 атм) |
|
||
8. |
н-C6H14 C6H6 +4H2 |
|
(T=600 K; P= 1; 0,5 и 0,1 атм) |
|
||
9. |
н-C7H16 C6H5CH3 +4H2 |
(Т=500 К; P=1; 0,5 и 0,1 атм) |
|
|||
10. |
C2H4 + C3H6 C5H12 |
|
(Т=600 К; P=1; 5 и 10 атм |
|
||
11. |
C2H2 + H2O CH3COH |
|
(T=1000 K; P= 1; 5 и 15 атм) |
|
||
12. |
н-C8H18 C6H5C2H5 + 4H2 |
(T=500 K; P= 1; 0,5 и 0,1 атм) |
|
|||
13. |
3H2 +CO2 CH3OH + Н2О |
(T=400 К; P=1, 5, 10 атм) |
|
|||
14. |
Циклогексан бутадиен-1,3+C2H4+H2 (Т=800 К, P=1; 0,5 и 0,1 атм) |
|||||
15. |
3CO+2H2O CH3OH+2CO2 |
(T=600 К; P=1; 5; 10 атм) |
|
|||
16. |
CO2+H2 CO +H2O |
|
(P=1 атм, T=800, 900, 1000 K) |
|||
17. |
C6H6 + C3H6 = C6H5C3H7 (н-пропилбензол) (P=1; 5 и 10 атм, T=800 К) |
|
||||
|
Постройте диаграмму зависимости состава равновесной реакционной смеси от |
|
||||
|
давления, сделайте вывод о влиянии P и Т на ее состав. |
|
|
|
||
|
|
|
|
|
||
18. |
C6H5CH3 +CH3OH орто-C6H4(CH3)2+ H2О |
|
|
|
||
|
Рассчитайте состав равновесной смеси в мольных долях при P=1 атм, T=900 K и |
|||||
|
следующих условиях: первоначальная смесь содержит а) по 1 моль исходных |
|
||||
|
веществ и 100 моль Н2О; б) по 1 моль исходных веществ и 500 моль Н2О; в) по 1 |
|||||
|
моль исходных веществ и 1000 моль Н2О. Постройте диаграмму зависимости |
|
||||
|
состава равновесной реакционной смеси от количества (в моль) содержащегося в |
|||||
|
ней первоначально водяного пара. |
|
|
|
|
|
|
|
|
|
|
||
19. |
CO2 + 3H2 CH3OH + Н2О |
(T=400 К; P=1; 5; 10 атм) |
|
|||
20. |
C6H6 + 3Н2 С6Н12 (циклогексан) |
(T=600 К; P=1; 5; 10 атм) |
|
|||
21. |
HCOOCН3 + 2H2 2СН3OH |
|
|
|
|
|
|
Метилформиат: ∆ ° |
= −349,78 кДж/моль ; ° |
= 301,25 |
Дж |
; |
|
|
|
|||||
|
298 |
|
298 |
|
моль∙К |
|
|
|
|
|
|
|
|
|
|
25 |
|
|
|
|
|
a=14,505; b·103=199,567; c·106=-81. |
|
||
|
(P=1 атм;T= 500, 600 и 700 К). |
|
|
|
|
|
|
||
22. |
CO + 3H2 CН4 + H2O |
(T=600 К; P=1; 5 и 10 атм) |
||
23. |
C2H5OH CH3CHО + H2 |
(Т=500 К; P=1; 0,5 и 0,1 атм). |
||
24. |
CH4 + H2О CO + 3H2 |
(T=800 К; P=1; 0,5 и 0,1 атм) |
||
25. |
CH3CHO + C2H4 бутадиен-1,3 + H2O (T=400, 600, 800 K; P=1атм) |
|||
26. |
C6H12 (циклогексан) бутадиен-1,3+С2H6 (T=900 К; P=1; 0,5 и 0,1атм) |
|||
27. |
цис-Бутен-2 2C2H4 |
(T=700 К; P=1; 0,5 и 0,1 атм) |
||
28. |
транс-Бутен-2 2C2H4 |
(T=700 К; P=1; 0,5 и 0,1 атм) |
||
29. |
2-метилпентан C6H6 + 4H2 |
(T=600 К; P=1; 0,5 и 0,1 атм) |
||
30. |
C2H5OH + CH3CHO C4H6 + 2H2O |
(T=600 К; P=1; 0,5 и 0,1 атм) |
||
31. |
C3H6 + 1,5O2 CH3CHO + HCOOH |
(T=500 К; P=1; 5 и 10 атм) |
||
32. |
C6H5CH3 + 2 NO2 C6H5CH3(NO2)2 + H2 (T=500 К; P=1; 5 и 10 атм) |
|||
33. |
C2H5CH(OH)CH3 C2H5COCH3 +H2 |
(T=600 К; P=2; 1; 0,5 атм) |
||
26
Список литературы
1.M. Berthelot. Thermochimie: Donnée et Lois Numériques. – Published by Gauthier-Villars et Fils, Paris, 1897.
2.Thomsen J. Thermochemische Untersuchungen. – Publisher J.A. Barth: Leipzig, 1882-1886. Thermochemistry (Translated by K.A. Burke), - Longmans, Green: London, 1908.
3.Lewis G.N. and Randall M. Thermodynamics and the Free Energy of Chemical Substances. – New York: McGraw-Hill, 1923.
4.Д. Сталл, Э. Вестрам, Г. Зинке. Химическая термодинамика органических соединений. – М.: Мир, 1971. – 806 с.
5.Краткий справочник физико-химических величин/ Под ред. А.А. Равделя и А.М. Пономаревой. – СПб.: «Иван Федоров», 2002. – 240 с.
6.Рид Р., Праусниц Дж., Шервуд Т. Свойства газов и жидкостей. – Л.:
Химия, 1982. - 592 с.
7.Физико-химические свойства индивидуальных углеводородов. Под ред.
проф. В.М. Татевского. – М.: Гостоптехиздат, 1960. – 414 с.
8.Казанская А.С., Скобло В.А. Расчеты химических равновесий. Сборник примеров и задач. Под ред. Г.М. Панченкова. Учеб. пособие для вузов. –
М.: Высш. школа, 1974. – 288 с.
27

УЧЕБНО-МЕТОДИЧЕСКОЕ ПОСОБИЕ
ЛЮБИМЕНКО ВАЛЕНТИНА АЛЕКСАНДРОВНА
РАСЧЕТ РАВНОВЕСНОГО СОСТАВА ИДЕАЛЬНОЙ ГАЗОВОЙ РЕАКЦИОННОЙ СМЕСИ
В авторской редакции
Сведения о программном обеспечении, которое использовано для создания электронного издания:
Microsoft Word - набор, вёрстка текста, генерация PDF https://www.microsoft.com/
Техническая обработка и подготовка материалов выполнены авторами
Подписано к использованию: 20.07.2021; Объём издания: 1,18 Мб; Тираж: 300 экз.; Комплектация издания: 1 CD-ROM;
Запись на физический носитель: Комков А.Н., komkov.a@gubkin.ru. 119991, Город Москва, проспект Ленинский, дом 65, корпус 1, РГУ нефти и газа (НИУ) имени И.М. Губкина, управление наукометрических исследований и поддержки публикационной активности (040)
