
Lyubimenko_V.A._Raschet_ravnovesnogo_sostava_idealnoy_gazovoy_reakcionnoy_smesi
.pdfДля вывода зависимости ∆ С° и теплового эффекта реакции от температуры выпишем из справочника константы эмпирических зависимостей
теплоемкости участников реакции от температуры (таблица 1).
Таблица 1 – Константы эмпирических зависимостей теплоемкостей участников реакции синтеза аммиака от температуры
|
|
|
|
СP, |
|
|
|
|
|
|
|
N2 |
|
|
|
|
|
|
|
|
|
|
|
|
H2 |
|
|
|
|
|
|
|
|
|
|
NH3 |
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
Дж/моль/К |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
a |
|
|
|
|
|
|
|
|
27,88 |
|
|
|
|
|
|
|
|
|
|
|
27,28 |
|
|
|
|
|
|
|
|
|
29,80 |
|
|
|
-50,12 |
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
b |
|
|
|
|
|
|
0,00427 |
|
|
|
|
|
|
|
|
|
0,00326 |
|
|
|
|
|
|
|
0,02548 |
|
|
0,03691 |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
c’ |
|
|
|
|
|
|
|
|
- |
|
|
|
|
|
|
|
|
|
|
|
0,5·105 |
|
|
|
|
|
|
|
|
-1,67·105 |
|
-4,84·105 |
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||||
a 2 a(NH ) |
3 a(H |
|
) |
a(N |
|
|
) |
2 29,80 3 27,28 27,88 -50,12 |
|
|
|
|
(4.1) |
||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
3 |
|
|
2 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
b 2 b(NH ) |
3 b(H |
) |
b(N |
) 2 0,2548 3 0,00326 0,00427 0,03691 |
(4.2) |
||||||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
3 |
|
|
2 |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
c 2 c |
|
|
|
3 c |
|
|
c |
|
|
|
2 1,67 105 |
3 0,5 105 -4,84·105 |
|
|
|
|
(4.3) |
||||||||||||||||||||||||||||||||||||
|
|
|
|
(NH3 ) |
|
|
(H2 ) |
|
|
(N2 ) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
Зависимость ∆ С° реакции от температуры выразится следующим |
|
|
|||||||||||||||||||||||||||||||||||||||||||||||
уравнением: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
∆ |
|
С° |
= a + b + |
′ |
. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(4.4) |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
Подстановка значений констант (4.1)-(4.3) в уравнение (4.4) приводит к |
|||||||||||||||||||||||||||||||||||||||||||||||||
следующей зависимости ∆ С° |
от температуры: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||
∆ С° |
= −50,12 + 0,03691 · − |
4,84·105 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(4.5) |
||||||||||||||||||||||||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
|
|
Зависимость теплового эффекта реакции от температуры выражается |
|||||||||||||||||||||||||||||||||||||||||||||||||
уравнением Кирхгофа: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1 |
|
|
|
|
|
2 |
|
|
|
|
2 |
|
|
1 |
|
|
|
|
3 |
|
|
3 |
|
|
1 |
|
|
1 |
|
||||
r HT |
r H298 a(T 298) |
|
|
b T |
|
298 |
|
|
|
|
c T |
|
298 |
|
c |
|
|
|
|
(4.6) |
|||||||||||||||||||||||||||||||||
2 |
|
|
3 |
|
|
|
|
298 |
|||||||||||||||||||||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
T |
|
|
|
|||||||
Уравнение (4.6) преобразуем к виду: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||
|
|
H |
|
|
H |
aT |
1 |
bT 2 |
|
1 |
cT 3 c |
1 |
|
, |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(4.7) |
|||||||||||||||||||||||
r |
r |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||
|
|
T |
|
|
|
0 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
где |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
H |
|
|
|
H |
|
|
a 298 |
1 |
b 2982 |
|
1 |
c 2983 |
|
c |
. |
|
|
|
|
|
|
|
(4.8) |
||||||||||||||||||||||||||||
r |
r |
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||||||||||||||||||||||||
|
|
0 |
|
298 |
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
11 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
Для реакции синтеза аммиака:
|
|
H 91880 50,12 298 |
1 |
0,03691 2982 |
4,84 105 |
-80207,3 Дж |
(4.9) |
||||||||||||||||
r |
|
|
|
|
|||||||||||||||||||
|
|
0 |
|
|
|
|
|
2 |
|
|
|
|
|
|
298 |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Подставим полученное значение |
r |
H |
в (4.8), и зависимость теплового эффекта |
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
0 |
|
|
|
|
|
|
|
|
|
||
реакции синтеза аммиака от температуры будет иметь вид: |
|
|
|||||||||||||||||||||
|
|
H |
|
80207,3 50,12 T |
|
1 |
0,03691 T |
2 |
|
|
4,84 105 |
|
|
(4.10) |
|||||||||
r |
T |
2 |
|
|
T |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
Таблица 2 – Зависимость ∆ С° |
и r HT |
реакции синтеза аммиака от |
|
|
|||||||||||||||||||
температуры |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
T, K |
|
|
|
|
∆ С° , Дж/моль/К |
|
r HT , Дж |
|
|
||||||||||
|
|
|
|
298 |
|
|
|
|
|
|
|
-44,571 |
|
|
|
-91880,00 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
300 |
|
|
|
|
|
|
|
-44,425 |
|
|
|
-91969,00 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
400 |
|
|
|
|
|
|
|
-38,381 |
|
|
|
-96092,50 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
500 |
|
|
|
|
|
|
|
-33,601 |
|
|
|
-99685,55 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
600 |
|
|
|
|
|
|
|
-29,318 |
|
|
|
-102828,83 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
700 |
|
|
|
|
|
|
|
-25,271 |
|
|
|
-105556,92 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
800 |
|
|
|
|
|
|
|
-21,348 |
|
|
|
-107887,10 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
900 |
|
|
|
|
|
|
|
-17,499 |
|
|
|
-109828,97 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
1000 |
|
|
|
|
|
|
|
-13,694 |
|
|
|
-111388,30 |
|
|
|||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||
По расчетным значениям ∆ |
|
С° |
и |
∆ |
° в интервале 300-1000 К с шагом 100 |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||
градусов строим графики этих зависимостей, приведенные на рисунках 1 и 2.
CP, Дж/моль/К
-10
200 |
400 |
600 |
800 |
1000 |
-15
-20
-25
-30
-35
-40
-45
T, K
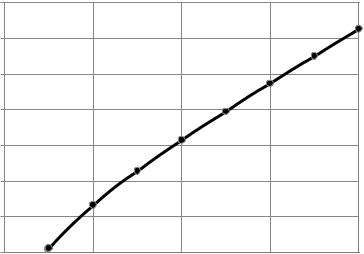
Рисунок 1 – Зависимость ∆ С° реакции синтеза аммиака от температуры
12
T, K
H , Дж r T
-90000
200 |
300 |
400 |
500 |
600 |
700 |
800 |
900 |
1000 |
-95000
-100000
-105000
-110000
-115000
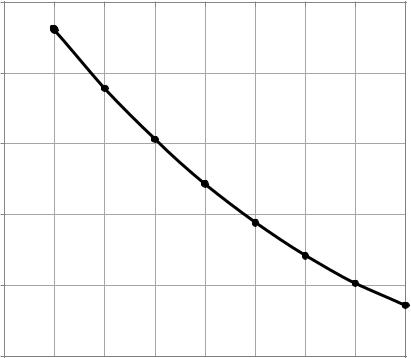
Рисунок 2 – Зависимость ∆ |
° |
реакции синтеза аммиака от температуры. |
|||||
|
|
|
|
|
|
|
|
Опишем характер полученных зависимостей ∆ |
|
С° |
и ∆ |
° |
от температуры: |
||
|
|
|
|
|
|
|
|
∆ С° реакции синтеза аммиака растет с ростом температуры и отрицательно во всем интервале от 298 до 1000 К, а ∆ ° убывает с ростом температуры. Убыль теплового эффекта реакции с ростом температуры объясняется отрицательным значением ∆ С° , так как эти величины связаны между собой уравнением
|
H |
|
|
|
r |
|
r CP . |
|
|
||
|
T |
P |
|
|
|
||
Производная от теплового эффекта реакции тепловой эффект реакции должен убывать с подтверждается выполненными расчетами.
(4.11)
отрицательна, следовательно ростом температуры, что и
13
5. Расчет зависимости r GT реакции синтеза аммиака от температуры
методами Темкина-Шварцмана и по уравнению Гиббса-Гельмгольца.
5.1.Расчет зависимости r GT реакции синтеза аммиака от температуры методом Темкина-Шварцмана
Для расчета |
G методом Темкина-Шварцмана нужно определить |
r |
S . |
||||
|
r |
T |
|
|
|
298 |
|
Выпишем из справочника абсолютные энтропии участников реакции при T=298 |
|||||||
К (таблица 3). |
|
|
|
|
|
|
|
Таблица 3 – Абсолютные энтропии участников реакции |
|
|
|||||
|
Термодинамическая функция |
N2 |
3H2 |
|
|
2NH3 |
|
|
Sº298, Дж/моль/К |
191,5 |
130,52 |
|
192,66 |
||
По закону Гесса, используя данные таблицы 3, рассчитаем изменение
энтропии реакции при T=298 K.
|
r |
S |
|
|
2 192,66 3 130,52 191,5 197,74 Дж/К. |
(5.1) |
||||||||||||||
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
Уравнение Темкина-Шварцмана включает константы, зависящие от |
|||||||||||||||
температуры M0, M1, M2, M-2: |
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
G |
|
H |
T |
S T ( aM |
0 |
bM |
1 |
cM |
2 |
c M |
2 |
) . |
(5.2) |
|||||
r |
|
T |
|
|
r |
298 |
r |
298 |
|
|
|
|
|
|
|
|||||
|
|
|
|
|
Значения |
этих |
констант |
и |
рассчитанные значения |
G в интервале |
||||||||||
r T
температур 300-1000 К с шагом 100 К приведены в таблице 4.
В случае реакции синтеза аммиака, в которой участвуют только неорганические соединения, константа M2 в уравнении (5.2) отсутствует, также как и константа c , равная 0.
Таблица 4 – Изменения энергии Гиббса в интервале температур 300-1000 К для реакции синтеза аммиака, рассчитанные по уравнению Темкина-Шварцмана
T, K |
M0 |
M1·10-3 |
M-2·105 |
r GT , Дж |
r GT , кДж |
1 |
2 |
3 |
4 |
5 |
6 |
300 |
0,0000 |
0,0000 |
0,0000 |
-32558,00 |
-32,558 |
|
|
|
|
|
|
400 |
0,0392 |
0,0130 |
0,0364 |
-12119,53 |
-12,120 |
|
|
|
|
|
|
500 |
0,1133 |
0,0407 |
0,0916 |
9300,06 |
9,300 |
|
|
|
|
|
|
600 |
0,1962 |
0,0759 |
0,1423 |
31396,94 |
31,397 |
|
|
|
|
|
|
|
|
|
14 |
|
|

Продолжение таблицы 4
1 |
2 |
3 |
4 |
5 |
6 |
|
|
|
|
|
|
700 |
0,2794 |
0,1153 |
0,1853 |
53990,07 |
53,990 |
|
|
|
|
|
|
800 |
0,3597 |
0,1574 |
0,2213 |
76944,96 |
76,945 |
|
|
|
|
|
|
900 |
0,4361 |
0,2012 |
0,2621 |
100217,45 |
100,217 |
|
|
|
|
|
|
1000 |
0,5088 |
0,2463 |
0,2783 |
123619,56 |
123,620 |
|
|
|
|
|
|
5.2. Расчет r GT реакции по уравнению Гиббса-Гельмгольца.
|
Уравнение Гиббса-Гельмгольца, используемое для расчета зависимости |
|||||||||||||
G |
от T, |
имеет следующий вид, |
|
если в реакции участвуют органические и |
||||||||||
r T |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
неорганические соединения: |
|
|
|
|
|
|
|
|
||||||
G |
|
|
H aT ln T |
b |
T 2 |
|
c |
T 3 |
|
c |
T 1 IT |
(5.3) |
||
r |
|
|
|
|||||||||||
r T |
|
|
0 |
2 |
|
6 |
|
|
2 |
|
|
|||
|
|
|
|
|
|
|
|
|
|
|||||
|
Для того, чтобы рассчитать |
r |
G |
реакции в интервале температур 300-1000 |
||||||||||
|
|
|
|
|
|
|
|
|
T |
|
|
|
|
|
К, необходимо сначала определить константу интегрирования в уравнении (5.3). Константу I вычислим, подставив в уравнение (5.3) значения
r G298 r H298 298 r S298 и T=298 К:
r G298 r H298 298 r S298 91880 298 ( 197,74)
91880 58926,52 32953,48 Дж
|
|
|
|
298 ln 298 |
b |
298 |
2 |
|
c |
298 |
1 |
|
|
|
|
|
|
|||
|
r G298 |
|
r H 0 a |
2 |
|
2 |
|
|
|
|
|
|
|
|||||||
I |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
0,03691 |
|
|
|
|
4,84 10 |
5 |
298 1 |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
32953,48 |
- 80207,3 50,12 298 ln 298 |
2982 |
|
|
|
|
|
|||||||||||||
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
298 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
32953,48 ( 4056,32) |
32953,48 4056,32 |
|
28897,2 |
96,9703 |
|
|
||||||||||||||
298 |
|
298 |
|
|
|
|
|
298 |
|
|
|
|
|
|
|
|
||||
Уравнение Гиббса-Гельмгольца (5.3) после подстановки в него всех числовых
значений констант принимает вид:
|
G |
-80207,3 50,12 T ln T |
0,03691 |
T 2 |
|
4,84 105 |
T 1 96,9703 T . (5.4) |
|
|
||||||
r |
T |
2 |
|
2 |
|
||
|
|
|
|
||||
15
Таблица 5 – Изменения энергии Гиббса в интервале температур 300-1000 К для реакции синтеза аммиака, рассчитанные по уравнению Гиббса-Гельмгольца (5.4) в сравнении с результатами расчета методом Темкина-Шварцмана
T, K |
Метод Гиббса-Гельмгольца |
Метод Темкина-Шварцмана |
|||
G , Дж |
G , кДж |
G , Дж |
G , кДж |
||
|
|||||
|
r T |
r T |
r T |
r T |
|
300 |
-26051,6 |
-26,052 |
-32558 |
-32,558 |
|
|
|
|
|
|
|
400 |
-4179,14 |
-4,179 |
-12120 |
-12,120 |
|
|
|
|
|
|
|
500 |
18302,1 |
18,302 |
9300 |
9,300 |
|
|
|
|
|
|
|
600 |
41094,7 |
41,095 |
31397 |
31,397 |
|
|
|
|
|
|
|
700 |
64011,4 |
64,011 |
53990 |
53,990 |
|
|
|
|
|
|
|
800 |
86922,8 |
86,923 |
76945 |
76,945 |
|
|
|
|
|
|
|
900 |
109734,0 |
109,734 |
100217 |
100,217 |
|
|
|
|
|
|
|
1000 |
132371,0 |
132,371 |
123620 |
123,620 |
|
|
|
|
|
|
|
5.3. Сравнение полученных результатов расчета с литературными данными
Таблица 6 – Термодинамические параметры участников реакции синтеза аммиака по литературным данным [4]
|
|
|
|
|
|
N2 |
|
|
|
|
H2 |
|
|
|
|
|
NH3 |
|
|
T, K |
|
|
f |
H |
, |
S , |
|
f |
H |
, |
S , |
|
|
f |
H , |
|
S , |
|
|
|
|
T |
|
T |
|
T |
|
T |
|
|
T |
|
T |
|
|||||
|
|
Дж |
|
Дж/моль/К |
Дж |
|
Дж/моль/К |
|
Дж |
|
Дж/моль/К |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
298 |
|
0,000 |
|
191,489 |
0,000 |
|
130,587 |
|
-45,689 |
|
192,590 |
|
|||||||
300 |
|
0,000 |
|
191,665 |
0,000 |
|
130,763 |
|
-45,731 |
|
192,841 |
|
|||||||
400 |
|
0,000 |
|
200,071 |
0,000 |
|
139,118 |
|
-47,823 |
|
203,510 |
|
|||||||
500 |
|
0,000 |
|
206,627 |
0,000 |
|
145,641 |
|
-49,664 |
|
212,505 |
|
|||||||
600 |
|
0,000 |
|
212,066 |
0,000 |
|
150,980 |
|
-51,170 |
|
220,413 |
|
|||||||
700 |
|
0,000 |
|
216,752 |
0,000 |
|
155,507 |
|
-52,426 |
|
227,651 |
|
|||||||
800 |
|
0,000 |
|
221,321 |
0,000 |
|
159,444 |
|
-53,430 |
|
234,262 |
|
|||||||
900 |
|
0,000 |
|
224,647 |
0,000 |
|
162,950 |
|
-54,308 |
|
240,454 |
|
|||||||
1000 |
|
0,000 |
|
228,066 |
0,000 |
|
166,122 |
|
-54,852 |
|
246,354 |
|
|||||||
В |
таблице |
7 представлены |
|
результаты расчета |
|
G реакции синтеза |
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
r |
T |
|
|
|
аммиака методами Темкина-Шварцмана, Гиббса-Гельмгольца и по литературным данным - по стандартным теплотам образования реагентов и стандартным абсолютным энтропиям, в интервале 300-1000 К с шагом 100 К
16
Таблица |
7 – Результаты расчета |
|
G |
реакции синтеза аммиака методами |
||||
|
|
|
r |
T |
|
|
|
|
Темкина-Шварцмана, Гиббса-Гельмгольца и по литературным данным |
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
G |
, кДж |
|
|
T, K |
|
|
|
|
r T |
|
|
|
|
Метод |
|
|
Метод |
|
Литературные |
||
|
|
|
|
|
||||
|
|
Гиббса-Гельмгольца |
Темкина-Шварцмана |
данные [4] |
||||
300 |
|
-26,052 |
|
|
-32,558 |
|
-31,981 |
|
|
|
|
|
|
|
|
|
|
400 |
|
-4,179 |
|
|
-12,120 |
|
-11,484 |
|
|
|
|
|
|
|
|
|
|
500 |
|
18,302 |
|
|
9,300 |
|
9,941 |
|
|
|
|
|
|
|
|
|
|
600 |
|
41,095 |
|
|
31,397 |
|
32,167 |
|
|
|
|
|
|
|
|
|
|
700 |
|
64,011 |
|
|
53,990 |
|
54,728 |
|
|
|
|
|
|
|
|
|
|
800 |
|
86,923 |
|
|
76,945 |
|
78,043 |
|
|
|
|
|
|
|
|
|
|
900 |
|
109,734 |
|
|
100,217 |
|
100,713 |
|
|
|
|
|
|
|
|
|
|
1000 |
|
132,371 |
|
|
123,620 |
|
124,018 |
|
|
|
|
|
|
|
|
||
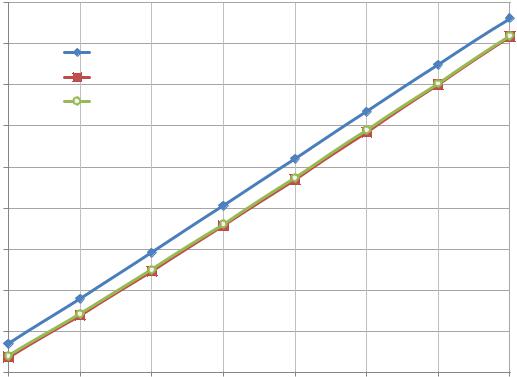
На |
рисунке 3 приведены зависимости |
G |
f (T ) |
реакции синтеза |
||||
|
|
|
|
|
|
r T |
|
|
аммиака, рассчитанные тремя различными способами – методом Темкина-
Шварцмана, Гиббса-Гельмгольца и по термодинамическим характеристикам реагентов, приведенным в литературе [4]. Из результатов расчета (таблица 7,
рисунок 3) следует, что зависимость r GT f (T ) для реакции синтеза аммиака,
полученная методом Темкина-Шварцмана, более точно соответствует литературным данным, чем зависимость, полученная методом Гиббса-
Гельмгольца. Метод Темкина-Шварцмана приводит к завышенным значениямr GT по сравнению с литературными данными.
Поэтому расчет равновесного состава реакционной смеси проведем по значениям r GT , полученным методом Темкина-Шварцмана.
17
Gº , кДж r T
140 |
|
120 |
Ур-е Гиббса-Гельмгольца |
|
|
100 |
Ур-е Темкина-Шварцмана |
|
|
|
Литературные данные |
80 |
|
60 |
|
40 |
|
20 |
|
0 |
|
-20 |
|
-40 |
|
300 400 500 600 700 800 900 1000
T, K
Рисунок 3 – Зависимости r GT f (T ) для реакции синтеза аммиака, полученные методами Темкина-Шварцмана, Гиббса-Гельмгольца и по литературным данным о термодинамических свойствах участников реакции
6.Расчет состава равновесной смеси для реакции синтеза аммиака при различных температурах и давлении P=5 атм
Расчет равновесного состава реакционной смеси проведем при температурах
400, 500 и 600 К (таблица 8).
Таблица 8 – Исходные данные для расчета равновесного состава идеальной газовой реакционной смеси N2+3H2 2NH3
T, K |
r GT , кДж |
lnKP= r GT / RT |
KP |
400 |
-12,120 |
3,644 |
38,262 |
|
|
|
|
500 |
9,300 |
-2,237 |
0,1068 |
|
|
|
|
600 |
31,397 |
-6,294 |
0,0018 |
|
|
|
|
Предполагаем, что для проведения реакции взяты стехиометрические
количества азота и водорода, то есть 1 и 3 моля, соответственно. После
18
установления равновесия в ходе реакции получается 2x моль NH3, при этом расходуется x моль N2 и 3x моль H2.
Составим таблицу с данными для вывода выражения константы равновесия для реакции синтеза аммиака.
Таблица 9 – Данные для составления выражения константы равновесия реакции
N2+3H2 2NH3
Свойства реакционной смеси |
|
Исходные вещества |
Продукт |
|||||||||||
|
|
|
N2 |
|
|
|
|
3H2 |
|
|
2NH3 |
|||
Количество реагента до начала реакции (t=0) , |
1 |
|
|
|
3 |
|
|
0 |
|
|
||||
моль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Количество реагента при равновесии (ni), моль |
|
|
1 - x |
|
|
|
|
3 - 3x |
|
|
2x |
|||
|
|
|
1 x |
|
|
|
|
3 1 x |
|
|
2x |
|
||
Мольная доля реагента при равновесии, Ni |
|
|
2(2 x) |
|
|
2(2 x) |
|
|
2(2 x) |
|||||
Парциальное давление реагента при |
|
|
1 x |
P |
|
|
3 1 x |
P |
|
x |
||||
равновесии (Pi), атм (при общем давлении P, |
|
|
|
|
|
|
|
P |
||||||
|
2(2 x) |
|
2(2 x) |
|
(2 x) |
|||||||||
атм) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Суммарное количество всех реагентов при равновесии, моль: |
|
|
|
|
|
|
|
|
||||||
ni 1 x 3 3x 2x 4 2x 2(2 x) . |
|
|
|
|
|
|
|
|
|
|
(6.1) |
|||
i |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Закон действующих масс для реакции синтеза аммиака с использованием данных таблицы 9 будет иметь следующий вид:
KP |
PNH2 |
|
x2 P |
2 |
|
23 (2 x)3 |
|
2(2 x) |
|
16x2 |
2 x 2 |
. |
(6.2) |
3 |
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
PH32 PN2 |
|
2 x 2 |
|
33 (1 x)3 P3 |
|
(1 x)P |
|
27 1 x 4 P2 |
|
|
||
|
Преобразуем уравнение (6.2), умножив обе его части на знаменатель и |
||||||||||||
перенесем все слагаемые в левую часть уравнения: |
|
|
|
||||||||||
|
|
|
27 1 x 4 P2 KP 16x2 2 x 2 , |
|
|
(6.3) |
|||||||
|
|
|
27 1 x 4 P2 KP 16x2 2 x 2 |
0 . |
|
|
(6.4) |
||||||
Уравнение (6.4) является алгебраически уравнением 4-ой степени, поэтому
решаем его в Excel с помощью встроенной функции Подбор параметра. При этом учитываем, что x может принимать значения только в пределах от 0 до 1.
Левую часть уравнения обозначим F(x) и будем искать такие значения x, при которых F(x)=0.
19
F(x) 27 1 x 4 P2 KP 16x2 2 x 2 . |
(6.5) |
Для подбора параметра сначала нажимаем кнопку в верхнем левом углу
меню кнопку Анализ “что-если”:
.
После нажатия кнопки появляется выпадающее меню следующего вида (рисунок
4), в котором выбираем пункт “Подбор параметра”.
Рисунок 4 – Вид выпадающего меню при нажатии кнопки Анализ “что-если”
Прежде чем использовать для поиска решения уравнения (4.4) функцию
Подбор параметра, составляем следующую форму в Excel:
Рисунок 5 – Форма в Excel для решения уравнения закона действующих масс (6.4) (для удобства ввода формулы она скопирована в окно Excel)
20
