
18.Влияние катализатора на скорость химической реакции.
19.Химическое равновесие. Принцип Ле-Шателье.
20.Основы химической термодинамики. Энтальпия системы.
21.Понятие об энтропии.
22.Соотношение между величиной изменения энергии Гиббса и величинами энтальпии и энтропии реакции.
23.Дисперсные системы. Коллоидные растворы.
24.Растворимость веществ.
25.Состав растворов. Способы выражения состава растворов.
26.Основные положения теории электролитической диссоциации.
27.Степень диссоциации электролитов. Факторы, определяющие степень диссоциации.
28.Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
29.Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
30.Обменные реакции в растворах электролитов.
31.Условия образования и растворения осадков.
32.Диссоциация воды. Константа диссоциации, ионное произведение воды.
33.Гидролиз солей. Механизм гидролиза.
34.Окислительно-восстановительные реакции. Основные типы окислительновосстановительных реакций.
35.Принцип электронного баланса.
36.Метод полуреакций.
18. Влияние катализатора на скорость химической реакции.
Катализ – это процесс изменения скорости химической реакции в присутствии катализатора.
Типы катализа: гомогенный и гетерогенный.
Гомогенный катализ – если катализатор и реагирующие вещества находятся в одной фазе.
Гетерогенный катализ – если катализатор и реагирующие вещества находятся в разных фазах.
Катализаторы - это вещества, которые повышают скорость химической реакции.
При этом сами катализаторы в химической реакции не расходуются. Установлено, что катализаторы изменяют механизм химической реакции. При этом возникают другие, новые, переходные состояния, характеризуемые меньшей высотой энергетического барьера. Таким образом, под действием катализатора снижается энергия активации процесса. Вступая в различного рода взаимодействия с промежуточными частицами, катализаторы по окончании реакции остаются в неизменном количестве. Катализаторы оказывают действие только на термодинамически разрешенные реакции. Катализатор не может вызвать реакцию, так как не влияет на ее движущие силы. Катализатор не влияет на константу химического равновесия, т.к. в равной степени уменьшает энергию активации и прямой, и обратной реакций.
Механизм действия катализаторов объясняется образованием промежуточных соединений. Например, механизм действия катализатора К в реакции А + В = АВ можно схематически показать так:
А + К = АК
АК + В = АВ + К
А + В = АВ (АК - промежуточное соединение).
В присутствии катализатора изменяется путь, по которому происходит суммарная реакция, поэтому изменяется ее скорость. Например: 2SO2 + O2 = 2 SO3 (медленно);
2SO2 + O2 = 2 SO3 (в присутствии катализатора NO - быстро).
Механизм: 2 NO + O2 = 2 NO 2 (быстро)
NO2 + SO2 = SO3 + NO (быстро). NO - катализатор, NO 2 - промежуточное соединение.
Энергия активации существенно меньше, следовательно, скорость реакции возрастает.
19. Химическое равновесие. Принцип Ле-Шателье.
Химическое равновесие — состояние химической системы, в которой протекает одна или несколько химических реакций, причём скорости в каждой паре прямой-обратной реакции равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем. А2 + В2 2AB.
Положение химического равновесия зависит от следующих параметров реакции: температуры, давления и концентрации. Влияние, которое оказывают эти факторы на химическую реакцию, подчиняется закономерности, которая была высказана в общем виде в 1884 году французским учёным Ле Шателье.
Принцип Ле Шателье: если на систему, находящуюся в равновесии, оказывают воздействие извне путем изменения какого-либо из условий, определяющих положение равновесия, то оно смещается в направлении того процесса, протекание которого ослабляет эффект произведённого воздействия. Так, повышение температуры вызывает смещение равновесия в направлении того из процессов, течение которого сопровождается поглощением тепла, а понижение температуры действует в противоположном направлении. Равновесие смещается вправо, если повысились равновесные концентрации продуктов прямой реакции. Если повышаются равновесные концентрации исходных веществ прямой реакции, то равновесие смещается влево. На равновесие влияют: температура; давление; концентрации веществ; добавление катализатора; изменение площади реакционной поверхности гетерогенных реакций. Добавление катализатора и изменение площади реакционной поверхности гетерогенных реакций не оказывают влияние на смещение химического равновесия. Если реакция эндотермическая, то повышение температуры приведет к смещению равновесия вправо. При увеличении концентрации какого-либо из веществ, участвующих в равновесной реакции, равновесие реакции сместится в сторону его расходования, а соответственно, при уменьшении концентрации какого-либо из веществ – в сторону реакции его образования. Изменение давления может оказывать влияние только на реакции с участием газообразных веществ. Если в реакции синтеза аммиака увеличить давление, равновесие сместится в сторону уменьшения числа моль газа. Если слева число моль газа больше, чем справа, равновесие сместится в сторону образования аммиака
20. Основы химической термодинамики. Энтальпия системы.
Химическая термодинамика - раздел химии, изучающий энергетику химических и физических превращений, направление протекания процессов в физико-химических системах, химические и фазовые превращения.
Химическая термодинамика изучает энергетику химических процессов и описывает состояние химического равновесия, термодинамические расчёты позволяют сделать вывод о возможности протекания химической реакции в определённых условиях. Однако термодинамика не может рассчитать скорость, с которой реагенты превращаются в продукты, не может также описать механизм реакции. Этим занимается химическая кинетика. Термодинамика и кинетика взаимно дополняют друг друга и позволяют дать полную характеристику химических реакций в зависимости от природы реагирующих веществ и внешних условий.
Система
тело или группа тел, находящихся во взаимодействии и обособленные от окружающей среды.
Термодинамическая система
система, в которой происходит энергоили массообмен.
Энтальпия (Н) — это свойство вещества, указывающее количество энергии, которую можно преобразовать в теплоту.
Энтальпия — это термодинамическое свойство вещества, которое указывает уровень энергии, сохранённой в его молекулярной структуре.
Это значит, что, хотя вещество может обладать энергией на основании температуры и давления, не всю её можно преобразовать в теплоту. Часть внутренней энергии всегда остаётся в веществе и поддерживает его молекулярную структуру. Часть кинетической энергии вещества недоступна, когда его температура приближается к температуре окружающей среды. Следовательно, энтальпия — это количество энергии, которая доступна для преобразования в теплоту при определенной температуре и давлении. Единицы энтальпии — джоуль для энергии и Дж/кг для удельной энергии.
Энтальпия или энергия расширенной системы Е равна сумме внутренней энергии газа U и потенциальной энергии поршня с грузом Eпот = pSx = pV
H = E = U + pV
Таким образом, энтальпия в данном состоянии представляет собой сумму внутренней энергии тела и работы, которую необходимо затратить, чтобы тело объёмом V ввести в
окружающую среду, имеющую давление р и находящуюся с телом в равновесном состоянии. Энтальпия системы H — аналогично внутренней энергии — имеет вполне определенное значение для каждого состояния: ΔH = H2 − H1
Если система каким-либо путём возвращается в исходное состояние (круговой процесс), то изменение любого её параметра равно нулю, а отсюда ΔU = 0 и ΔH = 0.
21. Понятие об энтропии.
Энтропия - понятие, впервые возникшее в термодинамике как мера необратимого рассеяния энергии.
Энтропию относят к определенным условиям – t = 25о, p = 101,325 кПа, T = 298.
Энтропия (S (Дж/К)) связана с числом (W) равновероятных микроскопических состояний, которыми можно реализовать данное макроскопическое состояние системы, уравнением
S=k*lgW
Где K- коэффициент пропорциональности.
Наименьшую энтропию имеют идеально правильно построенные кристаллы при абсолютном нуле. Энтропия кристалла, который имеет какие-либо неправильности несколько больше.
С повышением температуры энтропия всегда возрастает, так же возрастает при превращение вещества из кристаллического состояния в жидкое, и в особенности при переходе из жидкого состояния в газообразное.
Энтропия зависит только от состояния системы. Но связь изменения энтропии с теплотой зависит от способа проведения процесса – от его скорости.
Если процесс проходит обратимо и при постоянной температуре:
Изменение S = Q(обр)/T, где Q(обр) - кол-во теплоты, T- абсолютная температура.
22. Соотношение между величиной изменения энергии Гиббса и величинами энтальпии и энтропии реакции.
Энергия Гиббса является функцией состояния. При переходе системы из одного состояния в другое изменение ее величины не зависит от пути протекания процесса, а лишь от природы исходных и конечных веществ и их состояний. Поэтому энергию
Гиббса химической реакции rG° можно рассчитать через стандартные энергии Гиббса образования веществ, используя следствие из закона Гесса. Энергия Гиббса реакции равна сумме энергий Гиббса образования продуктов за вычетом энергий Гиббса образования исходных веществ с учетом стехиометрических коэффициентов. В результате протекания химической реакции (2.13) энергия Гиббса рассчитывается по формуле
rG° = l fG°L + m fG°M - d fG°D - b fG°B (2.16)
Энтальпийный и энтропийный факторы - стремление к объединению, порядку и стремление к разъединению, беспорядку, взятые по отдельности, - не могут быть критериями самопроизвольного течения химических реакций. Для изобарноизотермических процессов разность между этими значения и дает ту энергию, которая идет на совершение полезной работы при переходе системы из одного состояния в
другое, называемую энергией Гиббса процесса ( rG°) и равную
rG° = rH° -T rS° (2.17)
Энергия Гиббса служит критерием самопроизвольного протекания химической реакции в изобарно-изотермических процессах:
-если энергия Гиббса уменьшается, т. е rG° < 0, то реакция принципиально возможна;
-если энергия Гиббса систем возрастает, т. е. rG° > 0, то реакция не может протекать самопроизвольно;
-если rG° = 0, то реакция может протекать как в прямом, так и в обратном направлениях, т. е. обратима, в системе устанавливается равновесие.
+Направление химических реакций зависит oi их характера. Для экзотермических реакций ( rH° < 0) условие (2.17) соблюдается при любой температуре, если в ходе нее возрастает количество газообразных веществ и энтропия возрастает ( rS0 > 0). В данных реакциях обе движущие силы ( rH°) и (T rS0) направлены в сторону протекания
прямого процесса и rG° < 0 при любых температурах. Такие реакции могут самопроизвольно идти только в прямом направлении, т. е. являются необратимыми.
23. Дисперсные системы. Коллоидные растворы.
Дисперсными системами называются гетерогенные системы, в которых одно вещество распределено в другом в виде частиц различных размеров.
Любая дисперсная система состоит по меньшей мере из двух частей — дисперсной фазы в виде совокупности мельчайших частиц вещества и дисперсионной среды, в которой распределена дисперсная фаза. Размеры частиц дисперсионной фазы (кристалликов, капелек, пузырьков) отличаются степенью дисперсности, величина которой прямо пропорциональна размеру частиц.
Классификация дисперсных систем
1. По степени дисперсности различают грубодисперсные системы (взвеси) с
размером частиц более 100 нм и тонкодисперсные (коллоидные) с размером частиц от
1 до 100 нм.
Взвесь — смесь веществ, где твёрдое вещество распределено в виде мельчайших частиц в жидком веществе во взвешенном (не осевшем) состоянии.
Коллоидный раствор – это гетерогенная система, в которой граница раздела фаз может быть обнаружена только оптическим микроскопом. Предельным случаем тонкодисперсных систем являются истинные растворы.
Истинный раствор – это гомогенная однофазная система, в которой нет поверхности раздела, с размером частиц менее 1 нм, т.е. она состоит из отдельных ионов и молекул.
Можно сравнить: дисперсионная среда похожа на растворитель, а дисперсная фаза – на растворенное вещество.
2. По интенсивности взаимодействия частиц дисперсной фазы и дисперсионной среды дисперсные системы делятся на две группы: лиофильные и лиофобные.
Лиофильные системы характеризуются тем, что молекулы дисперсионной среды в значительной степени взаимодействуют с частицами дисперсной фазы (сольватируются), образуя вокруг нее оболочку. Эти системы характеризуются низким значением поверхностного натяжения и имеют предельно высокую дисперсность. К таким системам относятся растворы ВМС (например, желатин, целлюлоза, крахмал и т.д.).
Лиофобные системы не образуют сольватной оболочки из дисперсионной среды вокруг частиц дисперсной фазы. В таких системах взаимодействие между частицами различных фаз значительно слабее. Значение межфазного поверхностного натяжения велико, вследствие чего система проявляет тенденции к самопроизвольному укрупнению частиц дисперсной фазы. Такие системы образуют неорганические и органические вещества плохо растворимые в данной среде.
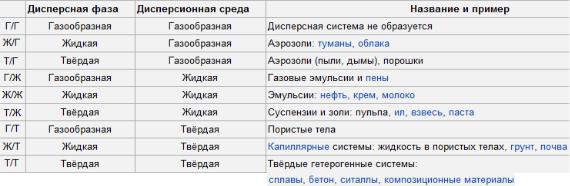
3. По агрегатному состоянию дисперсионной среды и дисперсной фазы.
Пути
образования
дисперсной системы:
1)Конденсационный – связан с зарождением новой фазы в перенасыщенной исходной фазе. Эта перенасыщенная исходная фаза впоследствии становится дисперсной средой.
2)Диспергационный – осуществляется при значениях поверхностного натяжения ниже некоторого критического значения.
3)Возможно образование дисп. системы в результате химической реакции в гомогенной среде. При этом продукты реакции при данных условиях находятся в агрегатном состоянии, отличном от материнской фазы.
24. Растворимость веществ.
При растворении твердых веществ и газов в жидкостях для каждой пары растворенное вещество — растворитель существует граница смешивания, которая характеризует растворимость вещества. Каждое вещество обладает индивидуальной растворимостью
вкаждом растворителе. Растворимость веществ зависит от температуры. Так например,
вжидких растворителях, при повышении температуры, растворимость твердых веществ, как правило, возрастает, а растворимость газов снижается. На растворимость газов, сильное влияние оказывает давление: при повышении давления растворимость газов возрастает.
Растворимость вещества в растворителе количественно определяется составом образуемого ими насыщенного раствора Насыщенный раствор — это такой раствор, при добавлении в который порции
растворяемого вещества оно уже больше не переходит в раствор, а его содержание в растворе равно растворимости этого вещества Таким образом, насыщенный раствор находится в контакте с избытком растворяемого вещества в виде второй фазы (осадка).
Ненасыщенный раствор — это такой раствор, в котором содержание растворенного вещества меньше растворимости этого вещества Пересыщенный раствор — это такой раствор, в котором содержание растворенного вещества превышает растворимость этого вещества
Концентрация раствора – это количество вещества, заключенного в определенном весовом или объемном количестве раствора или растворителя.
25.Состав растворов. Способы выражения состава растворов.
Способы выражения концентрации: |
|
|
1) Массовая доля вещества (ω) – отношение массы растворенного вещества (mв-ва) |
||
к массе раствора(mр-ра). Массовая доля – величина безразмерная, ее представляют |
||
ω = mв−ва |
100% |
|
либо в долях, либо в процентах. |
|
|
|
mр−ра |
|
2) Молярная концентрация См– отношение количества вещества в молях (n) к объему |
|
раствора в литрах (моль/л = М) |
n |
|
|
|
С = V |
|
л |
3) Нормальная концентрация или молярная концентрация эквивалента Сн – |
||
Сн = |
m |
|
отношение количества эквивалентов вещества к объему раствора (Н). |
||
|
M f V |
|
Т = mв−ва |
л |
|
|
||
2) Титр (Т) – это масса вещества в граммах 1 мл раствора (г/см3). |
||
|
V |
|
|
р−ра |
|
3) Моляльная концентрация Cm– отношение количества молей растворенного
вещества к 1000 г растворителя, т.е. число молей растворенного в-ва в 1000 г
растворителя (моль/кг). С = n
m mр−ля
26. Основные положения теории электролитической диссоциации.
Процесс распада вещества на ионы при растворении в воде или расплавлении называют электролитической диссоциацией.
Электролитическая диссоциация состоит из двух одновременно протекающих обратных процессов: из диссоциации (распад молекул на ионы) и ассоциации (процесс образования молекул из ионов)
В водных растворах диссоциации подвержены кислоты, сильные основания и растворимые соли:
HCl = H++Cl-
При диссоциации происходит резкое увеличение числа частиц в растворе – это отличает растворы электролитов от растворов неэлектролитов. Именно поэтому растворы солей замерзают при более низкой температуре, чем растворы неэлектролитов.
Согласно теории электролитической диссоциации С. Аррениуса и Д. И. Менделеева можно сформулировать основные положения теории электролитической диссоциации
(ТЭД):
 При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
При растворении в воде (или расплавлении) электролиты распадаются на положительно и отрицательно заряженные ионы (подвергаются электролитической диссоциации).
 Электролитическая диссоциация - процесс обратимый (обратная реакция называется ассоциацией).
Электролитическая диссоциация - процесс обратимый (обратная реакция называется ассоциацией).
27. Степень диссоциации электролитов. Факторы, определяющие степень диссоциации. Электролиты – вещества, растворы или расплавы которых проводят электрический
ток.
Неэлектролиты – вещества, растворы или расплавы которых не проводят электрический ток.
