
Диссоциация – распад соединений на ионы.
Степень диссоциации – отношение числа продиссоциированных на ионы молекул к общему числу молекул в растворе.
Диссоциация электролита количественно характеризуется степенью диссоциации. Степень диссоциации a – это отношение числа молекул, диссоциированных на ионы n., к общему числу молекул растворенного электролита N:
a = n/N * 100% a – доля молекул электролита, распавшихся на ионы.
Степень диссоциации электролита зависит от многих факторов: природы электролита, природы растворителя, концентрации раствора, температуры.
28. Теория сильных электролитов. Истинная и кажущаяся степень диссоциации сильных электролитов.
Согласно теории Дебая — Гюккеля, сильные электролиты полностью диссоциированы на ионы. Однако свободному движению частиц в жидкости препятствуют электростатические силы, действующие между ионами. В растворе, так же как и в кристалле, каждый ион окружен ионами противоположного знака, так называемой ионной атмосферой, которая перемещается вместе с центральным ионом и

ограничивает его подвижность. В результате электропроводность раствора сильного электролита оказывается меньше той величины, которая должна быть, если бы все ионы могли беспрепятственно перемещаться в электрическом поле. Следовательно, создается впечатление, что в растворах сильных электролитов число свободных ионов меньше, чем их общая (аналитическая) концентрация. Поэтому для характеристики сильного электролита вводится понятие эффективной (т. е. проявляющей себя в действии) концентрации ионов, называемой также активностью а. Эта величина аналогична концентрации свободных гидратированных ионов (согласно теории электролитической диссоциации)
Суть диссоциации сильных электролитов заключается в том, что они диссоциируют полностью, необратимо:
AB = A+ + B-.
Истинная степень диссоциации сильных электролитов равна всегда 100 % (1,0 доли ед.
).
В растворах сильных электролитов ионов очень много (особенно при повышенных концентрациях). Отсюда две особенности растворов сильных электролитов:
•расстояния между ионами очень малы, иногда всего в 2-3 раза больше, чем в кристаллической решетке;
•количество ионов электролита соизмеримо с количеством молекул воды, и поэтому не все ионы могут быть гидратированы молекулами воды.
Кажущаяся степень диссоциации учитывает активные ионы, принявшие участие в физических и химических процессах.
Истинная степень диссоциации сильных электролитов всегда равна 1,0, кажущаяся степень диссоциации возрастает с повышением температуры раствора и понижением концентрации раствор
29. Основания, кислоты и соли с точки зрения теории электролитической диссоциации.
Основываясь на теории электролитической диссоциации можно дать определения важнейшим классам неорганических соединений
Кислота – соединение, образующее пи диссоциации в водном растворе из положительных ионов только ионы водорода Н+.

Свойства кислот: взаимодействие с основаниями с образованием солей;взаимодействие с некоторыми металлами с выделением водорода;изменение цвета индикаторов, в частности, вызывать красную окраску лакмуса;кислый вкус.
Любая кислота при диссоциации дает выделение водорода. Поэтому все свойства, объясняются присутствием гидратированных ионов водорода. Именно они дают красную окраску лакмусовой бумажки.
H2SO3 2H+ + SO32-, CH3COOH H+ = CH3COO-.
Основания – соединения, образующие при диссоциации в водном растворе из отрицательных ионов только гидроксид-ионы ОН-.
Свойства оснований: взаимодействие с кислотами с образованием солей; изменение цвета индикаторов иначе, чем их изменяют кислоты (например, они вызывают синюю окраску лакмуса); «мыльный» вкус.
КOH К++ OH- ,
Сa(OH)2 Сa2++ 2OH-, NH3·H2O NH4++ OH-.
Соли – соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов и отрицательные ионы кислотных остатков.
При растворении кислых солей в растворе образуются катионы металла, сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе ионы.
Например:
В соответствии с этим делят: Средние соли (Na2CO3);Кислые соли
(NaHCO3);Основные соли (Ca(OH)Cl).
30. Обменные реакции в растворах электролитов.
Реакции в растворах электролитов протекают между ионами, на которые диссоциируют растворенные вещества. При этом не изменяются степени окисления элементов.
Не все ионные обменные реакции необратимы. Ионные обменные реакции идут до конца в том случае, если в результате реакции образуется:
нерастворимое соединение, выпадающее в осадок;
газообразное вещество;
слабый электролит (вода, слабое основание (NH4OH) или слабая кислота (HNO2)).
Уравнения реакций такого типа более правильно писать не в молекулярной, а в ионномолекулярной форме. В этих уравнениях указывают ионы, на которые распадаются молекулы сильных электролитов. Малорастворимые вещества, выделяющиеся из раствора в виде осадка, газообразные соединения и слабые электролиты в этих уравнениях пишут в молекулярном виде. Кроме того, существует краткая ионная форма записи уравнения реакции, отображающая сущность реакции, протекающей в растворе электролита.
BaCl2+ Na2SO4= BaSO4↓ + 2NaCl
2NaOH + H2SO4= H2O + Na2SO4
2NaNO2 + H2SO4 = 2HNO2 + Na2SO4
NH4Cl + NaOH = NH4OH + NaCl
31. Условия образования и растворения осадков.
Условием образования осадка является превышение произведения концентраций ионов (ПК) малорастворимого электролита над его произведением растворимости, т.е.ПК > ПР.
При увеличении концентрации одного из ионов ТРЭ в его насыщенном растворе (например, путем введения хорошо растворимого электролита, содержащего тот же ион) произведение концентраций ионов электролита (ПК) становится больше ПР. При этом равновесие между твердой фазой и раствором смещается в сторону образования осадка. Например, если в насыщенный раствор AgCI добавить сильный электролит KCI,то появление в растворе одноименного иона (CI-) приводит к смещению равновесия в сторону образования осадка (←). Когда установится новое равновесие, то произведение концентраций (ПК) ионов электролита вновь становится равным ПР, но при этом в растворе появится осадок. В состоянии нового равновесия концентрация ионов Ag+ будет меньше, а концентрация ионов CIбольш е, чем было до добавления
KCI. AgCI↓ <=> Ag+ + CI- + КCI <=> K+ + CI-.
По принципу Ле-Шаталье, если [CI-] ↑, то смещение равновесие произойдет в сторону образования осадка.
Напротив, если в насыщенном растворе электролита уменьшить концентрацию одного из ионов (например, связав его каким-либо другим ионом), произведение концентраций ионов будет меньше значения ПР, раствор станет ненасыщенным, и равновесие между раствором и осадком сместится в сторону растворения осадка (→).
Сu(OH)2↓ <=> Cu+2 + 2OH- + HCI <=> H+ + CI-
При добавлении HCI происходит реакция H+ + OH- <=> H2O , при этом [OH-] ↓, смещение равновесия происходит в сторону продуктов диссоциации основания.
32. Диссоциация воды. Константа диссоциации, ионное произведение воды.
Вода - слабый электролит - диссоциирует, образуя ионы H+ и OH-. Эти ионы гидратированы, то есть, соединены с несколькими молекулами воды, но для простоты мы записывали их в негидратированной форме
H2O = H+ + OH−
Запишем выражение для константы равновесия, опираясь на закон действия
масс:
K = [H+]•[OH—]/[H2O]
Концентрацию воды, принято исключать из данного выражения, вследствие ее практически постоянного значения в разбавленных растворах. Получаем новую константу равновесия KН2О, которая называется ионным произведением воды:
KН2О = [H+]•[OH—]
При температуре 25ºС KН2О = 1•10-14 и остается постоянным в водных растворах кислот, щелочей, солей или других соединений.
KН2О = [H+]•[OH—] = 1•10-14
При повышении температуры ионное произведение воды сильно возрастает. Полученное выражение применимо не только к чистой воде, но и к растворам. Если осуществляется условие [H+] = [OH—], то раствор называется
нейтральным, но обычно эти величины не совпадают, тогда при увеличении одного показателя, другой должен уменьшаться, так, чтобы их произведение оставалось постоянным (1•10-14).
Кислотно-основные свойства растворов определяются величиной концентрации ионов водорода или гидроксила. Мы уже знаем, что ионное произведение воды при определенной температуре постоянно, а [H+] и [OH—] — переменные, то по их величинам можно говорить о кислотности или щелочности раствора. При нейтральном характере раствора, т.е. [H+] = [OH—], получаем следующее:
[H+] = [OH—] = (KН2О)1/2 = (1•10-14)*1/2 = 10-7 М
Соотношение между количеством ионов [H+] и [OH-] определяет характер
среды:
[H+] =10-7= [OH-] - нейтральная среда [H+] >10-7> [OH-] - кислая среда
[H+] <10-7< [OH-] - щелочная среда.
33. Гидролиз солей. Механизм гидролиза.
Гидролиз солей – это химическая реакция ионного обмена между водой и растворённым в ней веществом с образованием слабого электролита.
В большинстве случаев гидролиз сопровождается изменением pH раствора. Большинство реакций гидролиза - обратимы:
Pb(NO3)2 + H2O => Pb(OH)(NO3) + HNO3 Na2HPO4 + H2O => NaH2PO4 + NaOH
Некоторые реакции гидролиза протекают необратимо: Al2S3 + 6H2O => 2Al(OH)3¯ + 3H2S↑
Причиной гидролиза является взаимодействие ионов соли с молекулами воды из гидратной оболочки с образованием малодиссоциированных соединений или ионов.
Способность солей подвергаться гидролизу зависит от некоторых факторов:
свойств ионов, образующих соль;
концентрации соли и продуктов реакции;
температура.
Если соль образована сильным основанием и сильной кислотой, то гидролизу она не подвергается.
Если сильной кислотой и слабым основанием – кислая среда. Если слабая кислота и сильное основание – щелочная среда.
Механизм гидролиза для разных типов соединений весьма различен. Так, гидролиз соединений, распадающихся в растворе на ионы, можно рассматривать как результат поляризационного взаимодействия ионов с их гидратной оболочкой. Характер и степень распада молекул гидратной оболочки зависят от природы катионов и анионов — чем сильнее поляризующее действие ионов, тем в большей степени протекает гидролиз.
Всоответствии с последовательным усилением акцепторной способности катионов (увеличением их заряда и уменьшением размеров) возможны два случая:
▪отсутствие заметного разложения молекул воды. Подобным образом ведут себя слабые акцепторы электронных пар — катионы щелочных и щелочноземельных металлов.
▪обратимое разложение молекул воды с образованием гидроксоаквакомплексов.
Взависимости от электронодонорной активности анионов возможны следующие случаи:
▪отсутствие заметного разложения молекул воды: однозарядные анионы и прочие слабые доноры
▪ обратимое разложение молекул воды: доноры средней силы.
Суммарный эффект гидролиза определяется природой находящихся в растворе катионов и анионов.
1. Если соединение при ионизации в растворе образует катионы и анионы, которые слабо поляризуют гидратную оболочку, гидролиз практически не происходит и рН среды не изменяется.
Примеров нет, потому что нет гидролиза.
2. Если соединение при ионизации образует катионы, которые поляризуют молекулы гидратной оболочки, и анионы, слабо поляризующие их, то происходит гидролиз по катиону. При этом образуется кислая среда, например
Cu2+ + |
Н2О |
= |
CuOH+ + |
Н+ |
CuCl2 + Н2О = CuOHCl + HCl |
|
|
|
|
3. Если соединение при растворении ионизируется на слабополяризующие катионы и среднеполяризующие анионы, то происходит гидролиз по аниону и в результате гидролиза создается щелочная среда, например.
CO32− + |
H2O |
= |
HCO3− + |
OH− |
Na2CO3 + Н2О = NaHCO3 + NaOH |
|
|
|
|
4. Если соединение при ионизации образует среднеполяризующие катионы и анионы, то происходит гидролиз и по катиону, и по аниону. При этом обычно наблюдается гидролиз с образованием малорастворимых слабых оснований и слабых кислот:
2Al3+ + |
3S2− + |
6Н2О |
= |
2Al(OH)3(осадок) |
+ |
ЗН2S(газ) |
Al2S3 + 6H2O = 2Al(OH)3 + 3H2S |
|
|
|
|
||
Большинство соединений неметаллов с неметаллами в воде необратимо гидролизируются на две кислоты.
34. Окислительно-восстановительные реакции. Основные типы окислительновосстановительных реакций.
Окислительно-восстановительные реакции - это реакции, протекающие с
изменением степеней окисления атомов, входящих в состав реагирующих веществ.
В каждой окислительно-восстановительной реакции происходят два противоположных, но взаимосвязанных процесса:
1). Окисление – это процесс отдачи электронов атомом, молекулой или ионом. Например:
Mg – 2e - → Mg+2
H2 − 2e - → 2H+
2I - − 2e - → I2
При окислении степень окисления повышается. Атом, молекула или ион, отдающие электроны, называется восстановителем.
2). Восстановление - это процесс присоединения электронов атомом, молекулой или ионом.
Например:
S + 2e - → S-2 Cl2 + 2e - → 2Cl Cu+2 + 2e - → Cu
При восстановлении степень окисления понижается. Атом, молекула или ион, присоединяющие электроны, называется окислителем. В любой окислительновосстановительной реакции процессы окисления и восстановления могут протекать только одновременно. Окислитель при этом восстанавливается, а восстановитель окисляется. Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем.
Типы овр:
Классификация ОВР.
1)Межмолекулярные – в ходе которых окислитель и восстановитель находятся в разных веществах:
MnO2 + 4HCl = MnCl2 + Cl2 + 2H2O
2)Внутримолекулярные – в ходе которых окислитель и восстановитель находятся в одном веществе.
KClO3 = KCl + O2
3)Диспропорционирование – атомы одного и того же элемента являются и окислителем и восстановителем.
Cl2 + H2O = HCl + HClO
35. Принцип электронного баланса.
Суть метода электронного баланса заключается в:
•Подсчете изменения степени окисления для каждого из элементов, входящих в уравнение химической реакции
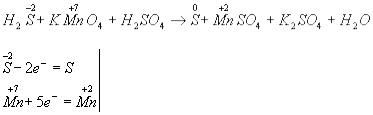
•Элементы, степень окисления которых в результате произошедшей реакции не изменяется - не принимаются во внимание
•Из остальных элементов, степень окисления которых изменилась - составляется баланс, заключающийся в подсчете количества приобретенных или потерянных электронов
•Для всех элементов, потерявших или получивших электроны (количество которых отличается для каждого элемента) находится наименьшее общее кратное
•Найденное значение и есть базовые коэффициенты для составления уравнения.
5Н2S + 2КМnО4 + ЗН2SО4 = 5S + 2МnSО4 + К2SО4 + 8Н2О
36. Метод полуреакций.
Ионно-электронный метод (метод полуреакций)
Реакции окисления-восстановления, также как и реакции обмена, в растворах электролитов происходят с участием ионов. Именно поэтому ионно-молекулярные
