Медична генетика. Підручник для вузів. В.М. Запорожан, Ю.І. Бажора, А.В. Шевеленкова, М.М. Чеснокова. — Одеса, ОДМУ, 2005
.pdf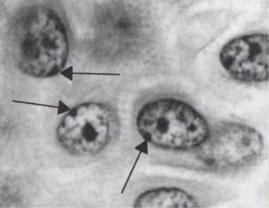
10.3.5. ВИЗНАЧЕННЯ СТАТЕВОГО ХРОМАТИНУ
Це експрес-метод, який дозволяє визначити кількість статевих хромосом, але потребує подальшого каріотипування для підтвердження діагнозу.
Розроблено методи визначення Х-статевого хроматину (тілець Барра) і Y-статевого хроматину.
Х-статевий хроматин. Тільця Барра — це спіралізована Х-хромосома. Одна з Х-хромосом у плодів жіночої статі інактивується і спіралізується на 16–19-ту добу ембріонального розвитку, а друга залишається активною. Спіралізована Х-хромосома помітна в ядрах соматичних клітин у вигляді темної, добре забарвленої грудки (рис. 10.6). Тільця Барра виявляють в епітеліальних клітинах із слизової оболонки щоки (у букальному зскрібку).
Методика визначення статевого хроматину в букальному зскрібку така. Після попереднього полоскання ротової порожнини стоматологічним шпателем беруть зскрібок епітелію внутрішньої поверхні щоки біля корінних зубів. Зскрібок наноситься рівномірним шаром на предметне скло, забарвлюється протягом 2 хв ацетоорсеїном, потім накривається покривним склом. Надлишки барвника видаляють за допомогою фільтрувального паперу. Підрахунок кількості тілець статевого хроматину проводять під імерсією в круглих або овальних ядрах з непорушеною ядерною мембраною. В епітеліальних клітинах грудки статевого хроматину розташовуються під ядерною мембраною. В жінок у нормі статевий хроматин знаходять більше як у 20 % клітин. У чоловіків статевий хроматин у нормі відсутній.
Статевий хроматин можна виявляти також у мазках крові, забарвлених за Романовським — Гімзою. У нейтрофільних лейкоцитах тільця Барра мають вигляд барабанних паличок. У нормі в жінок барабанні палички виявляються в 1–2 % лейкоцитів, у чоловіків — відсутні.
Метод використовують:
— для експрес-діагностики хромосомних хвороб, пов’язаних зі зміною кількості Х-хромосом.
Рис. 10.6. Статевий хроматин у клітинах епітелію слизової оболонки щоки (грудки статевого хроматину відмічено стрілками)
Кількість Х-хромосом на одиницю більше кількості грудок статевого хроматину і визначається за формулою:
N = n + 1,
де N — кількість Х-хромосом; n — кількість грудок статевого хроматину;
—як експрес-метод діагностики статі при гермафродитизмі;
—у судовій медицині для визначення статевої належності фрагментів трупа людини (тільця Барра добре зберігаються в хрящовій тканині).
Y-статевий хроматин. Y-хроматин — це інтен-
сивно флуоресціююча ділянка довгого плеча Y-хромосоми в інтерфазних ядрах. Його можна визначити в букальному зскрібку, лейкоцитах периферичної крові за такою методикою. Препарат забарвлюють флуоресцентним барвником ак- рихін-іпритом. Під люмінесцентним мікроскопом Y-хроматин виявляється в ядрі клітини як яскрава пляма діаметром 0,3–1,0 мкм. У чоловіків в нормі одна грудка Y-хроматину. Метод використовується для експрес-діагностики синдрому полісомії Y.
10.4. МОЛЕКУЛЯРНОГЕНЕТИЧНІ МЕТОДИ (МЕТОДИ ДНК-ДІАГНОСТИКИ)
Молекулярно-генетичні методи (методи ДНКдіагностики) — це велика і різноманітна група методів, призначених для виявлення варіацій у структурі досліджуваної ділянки ДНК.
10.4.1. ПОКАЗАННЯ ДО ДНК-ДІАГНОСТИКИ
1.Підтвердження клінічного діагнозу моногенного захворювання та уточнення типу мутації. Можливості діагностики пов’язані зі здійсненням програми «Геном людини» і розшифровкою геному людини. Перелік моногенних хвороб, що діагностуються молекулярними методами і є доступними пренатальній діагностиці, постійно розширюється. До цього списку належать: муковісцидоз, м’язова дистрофія Дюшенна — Беккера, гемофілія (А і В), фенілкетонурія, хвороба Хантера (мукополісахаридоз), адреногенітальний синдром, хорея Гентінгтона, синдром фрагільної Х-хромосоми та ін. Сьогодні можлива діагностика (у лабораторіях усіх країн світу) більше 1000 моногенних захворювань.
2.Пресимптоматична діагностика — коли клінічні ознаки захворювання з пізнім дебютом відсутні.
3.Виявлення гетерозиготних носіїв мутантного гена у випадках автосомно-рецесивних або зчеплених з Х-хромосомою захворювань.
4.Пренатальна діагностика моногенних хво-
роб.
5.Преімплантаційна діагностика.
189
6. Виявлення генетичної схильності до мульти- |
10.4.3. ЕТАПИ ДНК-ДІАГНОСТИКИ З |
|
факторіальних захворювань. |
|
|
7. Ідентифікація особи (геномна дактилоскопія) |
ВИКОРИСТАННЯМ ПОЛІМЕРАЗНОЇ |
|
і встановлення споріднення в судовій медицині. |
ЛАНЦЮГОВОЇ РЕАКЦІЇ |
|
8. Діагностика онкологічних захворювань. |
|
|
9. Визначення типу метаболізму лікарських |
Сьогодні одним з основних методів ДНК-діаг- |
|
препаратів у клінічній фармакогенетиці. |
ностики є полімеразна ланцюгова реакція (ПЛР). |
|
10. Діагностика інфекційних захворювань (ви- |
Метод було розроблено в 1983 р. К. Мюллісом |
|
явлення ДНК або РНК збудника). Сьогодні ство- |
(США). За розробку цього методу в 1993 р. йому |
|
рені й широко використовуються в практичній |
було присуджено Нобелівську премію в галузі |
|
діагностиці тест-системи для ідентифікації: ВІЛ- |
хімії. |
|
інфекції (визнано еталонним методом), гепатитів |
Метод грунтується на ампліфікації (тобто ба- |
|
В, С, D, E, у тому числі кількісна діагностика; за- |
гатократній редуплікації) in vitro певної ділянки |
|
хворювань, що передаються статевим шляхом: |
ДНК завдовжки від кількох десятків до тисячі та |
|
хламідіозу, уреаплазмозу, мікоплазмозу, трихомо- |
більше пар нуклеотидів. Це дозволяє протягом 3– |
|
нозу, гарднерельозу, гонореї, TORCH-інфекцій |
5 год одержати велику кількість копій потрібної |
|
(токсоплазмозу, краснухи, герпесу, цитомегалові- |
послідовності ДНК. Ідентифікація такої великої |
|
русу); бронхолегеневих |
захворювань, у |
кількості копій ДНК надалі не є дуже складною. |
т. ч. туберкульозу, а також деяких інших. Прак- |
Як матриця придатна будь-яка ДНК, виділена з |
|
тично за допомогою цього методу може бути ви- |
різних джерел. Головними перевагами методу |
|
явлений будь-який мікроорганізм або вірус у будь- |
ПЛР є таке: |
|
якому середовищі. |
|
— ампліфікація потрібної ділянки ДНК, навіть |
11. Визначення стійкості збудників інфекційних |
якщо аналізований препарат недостатньо очище- |
|
захворювань до антибіотиків. Формування стій- |
ний або є складною сумішшю молекул. Саме та- |
|
кості пов’язане з мутаціями певних генів, які мож- |
кими препаратами є зразки крові, сечі, ексудатів, |
|
на ідентифікувати. |
|
мокротиння та інших середовищ організму, а та- |
12. У перспективі — для створення генетично- |
кож бактерійні культури; |
|
го паспорта будь-якої людини. Йдеться про те, що |
— ампліфікація ДНК, що міститься в зразку в |
|
за допомогою автоматизованої системи можна |
дуже малих кількостях. По суті, як стартовий ма- |
|
проаналізувати весь спектр мутацій, відповідаль- |
теріал для ПЛР достатньо взяти не тільки одну |
|
них як за моногенні, так і мультифакторіальні за- |
клітину, але й одну молекулу. Це важливо при до- |
|
хворювання, визначити схильність до онкологіч- |
слідженні проб повітря, води тощо на наявність |
|
них захворювань. |
|
патогенних збудників захворювань, фрагментів |
|
|
тканин людини для судово-медичних досліджень; |
10.4.2. ВИХІДНИЙ МАТЕРІАЛ |
— можливість довгострокового зберігання ма- |
|
теріалу для дослідження у зв’язку зі стійкістю мо- |
||
ДЛЯ ПРОВЕДЕННЯ |
|
лекули ДНК. |
ДНК-ДІАГНОСТИКИ |
|
Розрізняють такі етапи ДНК-діагностики з ви- |
Для молекулярно-генетичної діагностики вико- |
користанням полімеразної ланцюгової реакції. |
|
1. Виділення ДНК. Для проведення ампліфікації |
||
ристовують будь-які ядровмісні клітини. |
не потрібна велика кількість матричної ДНК, при- |
|
Для діагностики спадкового захворювання часті- |
датні навіть невеликі фрагменти слабоочищеної |
|
ше беруть кров (лейкоцити), рідше — зскрібки з |
ДНК, в принципі може бути достатньо навіть |
|
порожнини рота, волосяні фолікули. |
однієї молекули. Як правило, ДНК із біологічно- |
|
Для пренатальної діагностики проводять хоріо- |
го матеріалу виділяють методами лізису клітин з |
|
центез (отримання ворсинчастої оболонки — хо- |
подальшим очищенням від білкових компонентів. |
|
ріона), плацентоцентез (отримання тканини пла- |
Для підвищення чутливості реакції ДНК можна |
|
центи), амніоцентез (отримання амніотичної ріди- |
сорбувати на іонообмінних смолах. |
|
ни і виділення з неї клітин), кордоцентез (отриман- |
2. Полімеразна ланцюгова реакція, яка дозво- |
|
ня пуповинної крові). |
|
ляє вибірково ампліфікувати (багатократно ре- |
Для доімплантаційної діагностики — бластомер |
дуплікувати) потрібну ділянку ДНК у мільйони |
|
або полярне тільце. |
|
разів. |
Для ідентифікації особи |
у судовій медицині |
Необхідною умовою для проведення ПЛР є |
використовують будь-які тканини (плями крові, |
знання нуклеотидної послідовності ампліфікованої |
|
шкіра, сперма та ін.), для встановлення споріднен- |
ділянки ДНК, оскільки специфічний вибір цієї |
|
ня за допомогою методів геномної дактилоскопії |
ділянки здійснюється шляхом гібридизації матрич- |
|
— кров. |
|
ної ДНК з двома штучно синтезованими прайме- |
Для діагностики інфекційних захворювань — |
рами. Праймери — олігонуклеотидні послідов- |
|
зскрібки з піхви, уретри, бронхолегеневі змиви, |
ності ДНК завдовжки від 15 до 30 п. н., компле- |
|
кров, культури збудників. |
|
ментарні 3′-кінцям ампліфікованої ділянки на |
Для діагностики онкологічних захворювань — |
змістовому й антизмістовому ланцюгах ДНК |
|
червоний кістковий мозок (при лейкозі) та ін. |
відповідно. Таким чином, відстань між праймера- |
|
Для діагностики мітохондріальних хвороб ос- |
ми визначає довжину синтезованих фрагментів |
|
новним джерелом ДНК є біоптат м’язів. |
ДНК. |
|
190
По суті, метод ПЛР імітує природний процес редуплікації ДНК у клітинах. До складу реакційного розчину вводять ДНК обстежуваної людини, чотири види нуклеотидів ДНК (dNTP — дезокси- рибонуклеотид-трифосфати), а також термостабільну ДНК-полімеразу (Taq-полімеразу), яка зберігає свою активність при високій температурі. Цей фермент було виділено з бактерій, які живуть у гарячих джерелах (Thermus aquaticus). Оптимум роботи ферменту — при температурі +72 °С.
Реакція відбувається у спеціальній буферній суміші з певними концентраціями іонів калію, хлору, магнію і точним значенням рН.
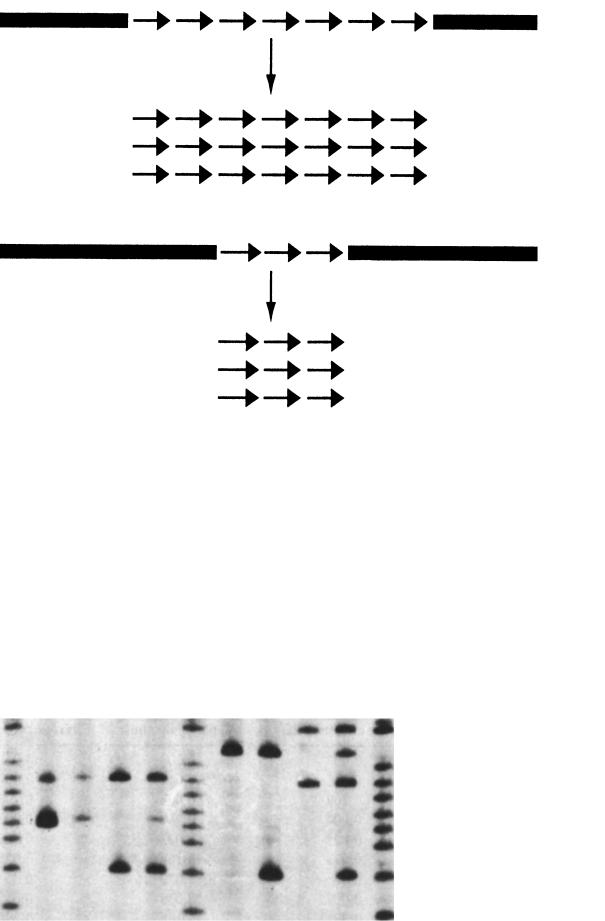
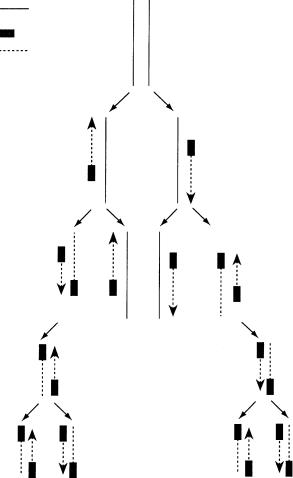
Полімеразна ланцюгова реакція відбувається циклічно. Кожен цикл має три фази (рис. 10.7):
1)денатурація (плавлення) — суміш нагрівають до 90–95 °С. При цьому відбувається розрив водневих зв’язків, що з’єднують два ланцюги ДНК, і ДНК перетворюється на однониткову форму;
2)гібридизація (відпал) — суміш охолоджують до 45–60 °С, праймери з’єднуються з комплементарними ділянками ДНК;
3)синтез — суміш знову нагрівають до 72 °С, починає працювати термостабільна ДНК-поліме- раза, і синтезується дочірній ланцюг ДНК. ДНКполімераза добудовує нитку нуклеотидів компле-
Вихідна ДНК Праймери
Синтезована
ДНК
Дволанцюжкова ДНК + праймери
+ dNTP + ДНК-
полімераза Taq
Теплова
денатурація
Відпал з праймером і подовження ланцюга за допомогою ДНК-поліме- рази Taq
Рис. 10.7. Полімеразна ланцюгова реакція (збільшення кількості копій ДНК у геометричній прогресії)
ментарно матричній ДНК, причому синтез ДНК йде від місця гібридизації праймера у напрямі 3′– 5′. При цьому праймер включається до складу щойно синтезованої ділянки нуклеїнової кислоти. У подальших циклах нові синтезовані молекули ДНК стають, у свою чергу, матрицею для аналогічного синтезу нових копій. Оскільки синтез кожного з двох антипаралельних ланцюгів ДНК розпочинається від місця гібридизації праймера, це місце і стає межею синтезованої ділянки.
Якщо уявити собі, що в реакційній суміші знаходилася одна молекула ДНК з ділянкою, яку необхідно редуплікувати, то після першого циклу одержують 2 молекули, після другого циклу — 4 і т. ін. Тобто кількість копій ДНК збільшується в геометричній прогресії.
Кількість вказаних циклів у ПЛР становить зазвичай від 25 до 30. У результаті кількість копій ДНК збільшується в мільйони разів.
Суміш ставлять у спеціальний прилад — термоциклер (ампліфікатор). У ньому автоматично відбувається зміна температур, необхідних для реакції.
Переваги ПЛР:
—значне (у 2–10 разів) скорочення витрат праці та часу;
—висока точність, принципова неможливість отримання хибнопозитивних результатів;
—можливість проведення дослідження навкрай малому (кілька мікролітрів) об’ємі матеріалу;
—простота підготовки матеріалу до дослідження; може використовуватися практично будьяка тканина або рідина організму.
Проведення ПЛР-діагностики вимагає ретельного дотримання всіх санітарно-гігієнічних норм для уникнення забруднення зразків чужорідною ДНК, спеціально обладнаних лабораторій і навченого персоналу.
3. Аналіз одержаних результатів. Подальший аналіз ампліфікованих фрагментів ДНК передбачає дослідження конкретних особливостей ампліфікованого фрагмента. Фрагменти з нормальною
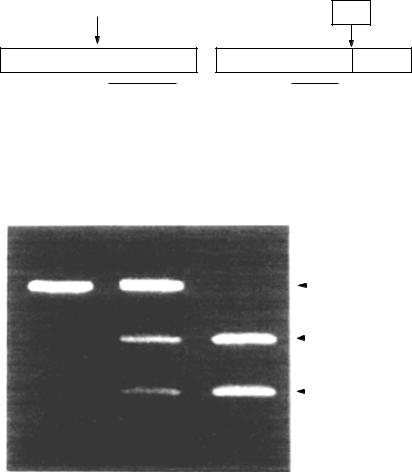
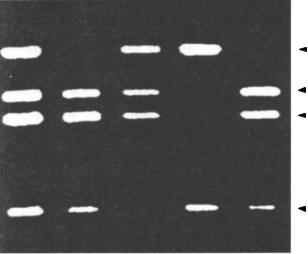
імутантною послідовностями можуть відрізнятися за електрофоретичною рухливістю, тому часто проводиться електрофорез ампліфікованих фрагментів у гелі (10.4.5.2). Водночас проводять електрофорез контрольних фрагментів ДНК. У гель додають бромистий етидій (барвник, який забарвлює ДНК). Фрагменти ДНК переміщаються на певну відстань. Ділянки гелю, в яких знаходяться фрагменти ДНК, даватимуть оранжеве світіння при ультрафіолетовому освітленні. Збіг смуг контрольного і дослідного фрагментів дозволить діагностувати наявність шуканого гена. Гель можна сфотографувати або його зображення перенести на екран комп’ютера (рис. 10.8).
Для ідентифікації ампліфікованих фрагментів можна використати методи секвенування, а також
метод алель-специфічних олігонуклеотидів. Він грунтується на гібридизації ампліфікованих фрагментів ДНК з міченими олігонуклеотидами, комплементарними нормальній або мутантній послідовності ДНК. Прикладом такого підходу є застосування ДНК-чіпів.
191
1 |
2 |
3 |
4 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
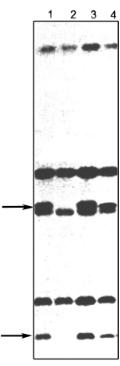
Рис. 10.8. Пряма ДНК-діагно- |
|
|
|
|
|
|
|
|
45 |
стика м’язової дистрофії Дюшен- |
|
|
|
|
|
|
|
|
на за допомогою мультиплекс- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ної полімеразної ланцюгової ре- |
|
|
|
|
|
|
19 |
акції. У кожної з обстежуваних |
||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
17 |
осіб одночасно ампліфіковано 4 |
|
|
|
|
|
|
|
екзони гена дистрофіну. Екзони |
|||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
17, 19, 44 і 45 відмічено стрілка- |
|
|
|
|
|
|
|
|
|
ми. Доріжка 1 — контроль, вид- |
|
|
|
|
|
|
|
|
|
но всі чотири екзони. Доріжки 2– |
|
|
|
|
|
|
|
|
|
5 — хворі на м’язову дистрофію |
|
|
|
|
|
|
|
|
|
Дюшенна з різними делеціями |
|
|
|
|
|
|
44 |
гена дистрофіну (доріжки 2 і 5 — |
||
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
делеція екзона 45, доріжка 3 — |
|
|
|
|
|
|
|
|
|
делеція екзона 44, доріжка 4 — |
|
|
|
|
|
|
|
|
|
делеція екзонів 17 і 19) |
10.4.4. МОДИФІКАЦІЇ ПЛР |
пліфікації або за характером температурних кри- |
|
|
вих етапу відпалу, які залежать від наявності або |
|
Існує велика кількість модифікацій методу |
відсутності шуканої ДНК-мішені. |
|
ПЛР, розроблених для швидкого сканування гено- |
Застосування ПЛР у реальному часі дозволяє |
|
му і пошуку відомих генних мутацій. |
значно заощадити час і скористатися перевагами |
|
Мультиплексна (мультипраймерна) ПЛР грун- |
«закритої системи», оскільки не потрібно відкри- |
|
тується на одночасній ампліфікації в одній реакції |
вати пробірки з реакційною сумішшю. Таким чи- |
|
кількох екзонів досліджуваного гена або кількох |
ном запобігають можливості контамінації про- |
|
фрагментів різних генів (див. рис. 10.8), що дозво- |
дуктів ампліфікації та виникнення хибнопозитив- |
|
ляє проводити експрес-скринінг найчастіших му- |
них результатів. Метод Real-time PCR особливо |
|
тацій у гені або виявляти водночас мутації в різних |
перспективний при діагностиці вірусних і бактері- |
|
генах. |
альних інфекцій. |
|
Алель-специфічна ампліфікація грунтується на |
|
|
використанні різних пар праймерів, один з яких є |
|
|
комплементарним нормальній, а другий — му- |
10.4.5. ІНШІ МЕТОДИ |
|
тантній послідовності ДНК. В результаті такої ре- |
||
ДНК-ДІАГНОСТИКИ |
||
акції в розчині синтезуються два різновиди ПЛР- |
||
продуктів — нормальні та мутантні, що розрізня- |
|
|
ються за своєю будовою. |
10.4.5.1. Використання рестрикційних |
|
Метод сайт-спрямованої модифікації ампліфі- |
||
ендонуклеаз |
||
кованої ДНК грунтується на використанні в ПЛР |
||
|
||
специфічного mismatch-праймера, відмінного від |
У різних методах молекулярної діагностики |
|
матричної послідовності на один нуклеотид. У ре- |
часто використовують ферменти — рестрикційні |
|
зультаті включення такого праймера до складу |
ендонуклеази (рестриктази). Вперше їх було |
|
мутантного ПЛР-продукту в ньому утворюється |
відкрито у бактерій. Ці ферменти in vivo беруть |
|
штучно створений сайт рестрикції для однієї з ре- |
участь у репарації ДНК, знищенні чужорідних |
|
стриктаз, що дозволяє провести ДНК-діагности- |
ДНК. Рестриктази впізнають специфічні послідов- |
|
ку за допомогою рестрикційного аналізу. |
ності з 4–6, рідше 8–12 нуклеотидів у дволанцюж- |
|
Існують спеціальні способи проведення ПЛР, |
ковій ДНК і розрізають її на фрагменти в місцях |
|
які дозволяють вивчати не тільки ДНК, але і РНК. |
локалізації цих послідовностей, які звуться сайта- |
|
Це важливо, наприклад, при дослідженні РНК- |
ми рестрикції. Кількість утворених рестрикційних |
|
вмісних вірусів (ретровіруси, зокрема ВІЛ, вірус |
фрагментів ДНК і їхня довжина визначаються ча- |
|
гепатиту С, грипу А та ін.), а також при аналізі |
стотою сайтів рестрикції та їх розташуванням у |
|
експресії різних генів в організмі. Подібні методи- |
ДНК. Чим частіше розташовані сайти рестрикції, |
|
ки зазвичай включають два етапи: зворотну транс- |
тим коротші фрагменти ДНК після рестрикції та |
|
крипцію та ПЛР на матриці одержаної ДНК. |
тим більша кількість фрагментів утворюється. |
|
ПЛР у реальному часі. Одним із перспективних |
Сьогодні відомо понад 500 різних типів ре- |
|
напрямів ДНК-технологій, що швидко розвива- |
стриктаз бактеріального походження. Вони на- |
|
ються, є ПЛР у реальному часі (Real-time PCR). |
зиваються за видом мікроорганізму, з якого ви- |
|
Цей метод не потребує електрофорезу продуктів |
ділені. Кожний із цих ферментів впізнає свою |
|
ампліфікації в агарозному або поліакриламідно- |
специфічну послідовність нуклеотидів. Кожна |
|
му гелі. Виявлення наявності або відсутності про- |
рестриктаза розрізає ДНК у строго визначених |
|
дуктів ампліфікації може здійснюватися двома |
місцях, де знаходяться специфічні сайти ре- |
|
шляхами: реєстрацією флуоресценції продуктів ам- |
стрикції (табл. 10.2). |
192