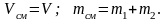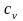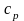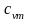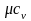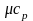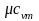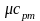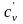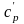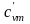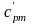- •Глава 1. Общие положения
- •1.1. Основные параметры состояния
- •1.2. Уравнение состояния идеального газа
- •1.3. Уравнения состояния реальных газов
- •Глава 2. Первый закон термодинамики
- •2.1. Виды энергии
- •2.2. Аналитическое выражение первого закона термодинамики
- •2.3. Теплоемкость газов
- •2.4. Энтальпия
- •2.5. Энтропия идеального газа
- •3.1. Круговые процессы или циклы
- •3.2. Общие свойства обратимых и необратимых циклов
- •3.3. Изменение энтропии в обратимых и необратимых процессах
- •3.4. Принцип возрастания энтропии
- •3.7. Эксергетический баланс и эксергетический кпд
- •6.1. Основные термодинамические процессы изменения состояния водяного пара
- •7.2. Циклы газотурбинных установок
- •8.1. Циклы воздушных холодильных установок
- •8.2. Циклы паровой компрессорной холодильной установки
2.3. Теплоемкость газов
При проектировании тепловой аппаратуры нужно знать количество теплоты, участвующей в процессах, протекающих в этих аппаратах. Для расчета этой теплоты была введена специальная физическая характеристика вещества – теплоемкость.
Истинная
теплоемкость – отношение элементарного
количества теплоты
 в термодинамическом процессе к бесконечно
малому изменению температуры
в термодинамическом процессе к бесконечно
малому изменению температуры
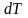 в
том же процессе:
в
том же процессе:
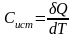 . (2.8)
. (2.8)
Для
конечного процесса 1-2 вводится понятие
средней теплоемкости как отношение
полного количества теплоты
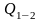 к изменению температуры:
к изменению температуры:
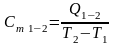 . (2.9)
. (2.9)
В практических расчетах количество теплоты можно рассчитать, если известна удельная теплоемкость вещества, участвующего в данном процессе.
Удельная
теплоемкость
это количество теплоты, которую нужно
подвести к единице количества вещества
для изменения его температуры на 1K
(10С).
Если в качестве единицы количества
вещества берется единица массы 1 кг,
теплоемкость называется массовой,
обозначается – c, единица измерения
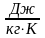 .
.
Если
берется единица объема 1 м3
при нормальных условиях, теплоемкость
называется объемной (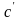 ),
ее единица измерения
),
ее единица измерения
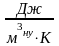
Если
берется единица количества вещества 1
моль, теплоемкость называется мольной,
обозначается µс, ее единица измерения
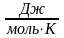 .
.
Соотношение между указанными теплоемкостями может быть выражено следующими зависимостями:
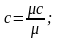
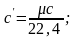
 ,
,
где ну – плотность газа при нормальных условиях.
Учитывая, что теплота является функцией процесса, можно предположить, что и теплоемкость также будет являться функцией процесса. Проанализируем ее поведение при некоторых частных случаях процессов. В качестве таковых при анализе чаще всего используются процессы, в которых остается постоянным один из основных параметров состояния: v, p и T.
Процесс
при v
= const
(изохорный):
 .
.
Используя
аналитическое выражение первого закона
термодинамики (2.5) применительно к
рассмативаемому изохорному процессу,
получим
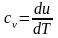 .
Тогда учитывая, что внутренняя энергия
является функцией состояния, получим
рабочую формулу для расчета изменения
внутренней энергии:
.
Тогда учитывая, что внутренняя энергия
является функцией состояния, получим
рабочую формулу для расчета изменения
внутренней энергии:
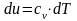 .
(2.10)
.
(2.10)
Процесс
при р = const
(изобарный):
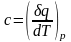 .
.
Используя
другое аналитическое выражение первого
закона термодинамики (2.7) применительно
к рассмативаемому изобарному процессу,
получим
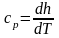 ,
тогда учитывая, что энтальпия является
функцией состояния, получим рабочую
формулу для расчета изменения энтальпии:
,
тогда учитывая, что энтальпия является
функцией состояния, получим рабочую
формулу для расчета изменения энтальпии:
Проведенный анализ частных случаев процессов подтверждает, что теплота является функцией процесса, то есть количество теплоты будет зависеть от характера изменения состояния рабочего тела.
Проанализируем
возможную связь между изохорной и
изобарной теплоемкостями. Для этого
запишем выражение (2.6) в дифференциальном
виде:
 .
.
Используя полученные выражения (2.10), (2.11) и (1.9), получим
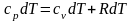 .
После преобазований получим выражения:
.
После преобазований получим выражения:
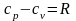 ,
(2.12)
,
(2.12)
Или
 ,
(2.12’)
,
(2.12’)
назывваемые уравнением Майера.
О
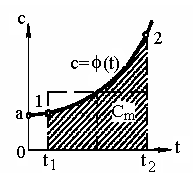
Рис. 2.4. График зависимости
теплоемкости от температуры
пыт и теоретические положения показывают, что теплоемкость газа зависит от температуры и давления: c = (p, t). При этом зависимость от температуры больше, чем от давления.Теплоемкость идеальных газов от давления не зависит: c = (t). Иногда влиянием давления пренебрегают и для реальных газов (но не всегда). Зависимость c = (t) показана на рис. 2.4. Так как теплоемкость зависит от параметров состояния, особенно от температуры, для определения истинной теплоемкости нужно взять отношение не конечных q и t, а бесконечно малых величин, то есть истинная теплоемкость записывается в виде
 .
(2.13)
.
(2.13)
Пользуясь формулой (2.13), можно определить количество теплоты q, подведенное к телу при изменении его температуры от t1 до t2:
 (2.14)
(2.14)
Для решения уравнения (2.14) нужно знать функцию с = f (t) для данного газа и произвести интегрирование в интервале от t1 до t2. Для упрощения расчетов воспользуемся понятием средней теплоемкости. Заштрихованная площадь 12t2t11 (рис. 2.4) описывается правой частью выражения (2.14) и соответствует количеству теплоты q.
Если
заменить эту площадь равновеликой
площадью прямоугольника высотой
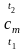 ,
то можно записать:
,
то можно записать:
 ,где
средняя теплоемкость в интервале
температур от t1
до t2.
,где
средняя теплоемкость в интервале
температур от t1
до t2.
Значением мы не располагаем, поэтому интеграл в уравнении (2.14) заменяем двумя интегралами:

что
равнозначно определению площади 12t2t11
как разницы между площадями а2t2оа
и а1t1оа.
Затем, заменив эти площади равновеликими
площадями прямоугольников с высотами
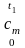 и
и
 ,
получаем
,
получаем
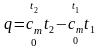 , (2.15)
, (2.15)
откуда для средней теплоемкости в интервале температур от t1 до t2 можно записать:
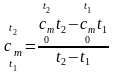 .
.
Значения средних теплоемкостей от 0 до температуры t представляются в виде таблиц термодинамических свойств веществ.
Определить теплоемкость методами термодинамики невозможно. Поэтому первоначально значение теплоемкости определяли только экспериментальным путем. Развитие науки о строении вещества позволило подойти к определению теплоемкости теоретически, используя методы молекулярно-кинетической теории и квантовой механики. Но пока эти методы не нашли широкого распространения либо из-за недостаточной точности полученных результатов, либо из-за сложности и трудоемкости.
Согласно
молекулярно-кинетической теории
теплоемкости энергия молекулы равномерно
распределяется по степеням свободы.
Для идеального газа
 ,
(2.16)
,
(2.16)
где n1 – число степеней свободы. Элементарная теория теплоемкости не учитывает энергию внутримолекулярных колебаний, а исходит только из рассмотрения поступательного и вращательного видов движения молекул. Согласно этой теории одноатомная молекула обладает тремя степенями свободы, двухатомная (и любой другой атомности линейная молекула) – пятью, а трех- и многоатомная нелинейная молекула – семью степенями свободы.
Ниже приведены результаты расчёта по формуле (2.16) теплоемкостей сv и cp газов, состоящих соответственно из одно-, двух- и трехатомных молекул:
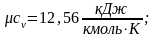
 ;
;
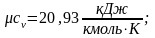
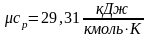 ;
;
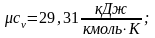
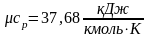 .
.
Результаты расчетов, полученные по формуле (2.16) для одноатомных газов, близки к действительным значениям.
Результаты для двухатомных газов существенно расходятся с действительными значениями (их можно использовать для ориентировочных расчетов).
Результаты для трехатомных газов нельзя применять даже для ориентировочных расчётов. Связано это с тем, что данная теория не учитывает энергию колебательного движения атомов внутри молекул и зависимость теплоемкости от температуры. Количество энергии, идущее на увеличение внутримолекулярных колебаний, и зависимость теплоемкости от температуры газа учитывает квантовая теория теплоемкости, согласно которой
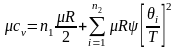 ,
где
,
где
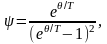 (здесь е
–основание натурального логарифма);
n2
– число колебательных степеней свободы;
(здесь е
–основание натурального логарифма);
n2
– число колебательных степеней свободы;
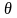 – характеристическая температура
колебательного движения:
– характеристическая температура
колебательного движения:
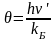 ,
,
где h – постоянная Планка; kБ – постоянная Больцмана; ν’ – частота колебания.
Важное значение в термодинамике имеет отношение сp/сv, обозначаемое как
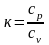 , (2.17)
, (2.17)
где к – показатель адиабаты. Величина к зависит от атомности газа и его значение можно определить, основываясь на рассмотренной выше молекулярно-кинетической теории. Если газ одноатомный, то к = 1,66, если газ двухатомный, то к = 1,40, если газ трехатомный, то к = 1,29. Показатель адиабаты также зависит и от температуры, но слабо, обычно принимают его для данного газа постоянным. Пользуясь этой величиной, можно из уравнения Майера получить некоторые часто применяемые зависимости.
Разделим
обе части уравнения на сv:
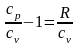 или
или
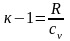 ,
,
откуда
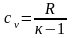 .
(2.18)
.
(2.18)
Умножив
обе части равенства (2.18) на
 ,
получим
,
получим
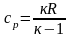 .
(2.19)
.
(2.19)
Рассмотренные ранее удельные теплоемкости в зависимости от характера процесса изменения состояния можно свести в таблицу.
Таблица теплоемкостей
Теплоемкость |
Истинная |
Средняя |
||
v=const |
p=const |
v=const |
p=const |
|
Массовая |
|
|
|
|
Мольная |
|
|
|
|
Объемная |
|
|
|
|
Таким образом, при проведении расчета теплоты важно установить, какую теплоемкость нужно использовать.
Пользуясь таблицами теплоемкостей отдельных газов, можно рассчитать теплоемкость газовых смесей.
Если смесь задана массовыми долями, массовая теплоемкость определяется из выражения
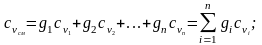 (2.20)
(2.20)
 (2.21)
(2.21)
Если смесь задана объемными долями, можно рассчитать объемную теплоемкость:
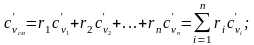 (2.22)
(2.22)
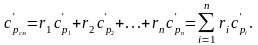 (2.23)
(2.23)
Молярная теплоемкость смеси газов равна сумме произведений объемных долей отдельных газов на их молярные теплоемкости:
 (2.24)
(2.24)
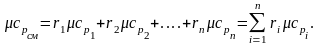 (2.25)
(2.25)
Все способы образования смесей можно разделить на три группы:
1) смешение газов при постоянном объеме;
2) смешение газовых потоков;
3) смешение газов при наполнении резервуара.
Смешение газов при постоянном объеме. Несколько газов с давлениями р1, р2, р3 и температурами T1, T2, T3 занимают объемы V1, V2, V3 (рис. 2.5). Если убрать перегородки, газы смешаются. Объем образовавшейся смеси будет Vсм = V1 + V2 + V3.
Масса смеси mсм = m1 + m2 + m3.
Предполагается, что при образовании смеси газы не совершают работу и отсутствует теплообмен с окружающей средой, то есть Q и L равны нулю. Тогда, согласно первому закону термодинамики, внутренняя энергия смеси равна сумме внутренних энергий отдельных газов до смешения:
Uсм = U1 + U2 + U3.
При сv = const
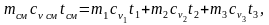
отсюда
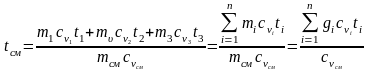 .
.
С учетом формулы (2.20) можно записать:
P1, T1 P2, T2 P3, T3
V1 V2 V3
Рис. 2.5. Смешение газов при постоянном объеме
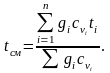 (2.26)
(2.26)
Из уравнения pсмVсм = mсмRсмTсм
вытекает
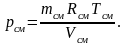 (2.27)
(2.27)
З
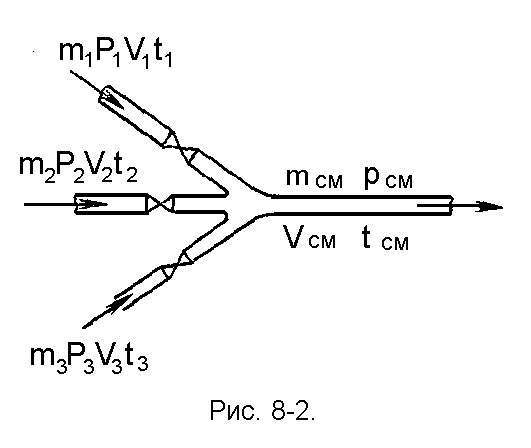
Рис. 2.6. Смешение газовых потоков
ная температуру, объем и давление, можно определить все остальные параметры смеси газов.Смешение газовых потоков (рис. 2.6). Смешение газов происходит в результате соединения нескольких потоков в одном канале. Считаем процесс адиабатным и протекающим без совершения работы. На основе первого закона термодинамики для потока полная энергия газового потока равна сумме полных энергий отдельных потоков:
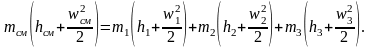
При малых скоростях потока кинетическая энергия потока мала по сравнению с энтальпией и ею можно пренебречь: mсмhсм=m1h1+m2h2+m3h3 или hсм=g1h1+g2h2+g3h3. Учитывая,
что h=cp t, запишем cpсмtсм = g1cp1t1 + g2cp2t2 + g3cp3t3;
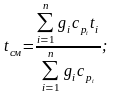 (2.28)
(2.28)
Далее
из характеристического уравнения

Смешение газов при наполнении резервуара (рис. 2.7). В резервуар объемом V, содержащий газ массой m1 (кг) с параметрами p1,T1, по трубопроводу поступает газ массой m2 (кг) и с параметрами p2,T2. Внутренняя энергия смеси идеальных газов равна сумме внутренних энергий газов, составляющих смесь:
mсмuсм = m1u1 + m2u2,
считая сv=const, получим
p1, T1, m1
V
p2, T2, m2
p2, T2, m2


Рис. 2.7. Смешение газов при наполнении резервуара
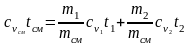
Или
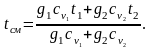 (2.29)
(2.29)
Из характеристического уравнения
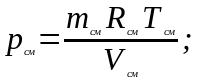 (2.30)
(2.30)