
2.4. Энтальпия
В XIX столетии американский физик Гиббс ввел в термодинамику сложную функцию вида
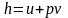 ,
, (2.31)
,
, (2.31)
которая была названа удельной энтальпией.
Энтальпия
является функцией состояния, её величина
определяется состоянием тела, поэтому
изменение энтальпии h
определяется только начальным и конечным
состояниями тела. Таким образом, энтальпия
это параметр состояния, а её дифференциал
является полным дифференциалом. Энтальпия
произвольного количества вещества
массой m:
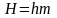 ,
Дж.
,
Дж.
Из
выражения (2.31) следует
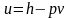 .
.
Подставив
это выражение в уравнение первого закона
термодинамики (2.5), получим
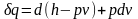 ,
,
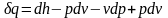 ,
,
. (2.32)
Формула (2.32) − еще одно аналитическое выражение первого закона термодинамики.
При p =const vdp = 0, qp = dh. В то же время qp = cpdT
см.
уравнение (2.32). Следовательно,
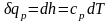 .
.
Проинтегрировав выражение cpdT = dh
от 0 до t и условно приняв, что при нормальных условиях (t = 0оС, p = 760 мм рт. ст.), hо = 0, получим
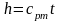 .
(2.33)
.
(2.33)
Удельная энтальпия численно равна количеству теплоты, которую нужно подвести к 1 кг вещества для нагревания его от нуля до заданной температуры при постоянном давлении. Из выражения qp = dh = cpdt
после
интегрирования получим
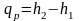 , (2.34)
, (2.34)
или
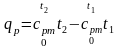 .
(2.35)
.
(2.35)
Следовательно,
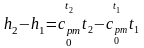 .
(2.36)
.
(2.36)
Формулой (2.34) удобно пользоваться в теплотехнических расчётах, так как значения энтальпии, как и теплоемкостей, даны в таблицах термодинамических свойств веществ.
2.5. Энтропия идеального газа
Кроме удельной внутренней энергии и энтальпии в термодинамике существует еще одна функция состояния, которая называется удельной энтропией. Ее обозначают символом s, единица измерения . Энтропия произвольного количества вещества массой m: S = sm, Дж/К. (2.37)
Дифференциал удельной энтропии является полным дифференциалом и определяется из выражения
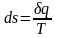 , (2.38)
, (2.38)
где
q
функция процесса: q
– неполный дифференциал. Умножив q
на интегрирующий множитель 1/Т, получим
полный дифференциал ds. Из формулы (2.38)
следует
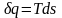 (2.39)
(2.39)
или
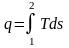 .
(2.40)
.
(2.40)
Сравнивая формулу (2.39) с аналитическим выражением работы изменения объема l = p·dv
– см. уравнение (2.1), видим, что для передачи энергии в форме деформационной работы нужна разность давлений, для передачи энергии в форме теплоты нужна разность температур, что деформационная работа совершается только при изменении удельного объема, теплота подводится (отводится) только при изменении энтропии. Можно также сказать, что энтропия в равновесных процессах изменяется только в результате подвода (отвода) теплоты.
Следовательно, энтропия – физическая величина, изменение которой является признаком обмена энергией в форме теплоты в равновесных процессах.
Значение
энтропии для заданного состояния
определяется интегрированием выражения
(2.38):
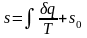 ,
где so
– константа интегрирования, которая
не может быть определена с помощью
первого и второго законов термодинамики.
,
где so
– константа интегрирования, которая
не может быть определена с помощью
первого и второго законов термодинамики.
Однако в технической термодинамике обычно используется не абсолютное значение энтропии, а ее изменение в каком-либо процессе:
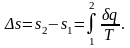
В любом процессе идеального газа du = cvdT,
А q = Tds.
Подставим
эти выражения в уравнение первого закона
термодинамики (2.31):
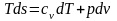
или
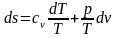 .
Из уравнения
.
Из уравнения
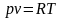 следует, что
следует, что
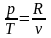 .
.
Тогда
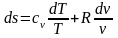 .
.
После
интегрирования получается:
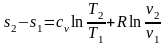 . (2.41)
. (2.41)
Чтобы выразить изменение энтропии через другие параметры состояния, запишем отношение уравнений Клапейрона для состояний 2 и 1:
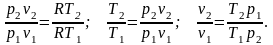
Подставив
в уравнение (2.41) отношение
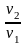 ,
а затем
,
а затем
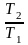 ,
получим
,
получим
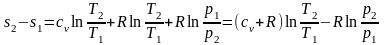 ;
;
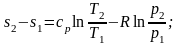 (2.42)
(2.42)
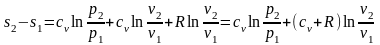 ;
;
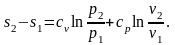 (2.43)
(2.43)
Зависимости
(2.41)–(2.43) показывают, что изменение
энтропии идеального газа зависит от
параметров начального и конечного
состояний и не зависит от процесса.
Поэтому
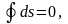 то есть энтропия является параметром
состояния, позволяющим исследовать
процессы преобразования энергии.
то есть энтропия является параметром
состояния, позволяющим исследовать
процессы преобразования энергии.
Из выражения (2.39) следует:
- если ds > 0, то и q > 0 (теплота подводится);
- если ds < 0, то и q < 0 (теплота отводится).
Т
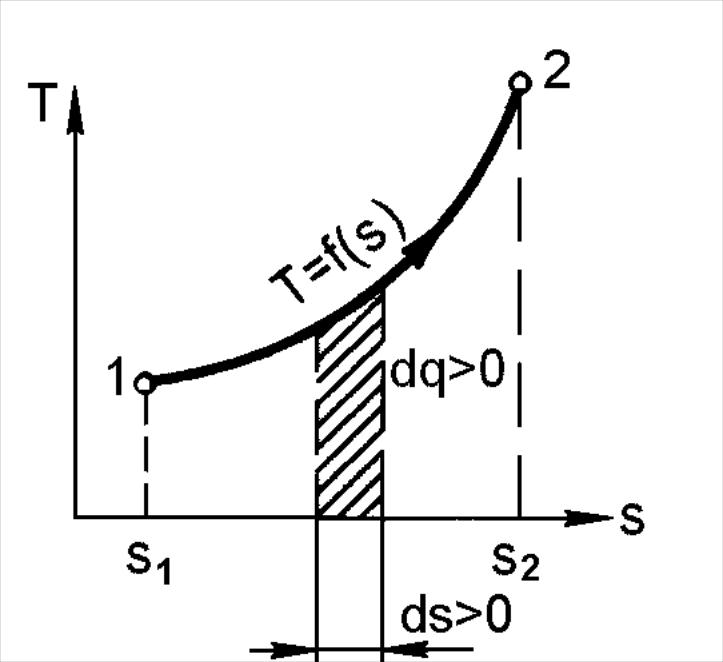
Рис. 2.8. Ts-диаграмма
идеального газа
аким образом, по изменению энтропии в обратимом процессе можно судить о направлении теплового потока между рабочим телом и окружающей средой. Ни один из ранее рассмотренных параметров состояния такой возможности не давал. Особенно важным является возможность использования энтропии при исследовании процессов с помощью диаграммы Ts.В Ts-диаграмме так же, как и в pv-диаграмме, равновесное состояние термодинамической системы (рабочего тела) изображается точкой, а равновесный термодинамический процесс – линией (рис. 2.8).
В равновесном процессе q= Tds,
а
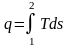 – см. уравнения (2.38) и (2.40).
– см. уравнения (2.38) и (2.40).
Следовательно,
площадь, ограниченная линией процесса
![]() ,
крайними ординатами
,
крайними ординатами
 и
и
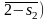 ,
отрезком оси абсцисс
,
отрезком оси абсцисс
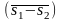 ,
описывается выражением
,
описывается выражением
.
Поэтому Ts-диаграмма называется тепловой или энтропийной диаграммой.
Из изложенного видно, что теплота, как и работа, не является параметром состояния. Теплота, как уже отмечалось, является функцией процесса. Количество подведенной (отведенной) теплоты зависит от характера процесса, так как между заданными точками 1 и 2 можно провести разнообразные кривые (процессы), и площадь под этими процессами, а следовательно, и теплота q1-2, будут иметь различные значения.
С помощью Ts-диаграммы можно определить не только теплоту, но и по характеру процесса на этой диаграмме знак теплоты. Знаки элементарного количества теплоты и приращения энтропии совпадают. Следовательно, если ds > 0 (рис. 2.8), теплота подводится независимо от того, увеличивается или уменьшается температура.
Если же удельная энтропия уменьшается, то есть ds < 0, теплота отводится также, независимо от знака изменения температуры. Признаком подвода теплоты может служить только рост удельной энтропии, а признаком отвода – её уменьшение.
