
2.2. Аналитическое выражение первого закона термодинамики
Пусть
в цилиндре с поршнем находится 1 кг
газа. Подведем к нему элементарное
количество теплоты q.
В результате увеличения скорости
движения молекул увеличится кинетическая
энергия их поступательного движения,
что повлечет за собой возрастание числа
и силы ударов молекул о стенки сосуда
и перемещение поршня, который пройдет
путь ds, совершая элементарную работу
l.
Вследствие изменения объема газа
изменится среднее расстояние между
молекулами, это приведет к изменению
потенциальной энергии сил взаимодействия.
Таким образом, при подводе теплоты
совершается работа и изменяются все
составляющие внутренней энергии. Отсюда
аналитическое выражение первого закона
термодинамики или выражение для
выполнения расчетов:
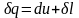 . (2.3)
. (2.3)
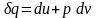 .
(2.4)
.
(2.4)
Если к одному килограмму газа подвести конечное количество
теплоты
q, то аналитическое выражение первого
закона термодинамики запишется следующим
образом:
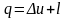 .
(2.5)
.
(2.5)
Формулы (2.3) – (2.5) показывают, что теплота, подведенная к рабочему телу, затрачивается на изменение его внутренней энергии и на совершение работы.
Американский
физик Гиббс ввел в термодинамику сложную
функцию вида
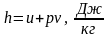 ,
(2.6)
,
(2.6)
которую назвали энтальпией.
Основываясь на этой величине им было получено другое аналитическое выражение первого закона термодинамики:
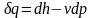 .
(2.7)
.
(2.7)
Во второй половине XVIII века была создана паровая машина, которая превращала тепловую энергию сгоревшего топлива в механическую. Изобретение паровой машины и наблюдение за различными процессами, связанными с выделением теплоты (трение, сверление стволов пушек), привлекли внимание ученых к тепловым явлениям и связи теплоты с механической энергией. Возник вопрос о природе теплоты. Тогда же, в XVIII веке, появилась теория теплорода. Теплоту рассматривали как особое невесомое, неуничтожаемое и несоздаваемое вещество – теплород. Поэтому законы превращения энергии освещались неправильно. В дальнейшем теория теплорода была заменена корпускулярной теорией, согласно которой теплота представляла собой только энергию вращательного движения корпускул (молекул).
Развивающаяся кинетическая теория вещества дала возможность объяснить закон сохранения и превращения энергии как переход одной формы движения в другую. Например, механическая энергия – это энергия движения больших тел (макротел), тепловая энергия − энергия неупорядоченного движения молекул (микротел). Переход теплоты в работу представляет собой переход энергии неупорядоченно движущихся молекул (микротел) в энергию движения больших тел (макротел).
Первый закон термодинамики является частным случаем всеобщего закона сохранения и превращения энергии применительно к тепловым и механическим явлениям. Его можно сформулировать следующим образом: во всех тех случаях, когда исчезает некоторое количество тепловой энергии, возникает вполне определенное количество механической энергии, и, наоборот, при совершении какой-либо работы появляется вполне определенное количество тепловой энергии: Q = L,
где Q – исчезнувшее количество тепловой энергии; L – работа, совершенная за счёт возникшей механической энергии (Q и L в одних и тех же единицах измерения энергии). Эта форма записи не означает, что вся теплота превращается в работу или что вся работа превращается в теплоту; она показывает эквивалентность теплоты и работы.
Существуют различные формулировки первого закона термодинамики:
1) невозможно ни возникновение, ни исчезновение энергии;
2) невозможно построить вечный двигатель первого рода, то есть двигатель, который совершает работу, не потребляя энергии (производит механическую энергию из ничего);
3) любая форма движения способна и вынуждена при определенных для каждого случая условиях превращаться, прямо или косвенно, в любую другую форму движения.
Аналитическое выражение первого закона
термодинамики для потока
В предыдущих главах рассматривались газы и пары, находящиеся в неподвижном состоянии (закрытые системы). Однако имеется достаточно много машин и аппаратов, в которых газ перемещается например, паровые и газовые турбины, ракетные двигатели и другие (открытые системы).
Для
1 кг газа без внутренних источников
работы, движущегося в неподвижном
канале, уравнение первого закона
термодинамики можно записать в виде
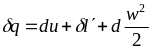 ,
(5.1)
,
(5.1)
где
l
работа против внешних сил (работа
проталкивания газа по каналу);
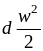
изменение внешней кинетической энергии
1 кг газа в потоке
располагаемая работа.
изменение внешней кинетической энергии
1 кг газа в потоке
располагаемая работа.
Если поток совершает полезную техническую работу lт, уравнение первого закона термодинамики будет иметь вид
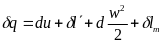 .
(5.2)
.
(5.2)
В
этом случае располагаемая работа
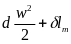 .
Последнее уравнение справедливо как
для обратимых, так и для необратимых
процессов.
.
Последнее уравнение справедливо как
для обратимых, так и для необратимых
процессов.
