
Лекция ЗО Титриметрия+Нейтрализация
.pdfЛекция Тема: ТИТРИМЕТРИЯ
ПЛАН
1.Сущность титриметрического метода, основные понятия.
2.Классификация титриметрических методов.
3.Приготовление и стандартизация растворов титрантов. Методы пипетирования и отдельных навесок.
4.Ошибки анализа.
5.Контрольные вопросы.
1. Сущность титриметрического метода, основные понятия
Титриметрический (объемный) анализ — один из разделов количественного анализа, основанный на точном измерении объема раствора реагента (титранта), вступившего в химическую реакцию с определяемым веществом. Концентрация раствора реагента должна быть точно известна.
Раствор реагента (титранта) с точно известной концентрацией называют
стандартным, или титрованным рабочим раствором.
Наиболее важной операцией титриметрического анализа является титрование — процесс постепенного прибавления титрованного рабочего раствора к определяемому веществу. Титрование продолжают до тех пор, пока количество титранта не станет эквивалентным количеству реагирующего с ним определяемого вещества.
Момент титрования, когда титрант добавлен в количестве, эквивалентном определяемому веществу, называется точкой эквивалентности (т.э.).
Следует отметить, что на практике часто определяют не точку эквивалентности, а конечную точку титрования (к.т.т.). Эти точки часто не совпадают, но близки. Конечную точку титрования можно определять по изменению окраски раствора, по изменению физико-химических свойств титруемого раствора или же при помощи индикатора.
Чаще всего для ее определения вводят индикатор («свидетель») — вспомогательное вещество. Его действие сводится к тому, что по окончании реакции между титруемым веществом и титрантом в присутствии небольшого избытка титранта индикатор претерпевает изменения (строение или физические свойства), которые заметны визуально (меняет окраску раствора или осадка, образует осадок).
С помощью индикаторов можно установить конечную точку титрования (к.т.т.) – момент титрования, когда наблюдается изменение цвета индикатора. В идеальном случае т.э. и к.т.т. совпадают, однако в практических условиях между ними наблюдается некоторая разница. Чем больше эта разница, тем больше погрешность титрования при прочих равных условиях, поэтому следует подбирать такой индикатор, чтобы разность между т.э. и к.т.т. была минимальной.
В ряде случаев при титровании можно обходиться без индикаторов (безындикаторное титрование). Например, конечную точку титрования в перманганатометрии устанавливают в результате окрашивания, которое возникает
при добавлении лишней капли окрашенного раствора |
титранта KMnO4 |
(безындикаторный метод). |
|
Титриметрический метод имеет ряд достоинств: |
|
- высокая скорость и точность анализа, погрешность не превышает |
0,1%; |
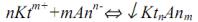
-применимость для определения различных количеств веществ;
-в одном и том же растворе часто можно определять одновременно несколько веществ;
-возможность автоматизировать титрование.
Втитриметрии применяются реакции, удовлетворяющие следующим требованиям: -реакция должна быть стехиометрична и протекать строго по заданному уравнению;
-количественно (Кр=1 ), в заданном направлении, практически до конца, с достаточно высокой скоростью и желательно при комнатной температуре; -побочные реакции и посторонние вещества не должны осложнять основную реакции;
-должна четко фиксироваться точка эквивалентности визуально с помощью индикаторов или с помощью приборов.
Правила титрования
1.Следует устанавливать титр стандартного раствора и применять один и тот же раствор в присутствии одного и того же индикатора.
2.Для титрования следует брать всегда одно и тоже количество индикатора и повторять титрование определяемого вещества несколько раз до тех пор, пока не будут получены близко сходящиеся результаты, совпадающие между собой в пределах 0,2-0,3%.
3.Необходимо брать, как правило, не более 1-2 капель индикатора, не забывая о том, что индикаторы, применяемые в методе нейтрализации, сами являются кислотами или основаниями. На их нейтрализацию также расходуется часть раствора титранта.
4.Всегда следует титровать до одного и того же оттенка окраски раствора, используя для титрования по возможности одинаковые объемы титруемого раствора.
5.Необходимо выбирать такой индикатор, который изменяет свой цвет вблизи точки эквивалентности.
2. Классификация титриметрических методов
Классификация по типу реакций:
I. Методы, основанные на реакциях, протекающих без изменения степени окисления:
а) методы кислотно-основного (перенос протонов) титрования. В их основе лежит реакция нейтрализации: Н3О+ + ОН- = 2Н2О; б) методы осадительного титрования, основанные на образовании труднорастворимых
веществ в процессе титрования: |
; |
|
|
|
||
в) |
методы |
комплексиметрического |
титрования |
основаны |
на |
реакциях |
комплексонообразования как с неорганическими, так и |
с органическими |
лигандами, |
||||
например, с комплексонами (комплексометрия):  ;
;
II. Методы, основанные на реакциях окисления - восстановления (перенос электронов):
 . Каждый метод получает название по стандартному раствору: перманганатометрия (титрант - раствор KMnO4);
. Каждый метод получает название по стандартному раствору: перманганатометрия (титрант - раствор KMnO4);
дихроматометрия (титрант - раствор К2Сr2О7); йодометрия (титрант раствор I2) и т.д.
Такие методы называют еше редокс-методами и их достаточно много. Классификация титриметрических методов по приемам титрования:
1.Прямое титрование. В этом случае определяемое вещество непосредственно титруют раствором реагента или наоборот.
Расчет концентрации или массы определяемого вещества рассчитывают по закону эквивалентов- вещества реагируют строго в эквивалентных соотношениях:
. Зная, что количество моль-эквивалента рассчитывается по формулам:

= |
и |
= |
применим данные формулы к закону эквивалентов- вещества реагируют в объемах обратно пропорционально их нормальным концентрациям:
|
|
= |
|
, откуда |
= |
|
|
|
|
|
|
|
|
|
|
||||
2.Обратное титрование (титрование по остатку). |
К |
анализируемому |
раствору |
||||||
приливают избыток стандартного раствора (точно измеренный объем и точно известной концентрацией), избыток (остаток) не вступившего в реакцию, которого оттитровывают другим стандартным раствором (титрантом).
=
3.Способ замещения (косвенное). Используют в случаях определения неустойчивых веществ или невозможности зафиксировать точку эквивалентности при прямом титровании. К анализируемому веществу добавляют избыток специального реагента, который вступает в реакцию с анализируемым веществом. Один из продуктов взаимодействия, количество которого эквивалентно количеству определяемого вещества, оттитровывают стандартным раствором (титрантом). Расчеты производят по формулам прямого титрования.
2. Приготовление и стандартизация растворов титрантов. Методы пипетирования и
отдельных навесок
В титриметрическом методе анализа используют растворы с точно известной концентрацией - стандартными. Различают первичные и вторичные стандарты.
Первичным стандартом называют стандартным раствор, приготовленный по точной навеске. Реагент (исходное, установочное вещество) для приготовления первичного стандарта должен удовлетворять ряду требований:
1)вещество должно быть химически чистым (массовая доля примесей не выше
0,05%);
2)состав вещества должен точно соответствовать формуле;
3)вещество должно быть устойчивым при хранении;
4)вещество должно иметь по возможности большую молярную массу эквивалента, чтобы уменьшить погрешность при взвешивании.
Первичные стандарты используют как для обычных титриметрических определений, так и для установления точной концентрации растворов вторичных стандартов.
Вторичным стандартом (или установленным раствором) называют стандартный раствор, концентрация которого установлена по первичному стандарту.
Процесс определения точной концентрации вторичного стандартного раствора титрованием по первичному стандартному раствору называется стандартизацией раствора.
Способы приготовления титрованных растворов
1.Приготовление титрованного раствора по точной навеске стандартного вещества. Рассчитанную массу навески стандартного вещества для приготовления раствора заданной концентрации (первичного стандарта или титранта) взвешивают на аналитических весах на часовом стекле (или в бюксе, стакане) с точностью до
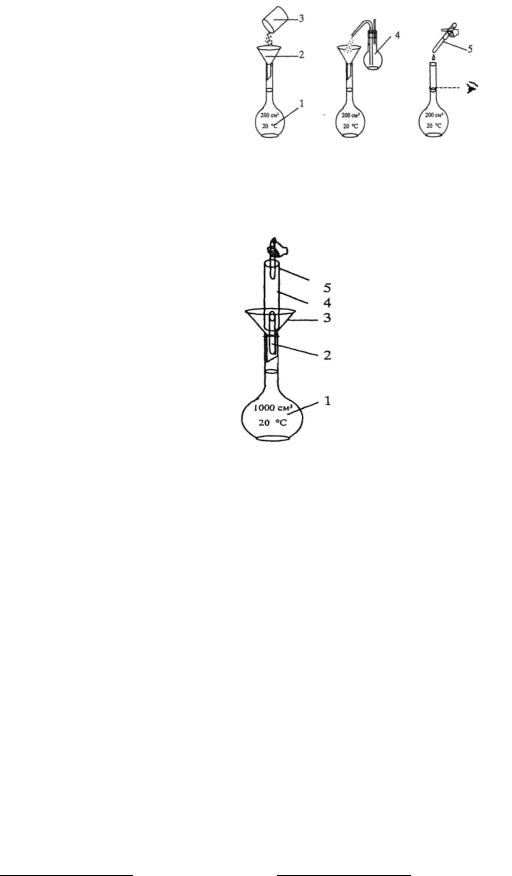
0,0001 г, переносят количественно (полностью) в |
|
|||||||||
чистую мерную колбу заданной вместимости, |
|
|||||||||
растворяют и1) доводят до метки дистиллированной |
|
|||||||||
водой (рис. 1). |
|
|
|
|
|
|
|
|||
2. Приготовление титрованного раствора из |
|
|||||||||
фиксанала. |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 1. Приготовление стандартного |
||
Для |
приготовления титрантов |
и |
растворов |
|
||||||
стандартов |
|
применяют |
также |
специальные |
|
раствора |
||||
|
|
1-мерная колба; 2-воронка; 3- стаканчик или |
||||||||
стандарт-титры – фиксаналы. |
|
|
|
|
||||||
|
|
|
|
бюкс с навеской; 4- промывалка с |
||||||
Фиксанал |
– раствор |
или сухое |
вещество, |
|
дистиллированной водой; 5- капельная |
|||||
|
пипетка |
|||||||||
помещенный |
в |
герметичную |
ампулу |
заводского |
|
|||||
|
|
|||||||||
|
Рис. 2. |
|||||||||
производства, |
|
содержащий |
строго |
определенное |
||||||
|
Приготовление |
|||||||||
(обычно 0,1 моль-экв) количество химического |
||||||||||
раствора из |
||||||||||
соединения. |
Содержимое |
ампулы |
количественно |
фиксанала |
||||||
переносят |
в |
мерную колбу |
заданного объема, |
1-мерная колба; |
||||||
2-нижний боек; |
||||||||||
разбивая ампулу о вложенный в воронку боек (рис |
||||||||||
3- воронка; |
||||||||||
2). Вторым бойком разбивают верхнее углубление |
||||||||||
4- фиксанал; |
||||||||||
ампулы, с помощью промывалки через отверстие |
5- верхний боек |
|||||||||
тщательно промывают ампулу. Для промывки |
|
|||||||||
рекомендуется не менее, чем 6-кратный объем воды |
|
|||||||||
(по сравнению с вместимостью ампулы). Воронку также многократно ополаскивают водой и удаляют из колбы. Полученный раствор доводят до метки дистиллированной водой и перемешивают. Из фиксанала готовят как стандартные так и рабочие растворы. Это быстрый и достаточно точный способ приготовления титрованных растворов.
3. Приготовление рабочего раствора по неточной навеске (NaOH, KOH) или разбавление более концентрированного раствора (HCl, , HN ).
При этом нет необходимости рассчитывать точную навеску вещества, так как при всей тщательности взвешивания из таких веществ нельзя получить раствор точной концентрации. Поэтому для приготовления рабочих растворов навеску взвешивают на технических весах и применяют неточную мерную посуду. Для стандартизации рабочего раствора его титруют стандартным раствором. Такие растворы называют
стандартизированными или с установленным титром (вторичными стандартами).
Титриметрические определения могут быть выполнены двумя способами:
1. способом отдельных навесок, при котором берут несколько (2-3) близких по величине навесок анализируемого (или стандартного) вещества, помещают каждую в отдельную колбу для титрования, растворяют в произвольном объеме дистиллированной воды и полученные растворы титруют. Массу и процентную концентрацию вступившего вещества для каждой навески рассчитывают по закону
эквивалентов. = (г); = (%).
2. способом пипетирования – навеску анализируемого (или стандартного) вещества помещают в мерную колбу ( , растворяют в дистиллированной воде, доводят раствор до метки и тщательно перемешивают, закрыв колбу пробкой; затем отбирают пипеткой аликвотную часть ( или приготовленного раствора и титруют не менее трех раз. Если расхождение между параллелями не превышает 0,2-0,3% берут среднее арифметическое и рассчитывают по закону эквивалентов нормальную концентрацию или массу по формулам:
= |
|
∙ |
|
(г). |
|
|
Способ отдельных навесок характеризуется более высокой точностью, так как измерение объема производится только один раз по бюретке, но многократные этапы взвешивания увеличивают длительность анализа. Способ пипетирования, несмотря на несколько меньшую точность (трехкратного измерения объема, наличие этапа разбавления и т.д.) характеризуется быстротой и удобством определения.
4. Ошибки анализа
1.Ошибки взвешивания и отмеривания. Применяемые в анализе аналитические весы и мерные приборы обычно имеют погрешности. Например, аналитические весы обычно
имеют точность до 4-го знака после запятой, мерные приборы (пипетки, бюретки) – до 0,02- 0,03 см3. Для повышения точности на аналитических весах не рекомендуется брать навеску
меньше 0,1000 г. При работе на бюретках объемы отмериваемых растворов должны быть не менее 20 см3.
2.К ошибкам измерения относится также капельная ошибка. При титровании из бюретки минимальная порция раствора равна 1 капле. Объем капли обычно равен 0,02-0,03 см3,
поэтому при титровании возникает так называемая капельная ошибка. Для ее уменьшения необходимо расходовать на титрование 20-25 см3 титранта, оттягивать кончик бюретки для уменьшения объема капли.
3.Химические ошибки вызваны различными химическими причинами. Например, индикаторы точки эквивалентности могут изменять свою окраску не в этой точке. Это вызывает появление индикаторной ошибки, так как раствор определяемого вещества перетитровывается или недотитровывается титрантом. Для устранения индикаторной ошибки необходимо применять индикаторы, дающие переход окраски в области, близкой к точке эквивалентности. При титровании слабых кислот и оснований возникают ошибки, вызываемые малой ионизацией кислоты или основания и неполным протеканием кислотно-основной реакции. Для уменьшения ошибок титрование проводят не менее трех раз и используют так называемый контрольный опыт, который осуществляют в одинаковых условиях (реагенты, индикатор), но без определяемого вещества. Объем титранта, израсходованный на титрование контрольной пробы до изменения окраски индикатора, потом вычитают из результатов анализа. Уменьшения ошибок можно добиться, аккуратно выполняя процесс титрования. Последние порции титранта добавляют по каплям, чтобы не перетитровывать анализируемый раствор.
4.Систематические и случайные ошибки.
Систематические ошибки возникают постоянно из-за неправильности аналитических весов, мерной посуды, аналитических приборов. Для устранения систематических ошибок необходимы проверка весов, калибровка мерной посуды и других измерителей.
Случайные ошибки возникают вследствие различных причин: добавлена лишняя капля титранта, неточно взята навеска вещества. Устраняют случайные ошибки, проводя не менее трех параллельных анализов. Средний результат трех, параллельных определений в большей или меньшей мере свободен от случайных ошибок.
5. Абсолютные и относительные ошибки. Абсолютные ошибки выражают в абсолютных цифрах, относительные – в процентах от результата анализа.
5. Контрольные вопросы
1.Сущность титриметрического метода анализа. Классификация титриметрических методов (с примерами).
2.Перечислите требования к титриметрическим реакциям.
3.Дайте определения следующим способам выражения концентрации растворов: титр, титр по определяемому веществу, нормальность, молярность, массовая доля вещества в растворе. Их размерность. Как можно перейти от одной концентрации к другой (приведите формулы)?
4.Дайте определение химического эквивалента и фактора эквивалентности вещества.
5.Что такое стандартный (рабочий, титрованный) раствор.
6.Понятие первичного стандарта и вторичного, привести примеры.
7.Что такое установочные вещества и какие требования к ним предъявляются?
8.Какие рабочие растворы называются приготовленными, а какие – установленными?
9.Какие существуют способы титрования? Дайте определение каждому способу, объясните их сущность и приведите примеры.
10.Перечислите основные правила титрования.
11.Какие могут иметь место ошибки в титриметрическом методе анализа.
12.В чем отличия между точкой эквивалентности (т.э.) и конечной точкой титрования
(к.т.т.)?
13.Опишите технику основных способов приготовления титрованных растворов. 14. В чем сущность способов пипетирования и отдельных навесок?
Лекция Тема: МЕТОД КИСЛОТНО-ОСНОВНОГО ТИТРОВАНИЯ
(НЕЙТРАЛИЗАЦИИ, ПРОТОЛИТОМЕТРИИ) ПЛАН
1.Сущность кислотно-основного титрования, классификация метода.
2.Индикаторы метода нейтрализации, теории индикаторов.
3.Применение метода нейтрализации.
4.Контрольные вопросы.
1. Сущность кислотно-основного титрования, классификация метода
Кислотно-основное титрование – это метод определения кислот, оснований, солей, основанный на реакции взаимодействия между протолитами (протолитометрия)
– кислотой НА и основанием В: НА + В = А- + НВ+
В водных растворах – это реакция нейтрализации: Н3О+ + ОН- = 2Н2О.
Поэтому метод кислотно-основного титрования также называют методом
нейтрализации.
Реакция кислотно-основного взаимодействия:
-протекает быстро,
-практически необратима,
-протекает строго стехиометрично,
т.е. удовлетворяет требованиям, предъявляемым к реакциям, применяемым в титриметрическом анализе.
Титрантами метода являются растворы сильных кислот и оснований: HCl, H2SO4, NaOH, KOH. Эти вещества не соответствуют требованиям, предъявляемым к

стандартным веществам, поэтому концентрацию титрантов устанавливают стандартизацией их растворов.
Взависимости от природы титранта метод нейтрализации подразделяется на:
-ацидометрическое титрование (от латинского слова "acid") - титрант кислота –
НС1 или Н2SO4), определяют основания и соли, гидролизующиеся по аниону. В качестве первичных стандартов чаще используют гексагидрат тетрабората натрия Na2B4O7·10H2O, безводный карбонат натрия Na2CO3;
-алкалиметрическое титрование (от латинского слова "alkaly") -титрант щелочь –
NaOH или Ba(OH)2), определяют кислоты и соли, гидролизующиеся по катиону. Первичным стандартом выступаютдигидрат щавелевой кислоты H2C2O4·2H2O,
янтарная кислота |
и др. |
2. Индикаторы метода нейтрализации, теории индикаторов
Растворы кислот и оснований, как правило, бесцветны, и реакции между ними не сопровождаются какими-то заметными внешними эффектами. Точка эквивалентности
вкислотно-основном титровании определяется по изменению рН раствора. Поэтому для определения характера среды и для приблизительной оценки рН используют кислотно-основные индикаторы – органические красители, структура и окраска которых зависит от величины водородного показателя рН.
Молекулярная и ионная формы индикаторов имеют различную окраску. Кроме того, изменение окраски связано с таутомерией молекул индикатора.
Существуют одноцветные индикаторы, бесцветные в кислой среде и окрашенные
вщелочной (например, фенолфталеин), и двухцветные (например, метиловый оранжевый), характеризующиеся различной окраской в кислых и щелочных растворах (табл. 1).
Таблица 1. Некоторые кислотно-основные индикаторы
Индикатор |
рН |
РТ |
Изменение окраски |
Окраска в точке экви- |
|
|
|
|
валентности |
|
|
|
|
|
Метиловый фиолетовый |
0-1,8 |
1,2 |
Желтая-фиолетовая |
Зеленая |
Тимоловый синий |
1,2-2,8 |
2,0 |
Красная-желтая |
Оранжевая |
Метиловый оранжевый |
3,1-4,4 |
4,0 |
Красная-желтая |
Оранжевая |
Бромкрезоловый зеленый |
3,9-5,4 |
4,5 |
Желтая-синяя |
Зеленая |
Метиловый красный |
4,4-6,2 |
5,5 |
Красная-желтая |
Оранжевая |
Бромтимоловый синий |
6,0-7,6 |
7,0 |
Желтая-синяя |
Зеленая |
Тимоловый синий |
8,0-9,6 |
9,2 |
Желтая -красная |
Оранжевая |
Фенолфталеин |
8,2-9,8 |
9,0 |
Бесцветная-красная |
Розовая |
Тимолфталеин |
9,3- |
9,6 |
Бесцветная-синяя |
Голубая |
|
10,5 |
|
|
|
Каждый индикатор характеризуется интервалом перехода окраски ( рН) - интервалом значений рН, внутри которого индикатор изменяет окраску, за его пределами преобладает одна из форм индикатора.
Рассмотрим равновесие в растворе кислотного индикатора:
HInd (бесцветная форма) ↔ |
+ In (окрашенная форма) |
||
= |
|
выразим концентрацию : |
|
|
|||

Установлено, что человеческий глаз способен замечать резкое изменение цвета в растворе если соотношение концентраций молекулярной (окрашенной) формы и ионной
(бесцветной) формы будет равно:
т.к. отрицательный логарифм константы ионизации – это силовой показатель
–lg K= рК , |
рН= рКlg |
|
= рК+1; рН= рКlg |
|
= рК-1 , то соответственно |
|
|
интервал перехода окраски (ΔрН) рассчитывают по формуле:
ΔpH = pKi ± 1,
где Ki - константа ионизации индикатора.
Интервал перехода окраски зависит от природы индикатора и его свойств. Чем меньше интервал перехода окраски, тем ценнее индикатор. Значение рН, при котором заканчивается титрование в присутствии данного индикатора, называется показателем титрования (рТ). Изменение окраски происходит, как правило, при равных значениях концентраций молекулярной и ионной форм индикатора, поэтому во многих системах рТ= pKi.
Требования к кислотно-основным индикаторам:
резко различная окраска индикатора при близких значениях рН;
минимальный интервал изменения окраски;
контрастный переход окраски;
стабильность окраски индикатора;
обратимость изменения окраски.
Теории индикаторов
Существуют различные теории индикаторов, каждая из которых по своему объясняет поведение кислотно-основных индикаторов в кислых и щелочных средах.
Ионная теория индикаторов (Оствальда 1894 г). В связи с тем, что кислотно-
основные индикаторы представляют собой слабые кислоты или слабые основания, любой такого рода индикатор диссоциирует в растворе согласно уравнению:
слабая кислота (донор протонов) |
HInd ↔ |
+ In |
слабое основание (акцептор протонов) |
IndОН ↔ In |
+ |
Окраска раствора, в котором индикатор находится в молекулярной форме, отличается от окраски раствора, в котором индикатор находится в ионной форме.
Так, молекулы кислотного индикатора фенолфталеина HInd бесцветны, а его анионы In окрашены в малиновый цвет: достаточно к раствору, содержащему фенолфталеин, прибавить 1—2 капли щелочи, как введенные -ионы станут связывать катионы с образованием слабого электролита — молекул воды. При этом равновесие диссоциации индикатора сместится вправо, и накопление анионов In вызовет окрашивание раствора в малиновый цвет.
И наоборот, если к раствору фенолфталеина прилить несколько капель кислоты, то повышение концентрации одноименного иона Н+ будет подавлять диссоциацию молекул индикатора. Равновесие сместится влево, и раствор обесцветится.
Аналогичным образом объясняют поведение лакмуса, молекулы которого окрашены в красный цвет, а анионы — в синий; нейтральные растворы лакмуса имеют промежуточную фиолетовую окраску. Это подтверждает, что цвет водного раствора индикатора зависит от соотношения между его молекулярной и ионной формами.
Таким образом, переход одной окраски, присущей молекулярной форме кислотноосновного индикатора, в другую, свойственную его ионной форме, происходит под влиянием
или -ионов, то есть зависит от рН раствора.
Хромофорная теория индикаторов. Поведение индикаторов, объясняемое ионной теорией индикаторов, не объясняла изменение окраски индикатора при долгом хранении, а также обратимость окраски индикатора, эти явления объясняла хромофорная теория индикаторов, согласно которой изменение окраски индикаторов связано с изменением структуры их
молекул, внутримолекулярной перегруппировкой, вызываемой действием |
или |
-ионов. |
Согласно хромофорной теории, цветность органических |
соединений, |
|
обусловливается присутствием в |
них хромофоров «носителей цвета» группировок |
атомов с сопряженными связями, |
обеспечивающие поглощение видимого света из-за |
сравнительно легкого возбуждения электронов π-связи, например: —N=N—, —N , |
|
—NO, =C=C=, =C=O. |
|
Присутствие других групп атомов ауксохромов, например, |
, —N , —NHR, |
—самих по себе не придающих окраску органическому соединению, но влияющих на свойство хромофоров, углубляя цвет окрашенного вещества.
По хромофорной теории в процессе изменения рН раствора меняется строение молекул кислотно-основных индикаторов. Это явление обусловливается бензоидно-
хиноидной таутомерией.
При изменении рН среды раствора или при диссоциации хромофоры могут перегруппировываться. Перемена окраски у индикаторов является результатом изменений в их внутреннем строении. У одноцветных индикаторов окраска изменяется в связи с появлением или исчезновением хромофоров. У двухцветных индикаторов эти изменения обусловлены превращением одних хромофоров в другие.
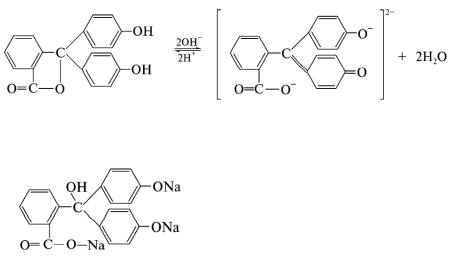
Типичным одноцветным индикатором является фенолфталеин. Молекула фенолфталеина имеет три бензольных кольца и одно из них может претерпевать хиноидную перегруппировку, которая является хромофором, а также молекула содержит две гидроксильные и одну карбоксильную и они тоже изменяются. При рН < 8 его молекулы не содержат хиноидной группировки и поэтому бесцветны. Однако при добавлении раствора щелочи к раствору фенолфталеина (рН=8) происходит перегруппировка атомов в молекуле (депротонизация) с образованием хиноидной группировки, которая обусловливает появление малиновой окраски раствора:
Дальнейшее увеличение рН до 13—14 вызывает некую перегруппировку, в результате чего получается трехзамещенная соль, лишенная хиноидной группировки и поэтому бесцветная:
Вследствие этого фенолфталеин обесцвечивается при действии большого избытка щелочи, например натрия гидроксида.
3. Применение метода нейтрализации
Методом нейтрализации в клинико-биохимических лабораториях, а также в контрольно-аналитических аптечных лабораториях определяют общую кислотность желудочного содержимого, т. е. свободную и связанную соляную кислоту, органические кислоты и кислореагирующие фосфаты, титруя свежий исследуемый материал 0,1 н. раствором едкого натра. Метод нейтрализации используется и для
определения титруемой кислотности и щелочности мочи, величины pH кишечного сока, крови.
В пищевой промышленности метод нейтрализации находит самое широкое применение. При помощи этого метода определяют карбонатную жесткость воды, кислотность молочных продуктов, хлебобулочных и кондитерских изделий, квашеной капусты, безалкогольных напитков и др.
Под жесткостью понимают суммарное содержание в воде солей кальция и магния. Общую жесткость определяют комплексонометрическим методом, а карбонатную или временную жесткость - методом нейтрализации. Различают воду мягкую (общая жесткость до 2 ммоль-экв/дм3), средней жесткости (2-10 ммольэкв/дм3) и жесткую (более 10 ммоль-экв/дм3).
Карбонатная жесткость (временная) зависит от содержания в воде гидрокарбонатов кальция и магния. Она почти полностью устраняется кипячением, при котором гидрокарбонаты разлагаются:
Са(НСО3)2 = CaCO3+ СО2 + |
2О |
|
||
Mg(НСО3)2 = MgCO3+ СО2 + |
2О |
|||
Жесткость принято |
выражать |
в ммоль-экв/дм3 и рассчитывается по формуле: |
||
Ж |
V (HCl) С(1/1HCl) |
1000 . |
|
|
V (Н2О) |
|
|
||
|
|
|
|
|
Постоянную жесткость, которая не устраняется кипячением определяют обратным титрованием: к пробе воды добавляют избыток стандартного раствора карбоната натрия N и упаривают досуха, затем сухой остаток растворяют в дистиллированной воде и титруют стандартным раствором соляной кислоты:
Ж= |
|
∙1000. |
|
О |
|||
|
|
Определение кислотности хлеба.
Кислотность хлеба обусловливается наличием в нем, главным образом, молочной и уксусной кислот, которые образуются при брожении теста. Умеренная кислотность способствует лучшему усвоению хлеба и придает ему приятный вкус. Большая кислотность хлеба вредна, так как может повысить процессы брожения в органах пищеварения.
За один градус кислотности хлеба принимают 1 мл c(l/1 NaOH) = 1 моль/л, израсходованного на нейтрализацию кислот в 100 г хлеба.
Кислотность ржаного хлеба не должна превышать 12°, а пшеничного -70. Расчет кислотности:
Пересчет на 1,0 н раствор NaOH: |
Vпересчет |
|
V (NaOH) * c(NaOH) |
|
|
|
||||
|
|
|
||||||||
|
|
|
|
|
1.0 |
|
|
|
||
Объем 1,0 н NaOH необходимый на титрование 250 мл вытяжки: V250 |
|
Vпересчет * 250 |
||||||||
Va |
||||||||||
|
|
|
|
|
|
|
|
|
||
На 100 г продукта потребуется: |
|
|
|
|
|
|
||||
кислотность |
V250 |
*100 |
. |
|
|
|
|
|
|
|
|
m |
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
||
Определение кислотности продуктов кондитерского производства.
В кондитерском производстве кислотность принято выражать в условных единицах
(градусах). Под градусом кислотности понимают объем (см3) раствора гидроксида натрия с
концентрацией равной С(l/1 NaOH) = 1 моль/л, необходимого для нейтрализации кислот и кислых солей, содержащихся в 100 г анализируемого изделия.
Кислотность продуктов кондитерского производства (карамель, мармелад, пастила, шоколад, халва, печенье) устанавливают титрованием водной вытяжки (экстракта).
Кислотность кондитерского изделия (град) рассчитывают по формуле:
