
Задание 1
.docx
Задача 1. Рассчитайте изменение энтальпии химической реакции двумя способами для реакции:
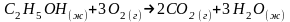
К какому типу, экзо- или эндотермическим, относится указанная реакция?
Решение:
I способ
1. Записать 1-ое следствие из закона Гесса для данной реакции:
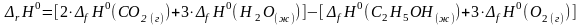
2. Выписать
значения
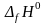 исходных веществ и продуктов реакции
из справочника термодинамических
величин с учетом их агрегатных состояний
и подставить в записанную выше формулу.
исходных веществ и продуктов реакции
из справочника термодинамических
величин с учетом их агрегатных состояний
и подставить в записанную выше формулу.
 .
.
II способ
1. Записать 2-ое следствие из закона Гесса для данной реакции:
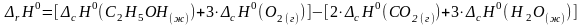
2. Выписать
значения
![]() исходных веществ и продуктов реакции
из справочника термодинамических
величин с учетом их агрегатных состояний
и подставить в записанную выше формулу.
Необходимо помнить, что энтальпия
сгорания конечных продуктов окисления,
таких как CO2, Н2О
равна 0.
исходных веществ и продуктов реакции
из справочника термодинамических
величин с учетом их агрегатных состояний
и подставить в записанную выше формулу.
Необходимо помнить, что энтальпия
сгорания конечных продуктов окисления,
таких как CO2, Н2О
равна 0.
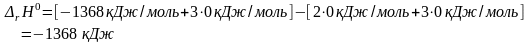 Так
как
Так
как
![]() ,
то реакция экзотермическая, то есть
протекает с выделением теплоты.
,
то реакция экзотермическая, то есть
протекает с выделением теплоты.
Ответ: I способ: –1367 кДж; II способ: –1368 кДж.
Задача 2. Рассчитайте количество теплоты, которое выделится при окислении 90 г глюкозы, воспользовавшись 1-ым следствием из закона Гесса.
Решение:
1. Записать уравнение химической реакции:
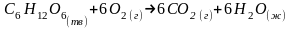
2. Рассчитать тепловой эффект реакции, воспользовавшись I следствием из закона Гесса:
 Так
как
Так
как
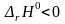 ,
то реакция экзотермическая, то есть
протекает с выделением 2802 кДж теплоты.
,
то реакция экзотермическая, то есть
протекает с выделением 2802 кДж теплоты.
3. Рассчитать количество вещества в 90 г глюкозы:
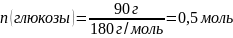
4. Составить и решить пропорцию для нахождения количества теплоты, выделяющейся при окислении 0,5 моль глюкозы:

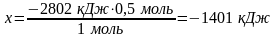
Ответ: Выделится 1401 кДж тепла.
Задача 3. Вычислите калорийность пищевого продукта массой 250 г, содержащего 55% воды, 30% белка, 10% жира и 5 % углеводов.
Решение:
Калорийность пищевого продукта будет складываться из калорийности белков, жиров и углеводов, входящих в его состав:
 +
+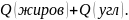
Для определения калорийности белков, жиров и углеводов воспользуемся табличными значениями удельных теплот полного окисления веществ в условиях организма (табл.2, см. приложение): условный белок – 17 кДж/г; условный жир – 38 кДж/г; углеводы – 17 кДж/г.
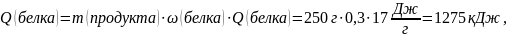

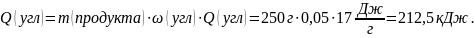
Калорийность продукта будет равна сумме теплот полного окисления белков, жиров и углеводов:

Для оценки калорийности в килокалориях произведем пересчет:
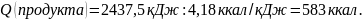
Ответ: калорийность пищевого продукта составляет 583 ккал.
Вариант 1.
1. Вычислите стандартную энтальпию реакции:
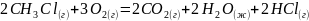
используя табличные значения стандартных энтальпий образования веществ.
2. В 100 г консервированной кукурузы в среднем содержится 3 г белка, 18 г углеводов и 2 г жиров. Рассчитайте (в кДж и ккал) энергию, которая выделится при усвоении порции кукурузы массой 180 г.
Вариант 2.
1. Вычислите стандартную энтальпию реакции, используя значения стандартных энтальпий сгорания веществ:
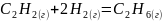 .
.
2. Один сорт сметаны содержит в 100 г 15,0 г жиров, 2,9 г белка, 3,0 г углевода; другой сорт – 25,0 г, 2,6 г и 2,7 г соответственно. Вычислите для каждого сорта сметаны массы, эквивалентные энергетической ценности 200 ккал.
Вариант 3.
Вычислите количество теплоты, которое выделится, если в реакцию

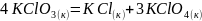
вступает 3 г KClO3.
В 100 г баранины содержится 24 г белка и 25 г жира. Вычислите массу, эквивалентную энергетической ценности 520 ккал.
Приложения
Таблица 1. Термодинамические свойства веществ при 298К
-
Вещество (агрегатное состояние)
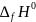 ,
кДж/моль
,
кДж/мольS0, Дж/мольК
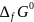 ,
кДж/моль
,
кДж/моль ,
кДж/моль
,
кДж/мольНеорганические соединения
Br2(ж)
0
152
0
Br2(г)
30,7
245,4
3,1
Cl2(г)
0
223
0
N2(г)
0
191,5
0
O2(г)
0
205
0
O3(г)
142
238
163
Н2(г)
0
131
0
СО2(г)
–393,5
214
–394
СО(г)
–111
198
–137
HCl(г)
–92,3
186,8
–95
HBr(г)
–36,3
199
–53,3
Н2О(ж)
–286
70
–237,2
H2O(г)
–241,8
189
–228,6
H2O2(ж)
–188
110
–121
HNO3(ж)
–173
156,2
–80
HNO3(г)
–134
267
–74
H2SO4(ж)
–814
157
–690
NH3(ж)
–80,80
110,00
–26,60
NH3(г)
–45,94
192,66
–16,48
NO(г)
91,26
210,64
87,58
NO2(г)
33,8
240,5
51,8
N2O4(г)
9,7
304,3
98,3
S2(г)
128,4
228
79,4
SО2(г)
–297
249
–300
H2S(г)
–21
205,7
–33,8
KCl(к)
–436
83
–408
KClO3(к)
–391
143
–290
KClO4(к)
–430
151
–300,6
Органические соединения
СН4(г)
–75
186,3
–51
–890
С2Н2(г)
226
201
209
–1300
С2Н6 (г)
–84,7
229,5
–33
–1560
СН3Cl (г)
–86,3
234,5
–63
С3Н8О3(ж) глицерин
–668,60
204,47
–477,07
–1661
С12Н22О11(к) сахароза
–2222,12
360,24
–1544,70
–5645
СO(NH2)2(к)
–333,17
104,60
–197,15
–634
С6Н6(г)
83
269
130
–3302
С6Н6(ж)
49
173
124
–3268
С6Н12(ж)
–156
204
26,8
–3920
СH3COOH(ж)
–485
160
–390
–875
СH3COСH3(г)
–217,6
295
–153
СH3COСH3(ж)
–248
200
–155
–1790
С2H5OH(г)
–235
283
–168
–1409
С2H5OH(ж)
–278
161
–175
–1368
С2H5OС2H5(ж)
–279
253
–123
–2727
С6Н12О6(водн), D-глюкоза
–1264
270
–917
CH3CH(OH)COOH(водн) молочная кислота
–686
222
–539
Таблица 2. Удельные теплоты полного окисления веществ
в условиях организма
-
Вещество
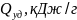
Жиры
38
Алкоголь
26
Белки
17
Углеводы
17
Карбоновые кислоты (лимонная кислота и др.)
9
Многоатомные спирты (глицерин, подсластители)
10
