
Дисперсные системы Примеры решения + Задачи для самостоятельного решени
.pdf
Дисперсные системы
Дисперсными системами называются гетерогенные, преимущественно микрогетерогенные, двух- и многофазные системы, в которых по крайней мере одна из фаз находится в дисперсном состоянии.
Обычно дисперсная система состоит из частиц дисперсной фазы и окружающей их сплошной дисперсионной среды. Иначе говоря, частицы раздробленного вещества являются дисперсной фазой, а вещество, в котором они распределены, представляет собой дисперсионную среду.
Так, золи являются примером высокодисперсных коллоидных систем с жидкой дисперсионной средой, в объёме которой распределена твердая дисперсная фаза, размер которой лежит в пределе от 1 до 100 нм (10−9—10−7м).
Рассмотрим теперь строение коллоидных частиц на примере гидрозоля гидроксида железа (III). Его получают, реакцией гидролиза при добавлении в кипящую воду небольшого количества раствора FeCl3:
Кипячение способствует реакции благодаря удалению из системы хлороводорода с парами воды. Стабилизатором принято считать хлороксид железа FeOCl, являющийся продуктом неполного гидролиза хлорида железа
(III):
FeCl3+H2O→FeOCl+2HCl.
Молекулы FeOCl, подвергаясь диссоциации, образуют ионы FeO+и Cl-: FeOCl→FeO++Cl-.
Эти ионы участвуют в строении коллоидной частицы. Напишем формулу мицеллы и поясним ее строение:
По правилу Панета-Фаянса на агрегате (из m молекул нерастворимого вещества) из раствора адсорбируются те ионы, которые близки по своей химической природе к составу агрегата и достраивают его кристаллическую решетку. В данном случае такими ионами, которые называются потенциалобразующими, будут ионы FeO+. Агрегат вместе с адсорбированными на нем потенциалобразующими ионами (в количестве n) называется ядром мицеллы. Как правило, m>>n. Ионы FeO+придают ядру

положительный заряд. К заряженному ядру притягиваются ионы противоположенного знака (противоионы Сl-). Часть противоионов (в количестве (n-x)) находится в непосредственной близости от ядра в так называемом адсорбционном слое. Ядро вместе с этими противоионами являются собственно коллоидной частицей (гранулой). Гранулы данного золя заряжены положительно. Остальные противоионы Cl- в количестве х образуют диффузный слой и нейтрализуют заряд гранулы. Вся частица, называемая мицеллой, электронейтральна.
При получении золя Fe(OH)3 реакцией гидролиза хлорида железа (III) стабилизатором может являться и сам FeCl3, не полностью подвергающийся гидролизу. Тогда мицелла полученного золя выражается формулой:
{m[Fe(OH)3]•nFe3+3(n-x)Cl-}+•3xCl-.
Процесс соединения коллоидных частиц в более крупные агрегаты называется коагуляцией. Коагуляцию могут вызвать разные причины: механическое воздействие (резкое встряхивание, перемешивание), резкое понижение или повышение температуры, действие света, пропускание электрического тока, повышение концентрации золя, добавление неэлектролитов. Чаще всего самым эффективным фактором является добавление электролитов.
Все электролиты, взятые в достаточном количестве, способны вызывать коагуляцию коллоидных растворов. Наименьшая концентрация электролита, вызывающая коагуляцию золя за определённый промежуток времени,
называется порогом коагуляции.
эл · эл
Спорог = эл + золя
Он выражается в ммоль/л. Величина, обратная порогу коагуляции, называется коагулирующей способностью:
1
С порог .
Коагулирующей частью электролита является один из его ионов – тот, который имеет заряд, противоположный по знаку заряду коллоидных частиц, то есть совпадающий со знаком противоиона (в составе мицеллы). Например, для положительного золя Fe(OH)3 коагулирующим ионом электролита является его анион. При этом коагулирующее действие резко возрастает, а порог коагуляции уменьшается с увеличением заряда коагулирующего иона. Эта эмпирическая закономерность известна как правило Шульце-Гарди:
коагулирующий ион имеет заряд, противоположный заряду коллоидной частицы, при этом порог коагуляции электролита тем меньше, чем больше заряд (валентность) коагулирующего иона.

Пример. 2. Золь иодида серебра получен смешиванием раствора нитрата
серебра объемом 20 мл с С( |
)= |
моль/л и раствора иодида калия |
объемом 30 мл с С(KI) = |
|
моль/л. Назовите метод получения золя. |
Определите знак заряда коллоидных частиц. Приведите формулу мицеллы полученного золя.

|
Дано: |
|
С( |
)= |
моль/л |
V( |
) = 20 мл |
|
С(KI) = |
|
моль/л |
V(KI) = 30 мл
знак заряда – ?
Решение:
Золь получен химическим конденсационным методом в результате реакции обмена:
Знак заряда коллоидных частиц зависит от того, какой электролит взят в избытке. Для этого рассчитаем взятые количества реагентов:
; |
|
Получили, что: |
. |
После образования золя в избытке иодида
калия в растворе останутся ионы |
, |
, . |
|
По правилу Панета-Фаянса на агрегатах |
|
||
избирательно |
адсорбируются |
||
потенциалопределяющие |
ионы |
, |
|
обуславливающие отрицательный знак заряда коллоидных частиц. Формула мицеллы полученного золя:
Ответ: знак заряда – отрицательный.
Пример 3.

Пример 4.
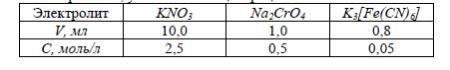
Задачи для самостоятельного решения
1.Напишите формулу мицеллы золя, полученного путем смешения 10 мл раствора нитрата меди концентрации 0,0015 моль/л и 5 мл 0,1% раствора ортофосфата калия плотностью 1,001 г/мл.
2.Золь бромида серебра получен сливанием 25,0 мл 0,008 М KBr и 18,0 мл 0,0096 М AgNO3. Определите знак заряда коллоидной ча-стицы и составьте формулу мицеллы золя.
3.Коагуляция золя гидроксида железа (III) объемом 4 л наступила при
добавлении 10 %-ного раствора сульфата магния объемом 0,91 мл ( =1,1г/мл). Вычислите порог коагуляции золя сульфат-ионами.
4.Пороги коагуляции гидрозоля гидроксида железа (III) сульфатом натрия и хлоридом алюминия соответственно равны 0,32 и 20,5 ммоль/л. Определите знак заряда коллоидных частиц золя. Вычислите величины коагулирующей способности этих электролитов.
5.Рассчитайте пороги коагуляции, определите знак заряда коллоидной частицы и напишите формулу мицеллы золя гидроксида алюминия, полученного сливанием растворов хлорида алюминия и гидроксида натрия, если для коагуляции 10,0 мл золя был израсходован следующий объем электролитов, указанной концентрации:
