
Обмен в-в в растительной клетке и особенности его регуляции
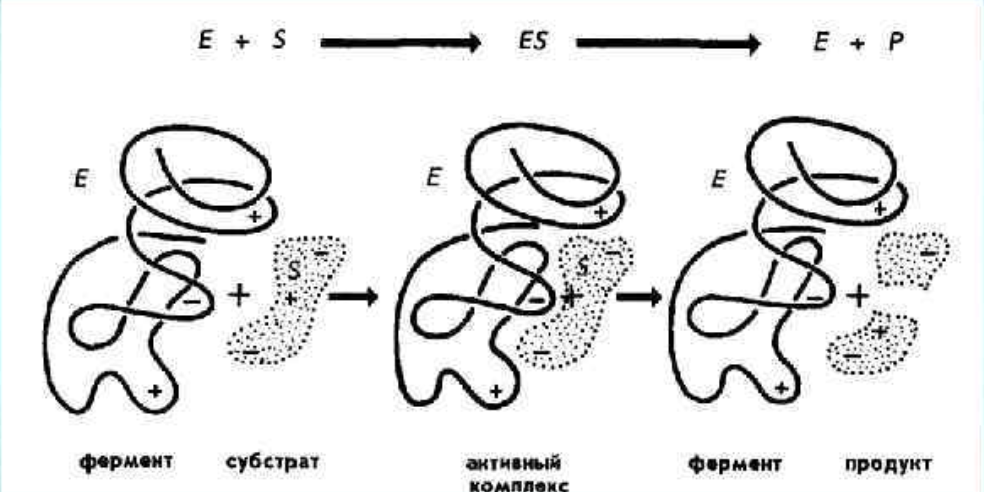
Активный центр - это совокупность функциональных групп, принимающих непосредственное участие в ферментативной реакции. Активный центр формируется в результате специфической укладки белка, поэтому каталитическая активность фермента зависит не только от первичной структуры белка, но и от его конформации. Образование фермент-субстратного комплекса вызывает переход субстрата в более реактивное состояние, его активацию. Известно, что при любом химическом взаимодействии вступают в реакцию только те молекулы, которые обладают избытком энергии.
Число столкновений между молекулами, приводящее к химическому взаимодействию (число эффективных столкновений), составляет лишь некоторую долю (иногда очень малую) общего числа столкновений. Эффективными оказываются лишь столкновения между молекулами, которые в этот момент обладают некоторым избытком внутренней энергии по сравнению со средней (для данной температуры) величиной. Энергия, которую необходимо придать молекулам вещества А для превращения их в Д сверх той средней, которую молекулы А уже содержат, называют энергией активации. В самом общем виде фермент, благодаря созданию фермент-субстратного комплекса, проводит реакцию обходным путем и тем самым снижает энергию активации или энергетический барьер.
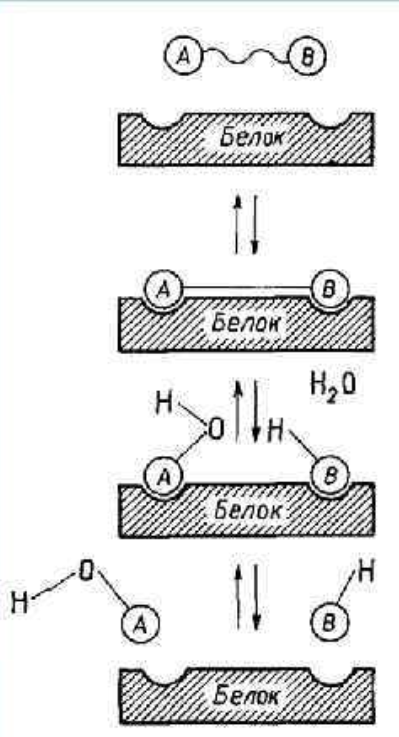
Повышение реакционной способности молекул или снижение энергии активации, по-видимому, для разных реакций проходит неодинаковыми путями. Точный механизм катализа для отдельных реакций до сих пор неясен. Вероятно, существуют разные возможности. Прежде всего, фермент может связывать субстрат в напряженной конфигурации. Так, если Функциональные группы фермента расположены таким образом, что после связывания две части молекулы субстрата А-В удерживаются несколько дальше друг от друга, чем тогда, когда они находились в свободном состоянии, то в результате растяжения связь в молекуле А-В легче поддается разрыву («эффект дыбы»). Одновременно присоединяется молекула воды. Именно таким путем совершается ферментативный распад (гидролиз) многих органических соединений. Реакция может идти и в обратном направлении. В этом случае вещества А и В, присоединяясь к активному центру фермента, сближаются и молекула воды как бы выжимается, образуется соединение АВ (рис. 1). Приведенная схема является упрощенной. В более общем виде можно сказать, что при образовании фермент-субстратных комплексов происходит определенная ориентация молекул: или сближение реагирующих молекул, или создание напряженных связей. Большое значение имеет поляризация субстрата (путем смещения электронов), происходящая в результате взаимодействия фермента и субстрата (рис. 2). Все это делает молекулы более реакционноспособными. Продукты реакции отделяются от фермента, и молекулы фермента регенерируют в прежнем виде. Благодаря этой последней особенности одна и та же молекула фермента может катализировать большой объем превращений. Таким образом, можно отметить следующие три фазы действия фермента: 1) образование фермент-субстратного комплекса; 2) преобразование промежуточного соединения в один или несколько активных комплексов; 3) выделение продуктов реакции и регенерация молекулы фермента.
Ферменты проявляют свою активность при выделении из клетки. Однако их действие в клетке (in vivo) может отличаться от действия вне клетки (in vitro). Ферменты могут быть локализованы в определенных частях клетки, вплетены в мембраны, пространственно разделены или, наоборот, объединены с субстратом. Все это накладывает большой отпечаток на их работу.
Разнообразие ферментов в клетке чрезвычайно велико, однако все их можно разделить на шесть классов: 1) оксидоредуктазы катализирующие окислительно-восстановительные реакции; 2) трансферазы катализирующие перенос атомных группировок от одного соединения к другому; 3) гидролазы осуществляющие распад различных органических соединений с участием воды (гидролиз); 4) лиазы катализирующие присоединения какой-либо атомной группировки к органическим соединениям или отщепляющие от субстратов определенную группу без участия воды; 5) изомеразы- катализирующие внутри-молекулярный перенос групп с образованием изомерных форм; 6) лигазы, или синтетазы, катализирующие синтез органических соединений, происходящий при участии АТФ (с использованием энергии этого соединения).
Белки-ферменты, катализирующие одну и ту же реакцию, встречающиеся у одного вида организмов, но различающиеся по ряду физико-химических свойств (внутренней локализации, электрофоретической подвижности), называют изоферментами. Они различаются по реакции на внешние условия; их максимальная активность проявляется в различных условиях температуры и значений рн. по-видимому, наличие изоферментов позволяет организмам лучше приспосабливаться к меняющимся условиям среды.
 Скорость
и направленность ферментативных реакций
клетки зависят от следующих причин: 1)
активности действующего фермента; 2)
количества белка-фермента. Остановимся
коротко на каждой из этих причин.
Скорость
и направленность ферментативных реакций
клетки зависят от следующих причин: 1)
активности действующего фермента; 2)
количества белка-фермента. Остановимся
коротко на каждой из этих причин.
2. Регуляция активности ферментов.
Достигается различными способами. Относительно простым для объяснения является влияние на ферментативную активность факторами среды, такими как температура, значение рН, давление, ионная сила.
Зависимость ферментативных реакции от температуры можно оценивать величиной температурного коэффициента (О1), который показывает, во сколько раз данный процесс ускоряется при повышении температуры на 10°С. Q, ферментативных реакции довольно высок, однако он не остается постоянным. Температурные оптимумы также различаются для разных ферментов и даже для одного и того же фермента. По данным Б.А. Рубина, один и тот же фермент, выделенный из растений в разное время года (ранней весной, летом и осенью), будет по-разному реагировать на повышение температуры. Ферменты, выделенные из растения в весенний период, будут иметь более низкий температурный оптимум по отношению к ферментам, выделенным в летний период. Поскольку большинство ферментов являются белками, то повышение температуры свыше 40°С вызывает их частичную инактивацию, а дальнейшее повышение температуры приводит уже к необратимому их повреждению.
Большое значение для протекания ферментативной реакции имеет значение рн среды. У каждого фермента свой оптимум значения рН, при котором лучше всего проявляется его активность. Отклонение значения рн в сторону большей кислотности или большей щелочности приводит к снижению активности фермента. Это связано с тем, что в большинстве случаев функциональные группы белка-фермента, составляющие его активный центр, ионизированы и их заряд зависит от значения рн, а от заряда зависит возможность образования фермент-субстратного комплекса. На растворимость белков-ферментов влияет ионная сила, связанная с концентрацией нейтральных солей и зарядом ионов.
Скорость ферментативной реакции может регулироваться соединениями, взаимодействующими с активным центром фермента в силу стерического соответствия - изостертеская регуляция. Такими соединениями могут быть субстраты, т. е. те вещества, которые подвергаются превращениям. При избыточной концентрации субстрата снижается скорость реакции (субстратное торможение).
Некоторые ферменты, кроме активных (каталитических) центров, имеют специальные регуляторные центры, которые служат для связывания эффекторов (регуляторов). Под действием эффекторов происходит изменение вторичной и третичной структуры (конформации) белка-фермента. Этот эффект носит название аллостерическая регуляция, а ферменты - аллостерическими.
Благодаря аллостерическим изменениям фермент может потерять активность или приобрести ее. Изменение конфигурации фермента происходит под влиянием веществ разного происхождения. В частности, это могут быть различные метаболиты, субстраты, а также конечный продукт данной реакции, который, накапливаясь, вызывает ее замедление.
Модификация структуры может происходить в результате присоединения к ферменту различных групп. Распространенным способом является фосфорилирование, т. е. присоединение к аминокислотам белка остатка фосфорной кислоты. Реакции фосфорилирования белков катализируются различными протеинкиназами: Белок + АТФ -›Белок-Ф + АДФ. В состоянии покоя протейнкиназы находятся в неактивном состоянии. Под действием внешнего сигнала в клетке образуются информационные молекулы-эффекторы (их иногда называют вторичными посредниками или мессенджерами), которые взаимодействуют с регуляторной субъединицей протеинкиназ. Это приводит к активированию или инактивированию протеинкиназ.
Активацию могут вызывать ионы кальция, комплекс Са2+-кальмодулин, АМФ, ГМФ и др. В зависимости от этого выделяют протеинкиназы: кальцийзависимые, АМФ-зависимые др. У растений описано около 500 протеинкиназ, которые отличаются и по типу фосфорилируемых аминокислот. В результате клонирования большинства генов протеинкиназ удалось расшифровать первичную структуру тенов и протеинкиназ. Это является важным, поскольку протеинкиназы выполняют ключевую роль в работе сигнальных систем.
Регуляция синтеза белков-ферментов. Все клетки данного организма имеют идентичную ДНК, поэтому обладают одинаковым геномом. Иначе говоря, все клетки одного организма обладают способностью синтезировать одинаковые белки-ферменты и имеют равные потенциальные возможности. В процессе развития организма из оплодотворенной яйцеклетки в каждый данный момент и в каждой специализированной клетке проявляется лишь часть генетического потенциала. Так, в специализированных клетках лишь от 5 до 20% ДНК служит основой ДЛЯ транскрипции, остальное количество ДНК репрессировано.
Разные клетки одного организма сильно различаются по форме и функциям. Специализированные клетки должны различаться и по содержанию белков-ферментов. Экспериментальных доказательств этого положения немного. Интересные данные в этом отношении получены для корневых волосков. Показано, что корневые волоски образуются укороченными клетками, которые отличаются высоким содержанием фермента кислой фосфатазы. Рядом расположенные клетки, не содержащие этого фермента, корневых волосков не образуют.
Среда тонко регулирует клеточный обмен. Достаточно прибавить определенное вещество в среду, где культивируются одноклеточные организмы, и у них появляются соответствующие ферменты. Такое явление называют индуцированным синтезом ферментов. Следовательно, способность к синтезу данного фермента была заложена в клетке, но она не проявлялась. Так, в норме дрожжевые клетки не используют лактозу. Однако если в среду добавить лактозу, клетки приобретают способность синтезировать фермент галактозидазу и сбраживать этот сахар. Можно привести обратный пример, когда присутствие определенного вещества тормозит образование ферментов, катализирующих его синтез. Так, тифозная палочка в присутствии триптофана не способна к синтезу этой аминокислоты. Однако в среде, лишенной триптофана, в клетках появляется фермент триптофансинтетаза. B клетках корня высших растений появляется фермент, восстанавливающий нитраты (нитратредуктаза) только в случаях их присутствия в среде.
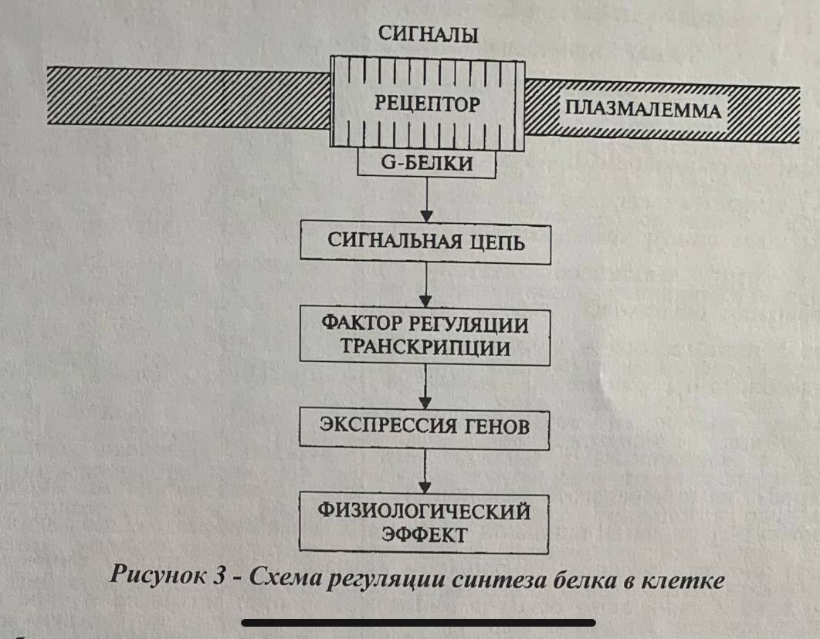
Регуляция синтеза белков-ферментов может происходить разными путями - как на уровне транскрипции, так и на посттранскрипционном уровне. В процессе эволюции выработались приспособления, позволяюшие организму воспринимать преобразовывать поступающие из внешней среды сигналы (рис. 3). Это так называемые сигнальные системы или сигнальные цепи. Именно это вызывает включение и выключение определенных генов. Сигнальные импульсы воспринимаются клеткой с помошью специфических рецепторов белковой природы. Белки-рецепторы, как правило, располагаются либо на поверхности плазмалеммы, либо пронизывают ес. Взаимолействие с сигналом приводит к изменению конформации рецепторного белка. Эти изменения позволяют белку-рецептору передать сигнал на так называемые G-белки, которые обладают способностью к циклическим преобразованиям, связанными, соответственно, с процессом фосфорилирования и дефосфорилирования и соответствующими конформационным изменениям. Источником фосфорилирования для G-белков является ГТФ-гуанинтрифосфат. При взаимодействии с белком-рецептором связанный с G-белками ГТФ превращается в ГДФ, а фосфорилированный G-белок взаимодействует со следующим звеном сигнальной цепи (вторичный посредник). К таким вторичным посредникам можно отнести циклическую АМФ, инозитолпирофосфат и др.
Большую роль в функционировании сигнальных цепей играют протеинки-назы ферменты, переносящие фосфатную группировку на белки. Как уже упоминалось, именно в процессе фосфорилирования происходят конформационные изменения белков. Важное значение имеют Са2+-зависимые протеинкиназы, способные фосфорилировать большое количество белков. В связи с этим важно наличие кальциевой сигнальной цепи. Содержание Са2+ в цитозоле очень мало, поэтому большое значение имеют регуляция кальциевых каналов в тонопласте и эндоплазматической сети. После G-белков сигнальный импульс может передаваться фосфолипазы приводить к образованию инозитолтрифосфата, который способствует открытию кальциевых каналов. Повышение содержания кальция активирует действие Са2+-зависимых протеинкиназ, в том числе происходит активация фактора инициации транскрипции.
 В
ряде случаев в сигнальную цепь включаются
митогенактивируемые протеинкиназы
МАРК И МАР-киназный каскад. Этот каскад
содержит серию протеинкиназ и «включается»
при митозе, обезвоживании, повреждении
тканей и других стрессорах. При этом
сигнальная цепь принимает следующий
вид:
В
ряде случаев в сигнальную цепь включаются
митогенактивируемые протеинкиназы
МАРК И МАР-киназный каскад. Этот каскад
содержит серию протеинкиназ и «включается»
при митозе, обезвоживании, повреждении
тканей и других стрессорах. При этом
сигнальная цепь принимает следующий
вид:
сигнал -› рецептор -> G-белки -> МАРККК -> МАРКК - МАРК – экспрессия
Необходимо подчеркнуть, что в результате действия сигнальных цепей может осуществляться экспрессия генов, их перепрограммирование. Как считает И.А. Тарчевский (2002) «Сам по себе геном является лишь хранилищем информации, реализуемой с помощью сигнальных цепей в зависимости от изменения внутренней и окружающей клетку среды». Множественность сигналов упорядочивает экспрессию генов. Нельзя не подчеркнуть, что в качестве сигналов во многих случаях работают гормоны. Именно их соотношение и концентрация изменяется под влиянием внешних факторов. На всех этапах передачи сигналов важную роль играют энергетические процессы. А именно изменение содержания таких высокоэнергетических соединений как АТФ и ГТФ.
Наряду с транскрипцией регуляция может осуществляться на разных этапах посттранскрипционных процессов. В клетке может регулироваться превращение про-мРНК в МРНК (процессинг), выход мРНК из ядра в цитоплазму, время жизни мРНК. Наконец, возможно осуществление регуляции и в процессе собственно трансляции путем изменения количества рибосом, образования полисом, количества транспортных PHK, активности аминоацилтрансфераз, уровня содержания АТФ. Трансляция может регулироваться путем изменения активности мРНК, а также ее количества.
Таким образом имеются различные возможности регуляции новообразования белков-ферментов. Благодаря этой регуляции организм растет и развивается, приспосабливается к различным условиям среды. В основе изменений обмена, происходящих под влиянием внешних воздействий, лежит, прежде всего, различная направленность и скорость ферментативных реакций. Регуляция образования и активности белков- ферментов лежит также в основе процессов дифференциации.
В заключение важно подчеркнуть, что клетка имеет сложную организацию. В отдельных ее компартментах осуществляются специфические взаимосвязанные физиолого-биохимические процессы. Взаимосвязь проявляется особенно хорошо на синтезе белка. Информация для этого процесса хранится в ядре, энергия поставляется митохондриями, материал образуется в цитоплазме, сам процесс происходит на рибосомах. Синтез белка - это также пример регулируемого процесса. Клетка, как и организм в целом, может существовать только при непрерывном обмене с внешней средой.
Достижения молекулярной биологии и генетики открыли новые пути исследования физиологических процессов и их регуляции в растительном организме. Большое значение в этом отношении имело развитие генной инженерии, которая является одной из отраслей биотехнологии. Своей задачей она имеет создание іn vitro (вне организма) новых генетических структур. Большие успехи достигнуты на бактериальной клетке. В частности, с помощью рекомбинированных бактерий получен ряд ценных медицинских препаратов (интерферон и др.). Генетическая манипуляция на растениях значительно сложнее. Все же и здесь имеются успехи.
В основе генной инженерии лежит перенос в организме чужеродных генов, информации и получение трансформированных или трансгенных растений. Это с одной стороны дает возможность изучения функционирования отдельных генов и в этой связи подойти к раскрытию молекулярных основ физиологических процессов. Вместе с тем, это позволяет получать растения с новыми свойствами. В частности, включать гены устойчивости к болезням, вредителям, неблагоприятным условиям среды. Так, в клетки растения табака был введен ген, ответственный за биосинтез яда, смертельного для насекомых. Благодаря этому растения табака приобрели устойчивость к насекомым. В растение табака были также введены гены, делающие его устойчивым к гербицидам. В клетки растения подсолнечника были перенесены гены, кодирующие белки бобовых культур, которые являются наиболее полноценными в пищевом отношении.
Процесс получения трансгенных растений включает выделение конкретных генов, внедрение чужеродного гена в наследственный аппарат растительной клетки, регенерация из отдельной клетки нормального растения с измененным геномом. Большую роль в развитии генной инженерии сыграло выделение у ряда бактерий внехромосомных генетических элементов, получивших название плазмид. Плазмиды, индуцирующие опухолеобразование у растений, получили название Ті-плазмил (Ті -tumor inducing, индуцирующая опухоль). На примере исследований на агробактериях (Agrobacterium tumefacies) показано, что сегмент, содержащийся в плазмиде, получивший названиеT-ДНК, может переноситься из клетки бактерии в растительную клетку, встраиваться в геном растений.
Интегрированная в растительную клетку чужеродная Т-ДНК наследуется в соответствии с законами Менделя. Установлено наличие в клетках особых ферментов специфических рестриктаз. Ферменты обладают способностью расплетать ДНК в строго определенных участках между определенными нуклеотидами. Кроме того, показано наличие ферментов лиаз. Комбинация этих ферментов позволяет вылелить Т-ДНК из плазмиды и встраивать в нее чужеродный ген. Эту сконструированную плазмиду через ряд этапов снова вводят в клетку бактерий. На последнем этапе растение заражают этими модифицированными генно-инженерными бактериями. Зараженные растения будут содержать Т-ДНК со встроенным чужеродным геном, т.e. являться трансгенными. К 2000 г. получено более 120 видов трансгенных растений. В 13 странах ими занято 44 2 млн га. Нельзя не отметить, что практическое использование таких растений все еще объект дискуссии.
