
2 семестр (+ подготовка к экзу) / Ответы на вопросы экзамена фх 2 семестр
.pdf
146.Основные этапы вывода уравнения теории активных соударений. Константа скорости бимолекулярной реакции, предэкспоненциальный множитель, энергия активации. Стерический фактор, необходимость его введения в кинетическое уравнение теории.
(см. вопросы 144 и 145)
147.Особенности протекания мономолекулярных реакций в газовой фазе. Механизм активации. Влияние давления (концентрации) на порядок мономолекулярной реакции. Схема Линдемана.
Мономолекулярные реакции — тип элементарных реакций, в котором молекула исходного вещества превращается в продукты.
Распад сложных молекул в газовой фазе возможен, когда уровень запасенной колебательной энергии превзойдет некоторое пороговое значение.
Механизм активации путём двойных соударений: 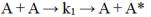
В мономолекулярных реакциях активированные молекулы существуют некоторое время, не распадаясь (происходит перераспределение энергии между различными связями). Активированная молекула может или превратиться в продукт, или потерять
активность, столкнувшись с другой молекулой.
Влияние давления (концентрации): велико -> первый порядок; мало -> второй порядок. Схема Линдемана:
Мономолекулярная реакция в схеме Линдемана рассматривается как комбинация двух бимолекулярных процессов и одного мономолекулярного.

148.Схема Линдемана. Поясните, при каких условиях реакция разложения в газовой фазе при термическом механизме активации протекает по первому порядку.
(см. вопрос 147)
149.Механизм мономолекулярных реакций в газовой фазе. Причина изменения порядка реакции с первого на второй при переходе от высоких давлений к низким давлениям реагента. Схема Линдемана.
(см. вопрос 147)
150.Для реакции разложения органического вещества в газовой фазе, происходящей по схеме «А → продукты», была исследована зависимость периода половинного превращения от начального парциального давления (вариант: «от начальной концентрации») реагента при постоянной температуре. Оказалось, что при достаточно высоких давлениях время полупревращения не зависит от начального парциального давления (вариант: «от начальной концентрации») реагента, тогда как при малых давлениях изменяется обратно пропорционально давлению (вариант: «начальной концентрации»). Объясните механизм наблюдаемых явлений с помощью схемы Линдемана.
(см. вопрос 147)
151.Реакции термического разложения некоторых органических веществ в газовой фазе являются мономолекулярными. Однако они протекают по первому порядку лишь при средних или высоких парциальных давлениях реагента, тогда как при малых парциальных давлениях реагента подчиняются кинетическим закономерностям, характерным для реакций второго порядка. Как объясняются эти экспериментальные данные с использованием схемы Линдемана?
(см. вопрос 147)
152.Основные положения теории переходного состояния (активированного комплекса). Основные стадии механизма химической реакции (кинетическая схема). Активированный комплекс. Термодинамическая форма основного уравнения теории.

Переходное состояние (активированный комплекс, АК) – состояние с наибольшей потенциальной энергией при движении системы реагирующих частиц вдоль координаты реакции.

153.Теория переходного состояния (активированного комплекса). Кинетическая схема протекания химического процесса согласно теории переходного состояния. Активированный комплекс.
(см. вопрос 152)
154.Основные положения теории переходного состояния, кинетическая схема химической реакции, активированный комплекс. Термодинамическая форма кинетического уравнения теории.
(см. вопрос 152)
155.Поясните понятия энтальпия активации и энтропия активации химической реакции. В какой теории кинетики используются эти величины? Как и на основе каких экспериментальных данных могут быть рассчитаны эти величины? Приведите соответствующие расчётные формулы для случая мономолекулярной (вариант: «бимолекулярной») химической реакции в идеальной газовой фазе.
Энтальпия активации (энтропия активации) — изменение энтальпии (энтропия) при переходе от исходной молекулы к активированному комплексу. Данные понятия используются в теории активированного комплекса.
156.Особенности кинетики химических реакций в жидких растворах. Клеточный эффект, уточнённая схема механизма простой реакции в жидком растворе, учитывающая клеточный эффект. Классификация реакций в жидких растворах по лимитирующей стадии, особенности реакций в каждом классе.
При проведении реакции в растворе скорость процесса по сравнению с газовой фазой меняется. Связано это скорее всего с изменением энтропии системы за счет сольватации (также может меняться энергия активации при замене растворителя).
При переходе от газовой фазы к жидкой может изменяться механизм и лимитирующая стадия (переход из кинетической области в диффузионную) + эффект сольватированной оболочки (клетки).

157.Особенности кинетики реакций Меншуткина в жидких растворах. Влияние вида радикала или атома галогена на скорость реакции Меншуткина в одном и том же растворителе. Влияние растворителя на скорость реакции данного класса при прочих равных условиях.
158.Особенности кинетики химических реакций в жидких растворах. Первое и второе уравнения Бренстеда–Бьеррума (вывод и анализ, особенности применения).
(см. вопрос 156)

159.Влияние сольватации на энергию активации медленных реакций в жидких растворах. Приведите анализ влияния сольватации с использованием первого уравнения Бренстеда– Бьеррума. Ответ поясните графиками.
Сольватация, будучи процессом экзотермическим, увеличивает активационный барьер при взаимодействии молекул растворителя с исходными веществами и уменьшает энергию активации реакции при сольватации активированного комплекса.
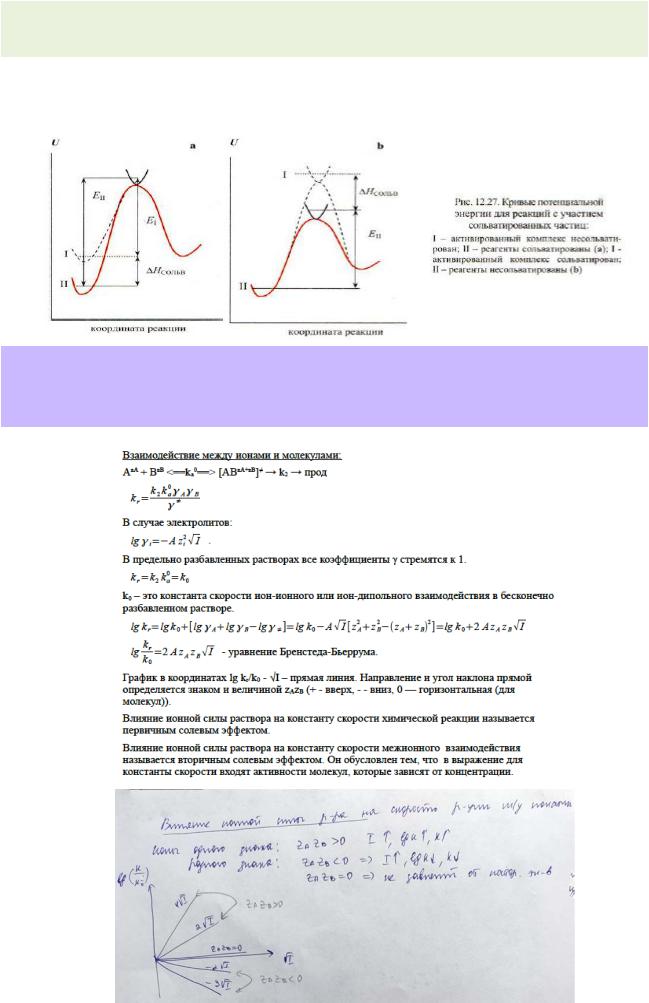
160.Особенности кинетики ионных реакций в разбавленных водных растворах. Уравнение Бренстеда–Бьеррума. Влияние ионной силы раствора на скорость реакции между
ионами. Изобразите схематически график зависимости 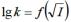 для случая реакции между ионами разного знака.
для случая реакции между ионами разного знака.

161.Влияние ионной силы на константу скорости реакции между ионами в разбавленном жидком растворе. Уравнение Бренстеда-Бьеррума, его графическое представление и пределы применимости.
(см. вопрос 160)
162.Какие реакции называются цепными? В чем заключается различие механизмов неразветвленной и разветвленной цепных реакций? Назовите основные стадии неразветвленной цепной реакции. Получите кинетическое уравнение для данного типа цепной реакции в случае квадратичного обрыва цепи в объеме смеси.
Цепные реакции — это процессы, в которых превращение исходных веществ в продукты осуществляется за счет чередования нескольких реакций с участием свободных радикалов, идущих с сохранением свободной валентности.
У разветвлённых цепных реакций есть стадия разветвления цепи.
163.Назовите основные стадии неразветвленной цепной реакции. Дайте определения понятий «звено цепи» и «средняя длина цепи». Укажите основные механизмы обрыва цепи.
Совокупность всех стадий развития цепи называется звеном цепи. Средней длиной цепи называют среднее число звеньев цепи после одного акта зарождения цепи.

164.Неразветвленные цепные реакции, их основные стадии, особенности механизма. Кинетическое уравнение неразветвлённой цепной реакции при линейном обрыве цепи (на примере).
(см. вопрос 162 и 163)
165.Существуют два основных механизма обрыва цепи в случае цепной реакции в газовой фазе. Назовите эти механизмы и поясните как изменяется вероятность обрыва цепи в соответствии с каждым из них при увеличении: а) общего давления газовой смеси; б) размеров внутреннего пространства реакционного сосуда.
Основные варианты стадий обрыва цепи — линейный обрыв цепи на стенке сосуда в
реакции с адсорбированной примесью или с материалом стенки и квадратичный обрыв цепи в объёме газа. Название «линейный» и «квадратичный» определяются соответствующими формами кинетических кривых

166.Поясните смысл понятий «линейный обрыв цепи» и «квадратичный обрыв цепи». Изменяется ли (и если да, то как?) вероятность обрыва цепи в каждом из двух названных механизмов с увеличением а) общего давления газовой смеси, б) размеров реакционного сосуда?
(см. вопрос 165)
167.В чём заключается метод квазистационарных концентраций Боденштейна? Для каких химических реакций он применяется и с какой целью? При каком условии справедливы выводы, получаемые с его помощью?
Метод квазистационарных концентраций (Боденштейна) — способ анализа кинетических схем сложных химических реакций, использующий условия равенства (приближенного) скоростей образования и расходования промежуточных веществ.
Метод можно применять, если в ходе химической реакции образуются промежуточные вещества, обладающие высокой химической активностью. Исходя из кинетической схемы, для каждого активного промежуточного вещества записывают равенство скоростей образования и расходования. Или, что то же самое, записывают, чему равна производная концентрации промежуточного вещества по времени, и приравнивают это выражение к нулю. В результате, дифференциальные уравнения для концентраций активных промежуточных веществ превращаются в алгебраические. Решая систему алгебраических уравнений, концентрации промежуточных веществ выражают через концентрации устойчивых участников реакции. Их подставляют в формулы для скоростей образования продуктов или расходования исходных веществ, и в итоге получают выражения этих скоростей, не содержащие концентраций промежуточных веществ. Огромное значение метода квазистационарных концентраций в химической кинетике состоит в том, что он позволяет исключить из кинетических уравнений концентрации неустойчивых интермедиатов, определение которых требует специальной техники, а иногда просто невозможно, и получить выражение скорости сложной реакции только через концентрации устойчивых веществ, доступных экспериментальному определению. Это позволяет, сравнивая теоретическое и экспериментальное уравнения скорости, сделать вывод о правильности предложенной кинетической схемы. Используется в последовательных и цепных реакциях.
168.Основные стадии неразветвленной цепной реакции. Рассмотрите на конкретном примере. Дайте определения понятий «звено цепи» и «длина цепи». Какие данные необходимы для нахождения средней длины цепи при прямом фотохимическом инициировании?
(см. вопросы 162-167)
Звено цепи — это совокупность последовательных элементарных актов, из повторения которых складывается цепной процесс.
Длина цепи — это среднее число полных звеньев на стадии продолжения или развития цепи.
Длина цепи — это отношение числа молекул продуктов реакции к числу первоначально возникших активных частиц. Она может быть определена как отношение скорости развития цепи к скорости ее обрыва. Она зависит от давления, формы и размера сосуда (S/V), присутствия посторонних веществ, относящихся к ингибиторам цепных реакций.
Квантовый выход необходим для средней длины цепи при прямом фотохимическом инициировании
169.Разветвлённые цепные реакции в газовой фазе. Предельные явления при протекании разветвленных цепных реакций. Верхний (первый) и нижний (второй) пределы взрыва (воспламенения), их зависимость от различных факторов.
