
2 семестр (+ подготовка к экзу) / Ответы на вопросы экзамена фх 2 семестр
.pdf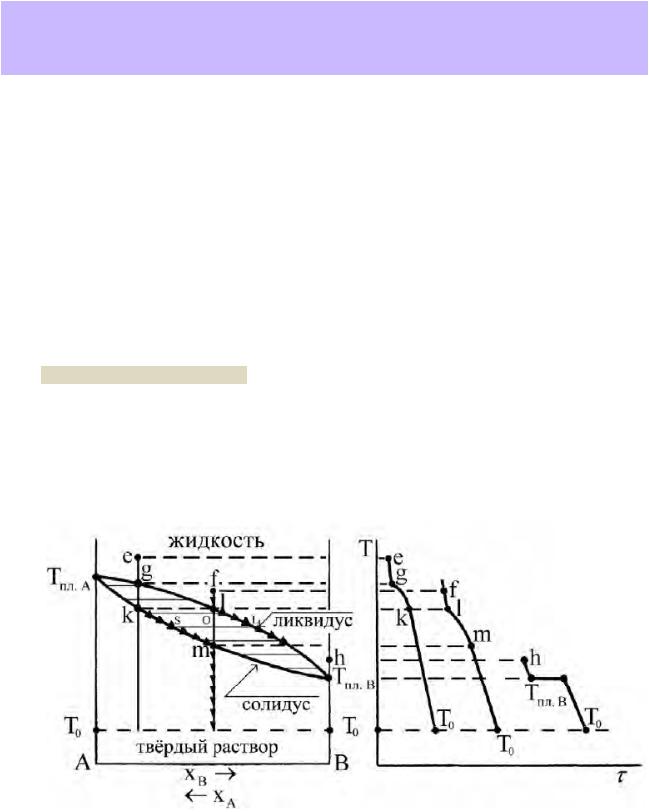
Подготовка к экзамену по физической химии
ФАЗОВОЕ РАВНОВЕСИЕ В ДВУХКОМПОНЕНТНЫХ СИСТЕМАХ – ДИАГРАММЫ ПЛАВКОСТИ
1.Понятие «изоморфизм» («неограниченный изоморфизм»), условия неограниченного изоморфизма. T-x-диаграмма плавкости изоморфной бинарной системы – фазовые поля, линии и особые точки, применение правила фаз Гиббса и правила рычага (проиллюстрируйте на примере).
Изоморфизм — близкое подобие структуры и химической связи двух веществ, при котором они образуют взаимные твёрдые растворы замещения в широком интервале концентраций. В пределе, когда твёрдые растворы замещения образуются при любом соотношении компонентов (т.наз. «неограниченный ряд твёрдых растворов») говорят о «полном» или «неограниченном» изоморфизме.
Условия неограниченного изоморфизма двух веществ:
-Один и тот же тип кристаллической структуры;
-Один и тот же тип химической связи;
-Параметры кристаллической решетки различаются не более чем на 10-15%
Пример изоморфной системы – система NaCl – AgCl (твёрдый раствор замещения с формулой Na1-xAgxCl, где параметр x может принимать любые значения на отрезке от 0 до 1).
Диаграмма плавкости изоморфной системы NaCl – AgCl имеет наиболее простой вид (справочник, рис. 28.6, с.38). На ней мы видим две линии, сходящиеся в точках температур плавления чистых компонентов на боковых осях ординат. Над верхней линией область существования фазы жидкого раствора – расплава. При смещении координатного окна вверх по оси температур область жидкости не простирается безгранично – при p = const может быть достигнуто начало кипения. Под нижней линией расположена область фазы твёрдого раствора Na1-xAgxCl. Между линиями – гетерогенная двухфазная область равновесия насыщенных твёрдого и жидкого растворов (кристаллов и расплава).
Линия ликвидус – геометрическое место точек диаграммы, выражающих состояние насыщенного жидкого раствора, находящегося в равновесии с твёрдым раствором.
Линия солидус – геометрическое место точек диаграммы, выражающих состояние насыщенного твёрдого раствора, находящегося в равновесии с жидким раствором.
Линия сольвус – геометрическое место точек диаграммы, выражающих состояние насыщенного твёрдого раствора, находящегося в равновесии с другим твёрдым раствором.
Правило фаз Гиббса: число степеней свободы f (вариантность состояния) равновесной термодинамической системы, на которую из внешних факторов влияют только p и T, равно числу независимых компонентов минус число фаз плюс два.
При наложении ограничений на параметры состояния (запрещающих их изменение) число степеней свободы уменьшается на количество ограничений:
Правило рычага: отношение чисел моль компонентов в двух равновесных фазах системы равно отношению длин противолежащих (по отношению к точкам фаз) отрезков, на которые делит конноду точка общего состава системы.
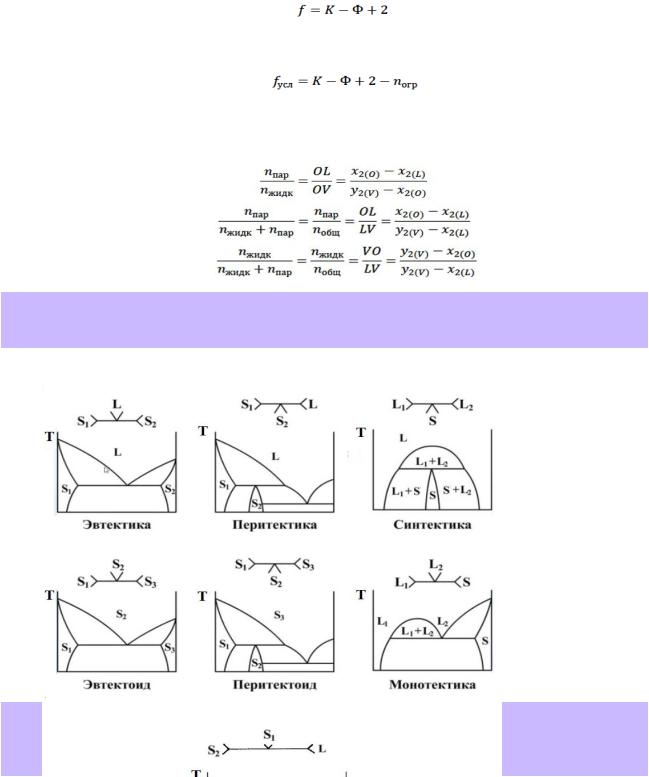
2.T-x-диаграммы плавкости бинарных систем: возможные фазовые равновесия и их выражение на диаграмме, применение правила фаз Гиббса. Шесть основных классов трёхфазных равновесий с участием твёрдых и жидких фаз (наименования, схемы).
(см. вопрос 1)
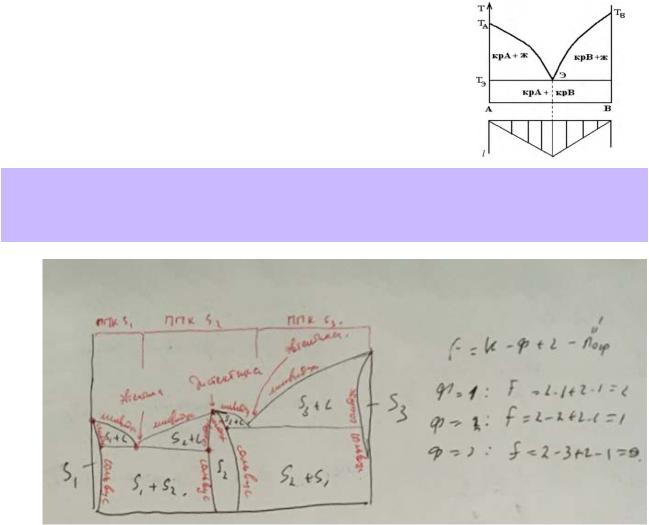
3.Эвтектическое равновесие в бинарной системе: определение, схема порядка фаз, фазовая реакция, протекающая при нагревании или охлаждении, число степеней свободы. Покажите эвтектическое равновесие на диаграммах, приведённых в справочнике (2 – 3 примера), дайте необходимые пояснения.
Эвтектическим равновесием (эвтектикой) в двухкомпонентной системе называется равновесие трёх фаз: двух твёрдых и одной жидкой, при нарушении которого жидкость всегда исчезает с понижением температуры.
(см. вопрос 2)
Фазовая реакция: S1+S2 L; число степеней свободы: f = 3 - Ф

Примеры: системы Al-Si — справочник стр.41 рис. 28.14
4.Перитектическое равновесие в бинарной системе: определение, схема порядка фаз, фазовая реакция, протекающая при нагревании или охлаждении, число степеней свободы. Покажите перитектическое равновесие на диаграммах, приведённых в справочнике (2 – 3 примера), дайте необходимые пояснения.
Перитектическим равновесием (перитектикой) в двухкомпонентной системе называется равновесие трёх фаз: двух твёрдых и одной жидкой, при нарушении которого одна из твёрдых фаз всегда исчезает с повышением температуры.
(см. вопрос 2)
Фазовая реакция: L+S2 S1; число степеней свободы: f = 3 - Ф Примеры: системы Hg-Cd — справочник стр.41 рис. 28.13
5.Монотектическое равновесие в бинарной системе: определение, схема порядка фаз, фазовая реакция, протекающая при нагревании или охлаждении, число степеней свободы. Покажите монотектическое равновесие на диаграммах, приведённых в справочнике, дайте необходимые пояснения.
Монотектика — равновесие жидкой фазы на основе одного компонента с твёрдой и жидкой фазой на основе другого компонента.
(см. вопрос 2)
Фазовая реакция: L1+S L2; число степеней свободы: f = 3 - Ф Примеры: системы Co-Bi — справочник стр.41 рис. 28.15
6.Синтектическое равновесие в бинарной системе: определение, схема порядка фаз, фазовая реакция, протекающая при нагревании или охлаждении, число степеней свободы. Покажите пример синтектического равновесия на диаграмме, дайте необходимые пояснения.
Синтектика — равновесие двух жидких и твёрдой фазы (см. вопрос 2)
Фазовая реакция: S L1+L2; число степеней свободы: f = 3 - Ф Примеры: системы Na-Zn (нет в справочнике)
7.Эвтектоидное равновесие в бинарной системе: определение, схема порядка фаз, фазовая реакция, протекающая при нагревании или охлаждении, число степеней свободы. Покажите пример эвтектоидного равновесия на диаграмме, дайте необходимые пояснения.
Превращение, подобное эвтектическому, происходящее путем распада твердого раствора на смесь из двух фаз называется эвтектоидным.
(см. вопрос 2)
Фазовая реакция: S1+S3 S2; число степеней свободы: f = 3 - Ф Примеры: системы Fe-C (нет в справочнике)
8.Перитектоидное равновесие в бинарной системе: определение, схема порядка фаз, фазовая реакция, протекающая при нагревании или охлаждении, число степеней свободы. Покажите пример перитектоидного равновесия на диаграмме, дайте необходимые пояснения.
Превращение, подобное перетектическому, заключающиеся во взаимодействии двух твердых фаз и образовании новой твердой фазы, называется перитектоидным
(см. вопрос 2)
Фазовая реакция: S3+S2 S1; число степеней свободы: f = 3 - Ф Примеры: системы Ag-Al (нет в справочнике)
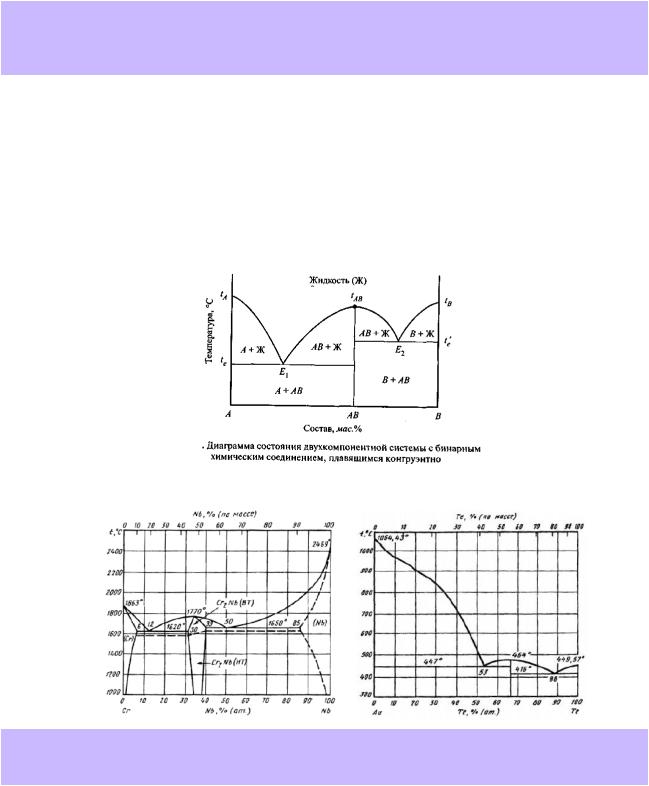
9.T-x-диаграмма плавкости бинарной системы с устойчивым химическим соединением, плавящимся конгруэнтно. Понятие конгруэнтного фазового превращения. Дистектическая точка (дистектика), её положение на диаграмме. Определение химической формулы устойчивого соединения (покажите на примере из справочника).
Устойчивым, плавящимся конгруэнтно называется химическое соединение, область гомогенности которого имеет точку конгруэнтного плавления (т. наз. дистектическую точку или дистектику). Это точка максимума на соприкасающихся линиях солидус и ликвидус, в которой процесс плавления протекает конгруэнтно – без изменения состава. В этой точке система подчиняется второму закону Гиббса-Коновалова: соприкасающиеся линии ликвидус и солидус имеют общую горизонтальную
касательную.
Это можно видеть на примере изоморфной системы LiCl-NaCl (справочник, рис.28.10, с.39)
Ещё примеры:
10.T-x-диаграмма плавкости бинарной системы с неустойчивым химическим соединением, плавящимся инконгруэнтно. Определение химической формулы соединения. Дайте необходимые пояснения на примере подходящей диаграммы из справочника.
Неустойчивым, плавящимся инконгруэнтно называется химическое соединение, область гомогенности которого не имеет точки конгруэнтного плавления. Фазы таких соединений при нагревании разлагаются, чаще всего, по перитектической реакции. В таких случаях верхняя точка области гомогенности фазы соединения лежит на перитектической конноде. Плавление таких соединений всегда протекает инконгруэнтно (не конгруэнтно): состав плавящейся твёрдой фазы отличается от состава образующейся жидкости.
Примером системы с неустойчивым химическим соединением, плавящимся инконгруэнтно, может служить система CsI – InI3 (рис. 17.6). В ней образуется узкая фаза

неустойчивого соединения Cs3InI6, разлагающаяся при нагревании по перитектической реакции на жидкий расплав и твёрдую фазу CsI.
11.Правило рычага – формулировка, вывод, применение. Проиллюстрируйте применение правила рычага на примере диаграммы плавкости бинарной системы (диаграмму выберите в справочнике).
Правило рычага: отношение чисел моль компонентов в двух равновесных фазах системы равно отношению длин противолежащих (по отношению к точкам фаз) отрезков, на которые делит конноду точка общего состава системы.
Правило рычага представляет собой следствие материального баланса системы и действует для любых двухфазных областей плоских диаграмм
Вывод правила рычага на примере равновесия «жидкость-пар»:
Суммарные количества моль компонентов в двух равновесных фазах системы при известных общем составе и составах фаз можно найти при помощи правила рычага
12.Уравнение Шредера (в интегральной форме), условия его применимости. Кривые свободного (спонтанного) охлаждения, их ход в случаях, когда из двухкомпонентного расплава кристаллизуется одна твёрдая фаза или две твёрдые фазы одновременно. Треугольник Таммана.
Уравнение Шредера:
Условия применимости уравнения Шредера:
1.В твердой фазе практически чистое вещество aS=xS=1
2.Поведение компонента в жидкой фазе то же, что и в идеальном растворе aL=xL
3.DплH = const в широком интервале температур
Простейший вариант термического анализа — кривые хода температуры во времени при свободном охлаждении образца после отключения нагревателя (кривые охлаждения). Процесс кристаллизации твердой фазы из жидкого расплава сопровождается выделением теплоты. При свободном охлаждении системы выделяющаяся в ней теплота кристаллизации частично или полностью компенсирует теплоотвод в окружающую среду. При этом на линиях зависимости температуры от времени возникают участки с пониженной скоростью охлаждения или даже температурные остановки.
Общие принципы анализа кривых свободного охлаждения
1.При свободном изобарном охлаждении однофазной системы (жидкого расплава или твёрдого раствора) система бивариантна, никаких эффектов на кривой охлаждения не наблюдается. Скорость охлаждения пропорциональна разности температур системы и окружающей среды и на начальном этапе охлаждения расплава может быть
довольно высокой.
2.В момент начала кристаллизации и в процессе кристаллизации одной твердой фазы из расплава система моновариантна. Скорость охлаждения уменьшается, снижается наклон кривой охлаждения к оси абсцисс. Это происходит в результате выделения теплоты кристаллизации.
3.В условиях инвариантного состояния: при кристаллизации чистых веществ, а также при трёхфазных состояниях, на кривой охлаждения возникают температурные остановки, продолжающиеся до тех пор, пока одна из фаз не исчезнет.
По продолжительности температурной остановки при температуре эвтектики можно уточнять состав эвтектической жидкости. Для этого следует приготовить ряд смесей различного состава с одинаковой общей массой. Провести запись кривых охлаждения и отложить длительность температурной остановки при эвтектической температуре как функцию исходного состава смеси (в массовых %). Это построение называется «треугольник Таммана», вершина треугольника указывает состав эвтектической жидкости.
13.Описание равновесной кристаллизации при изобарном охлаждении бинарной закрытой системы: поля первичной кристаллизации, путь процесса на T-x-диаграмме, кривые охлаждения, правило рычага. Дайте необходимые пояснения на примере диаграммы плавкости бинарной системы (диаграмму выберите в справочнике).

14.Т-х-диаграмма плавкости бинарной системы «A–B» характеризуется следующими особенностями:
●неограниченная взаимная растворимость компонентов в расплавленном состоянии;
●очень малая взаимная растворимость компонентов в твёрдом состоянии;
●температура плавления компонента A меньше температуры плавления, компонента B;
●образуется твердая фаза устойчивого химического соединения стехиометрического состава AB2 (возможны другие варианты формулы), участвующая в эвтектических равновесиях с фазой твердого A и с фазой твердого B;
●температура конгруэнтного плавления соединения AB2 находится в интервале между температурами плавления A и B.
Изобразите схематически описанную выше T-x-диаграмму плавкости системы «A–B», подпишите все фазовые поля, назовите линии и особые точки. Рассчитайте число степеней свободы для всех вариантов фазового равновесия, показанных на диаграмме.
15.Т-х-диаграмма плавкости бинарной системы «A–B» характеризуется следующими особенностями:
●неограниченная взаимная растворимость компонентов в расплавленном состоянии;
●очень малая взаимная растворимость компонентов в твёрдом состоянии;
●температура плавления компонента A больше температуры плавления компонента B;
●в системе образуется неустойчивое химическое соединение состава A3B (возможны другие варианты формулы), разлагающееся по перитектической реакции на твёрдую фазу A и расплав;
●твердая фаза химического соединения состава A3B участвует в эвтектическом равновесии с фазой твердого B.
Изобразите схематически описанную выше T-x-диаграмму плавкости системы «A–B», подпишите все фазовые поля, назовите линии и особые точки. Рассчитайте число степеней свободы для всех вариантов фазового равновесия, показанных на диаграмме.
16.Т-х-диаграмма плавкости бинарной системы «A–B» характеризуется следующими особенностями:
●ограниченная взаимная растворимость компонентов в расплавленном состоянии;
●очень малая взаимная растворимость компонентов в твёрдом состоянии;
●температура плавления компонента A больше температуры плавления компонента B;
●в системе образуется неустойчивое химическое соединение состава A2B (возможны другие варианты формулы), разлагающееся по синтектической реакции;
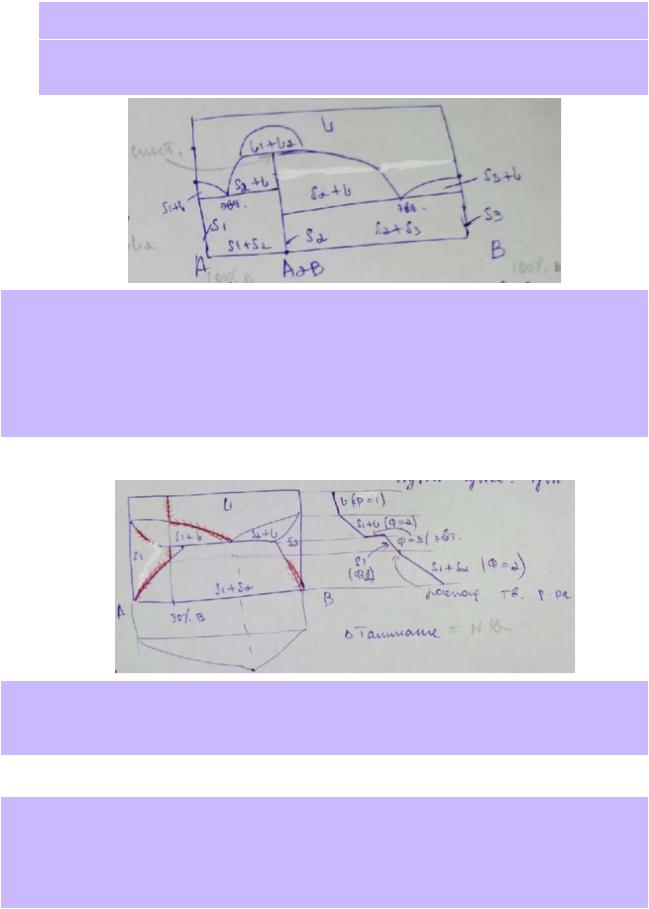
●твердая фаза химического соединения состава A2B участвует в эвтектических равновесиях с фазой твердого A и с фазой твёрдого B.
Изобразите схематически описанную выше T-x-диаграмму плавкости системы «A–B», подпишите все фазовые поля, назовите линии и особые точки. Рассчитайте число степеней свободы для всех вариантов фазового равновесия, показанных на диаграмме.
17.Приведите пример бинарной системы, имеющей диаграмму плавкости с одной эвтектикой (систему выберите в справочнике). Изобразите схематически эту диаграмму, запишите обозначения фазовых областей, и наименования линий. Покажите на диаграмме путь равновесной кристаллизации (изменение составов фаз) для расплава с содержанием одного из компонентов 30%. Укажите точки начала и окончания фазовых превращений и состояние системы на каждом участке процесса, изобразите схематически соответствующую кривую свободного охлаждения, объясните её вид. Треугольник Таммана, условия его получения.
(см. предыдущие вопросы)
18.Как по диаграмме плавкости системы с одной эвтектикой можно оценить значения теплоты плавления компонентов системы? Приведите пример соответствующей системы, запишите и назовите используемое уравнение, получите выражение для теплоты плавления. Назовите все используемые допущения.
По уравнению Шредера. См. вопрос 12.
19.По приведённой в справочнике диаграмме плавкости системы Al – Si (рис. 28.14, стр.40) опишите все фазовые поля, указав вид и число равновесных фаз и число степеней свободы. Изобразите на диаграмме путь равновесной кристаллизации (изменение составов фаз) расплава с концентрацией 20 масс.% алюминия. Укажите температуры начала и окончания фазовых превращений, а также фазовый состав системы на каждом участке. Изобразите схематически соответствующую кривую охлаждения.
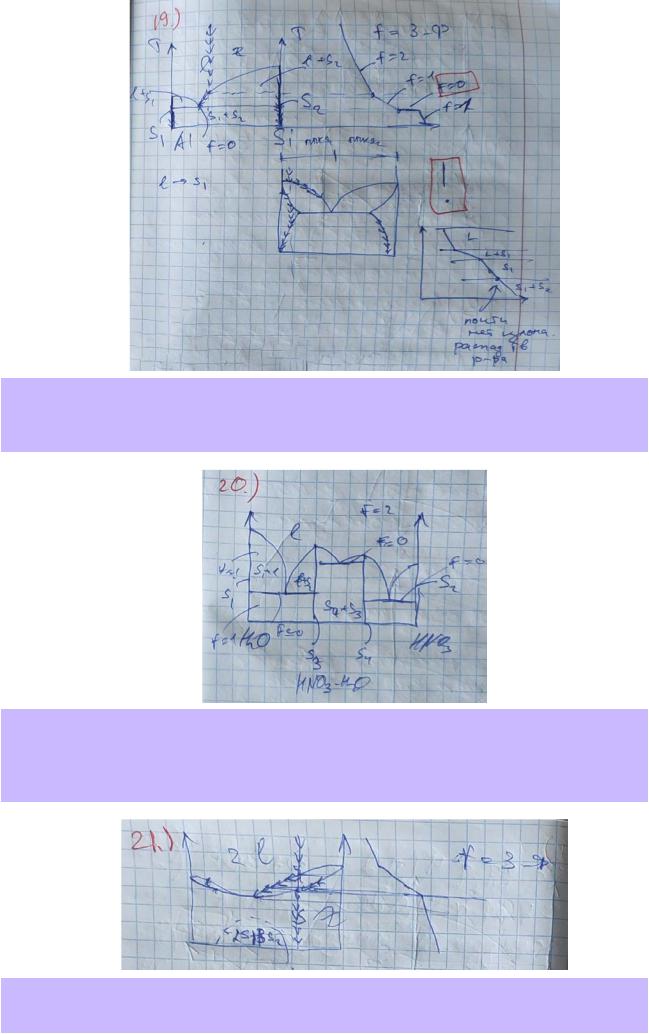
20.По приведённой в справочнике диаграмме плавкости системы H2O – HNO3 (рис.28.21, стр.41) опишите все фазовые поля, указав вид и число равновесных фаз и число степеней свободы. Если в системе образуются химические соединения, укажите их формулы и дайте их краткую характеристику.
21.По приведённой в справочнике диаграмме плавкости системы LiCl – NaCl (рис. 28.10, стр. 39) опишите все фазовые поля, указав вид и число равновесных фаз и число степеней свободы. Изобразите схематически на диаграмме путь процесса (изменение составов фаз) при изобарном (давление 1атм) нагревании от 300оС до 800оС раствора с концентрацией 70 мольн.% NaCl.
22.По приведённой в справочнике T-x-диаграмме плавкости системы Na – K для давления P=1 атм (рис. 28.22, стр.41) опишите все фазовые поля, указав вид и число равновесных фаз и число степеней свободы. Если в системе образуются химические соединения,
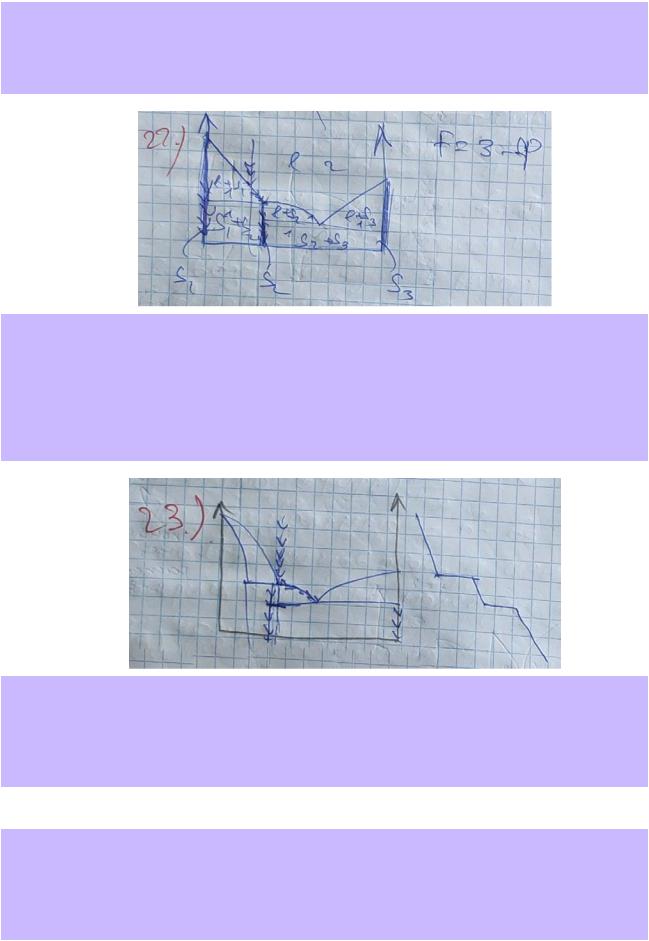
укажите их формулы и дайте их краткую характеристику. Изобразите на диаграмме путь равновесной кристаллизации (изменение составов фаз) расплава с концентрацией натрия 20 мольн%. Укажите температуры начала и окончания фазовых превращений, а также фазовый состав системы на каждом участке. Изобразите схематически соответствующую кривую охлаждения.
23.По приведённой в справочнике диаграмме плавкости системы Ag – Sb (рис.28.25, стр.42) опишите все фазовые поля, указав вид и число равновесных фаз и число степеней свободы. Если в системе образуются химические соединения, укажите их формулы и дайте их краткую характеристику. Изобразите на диаграмме путь равновесной кристаллизации (изменение составов фаз) расплава с концентрацией 30 масс% серебра. Укажите температуры начала и окончания фазовых превращений, а также фазовый состав системы на каждом участке. Изобразите схематически соответствующую кривую охлаждения.
24.По приведённой в справочнике диаграмме плавкости системы KBr–CuBr (рис. 28.23, стр. 41) опишите все фазовые поля, указав вид и число равновесных фаз и число степеней свободы. Если в системе образуются химические соединения, укажите их формулы и дайте их краткую характеристику. Изобразите на диаграмме путь равновесной кристаллизации (изменение составов фаз) при медленном изобарном (давление 1 атм)
охлаждении от 700оС до 100оС расплава с концентрацией 20 мольн.% CuBr.
Выполнить по аналогии с предыдущими вопросами.
25.По приведённой в справочнике T-x-диаграмме плавкости системы Co–Bi (рис. 28.15, стр.40) опишите все фазовые поля, указав вид и число равновесных фаз и число степеней свободы. Изобразите на диаграмме путь процесса (изменение составов фаз) при медленном охлаждении расплава с концентрацией 20 масс% Bi от 1500 оС до 200 оС. Укажите температуры начала и окончания фазовых превращений, а также фазовый состав системы на каждом участке.
Выполнить по аналогии с предыдущими вопросами.
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
