
304-_Organicheskaya_khimia_Chernykh_V_P_i_dr_Kh__2007_-776s
.pdf
глава 24
КарБОнОвые КислОТы. МОнОКарБОнОвые КислОТы
Карбоновыми кислотами называют производные углеводородов, содержащие
всвоем составе одну или несколько карбоксильных групп —COOH.
взависимости от природы углеводородного радикала, связанного с карбоксильной группой, различают алифатические (насыщенные и ненасыщенные),
алициклические и ароматические карбоновые кислоты. в соответствии с числом карбоксильных групп кислоты подразделяют на монокарбоновые, дикарбоновые,
трикарбоновые и поликарбоновые.
24.1. насыЩенные МОнОКарБОнОвые КислОТы
Насыщенными монокарбоновыми кислотами называют производные предель-
ных углеводородов, содержащие в своем составе одну карбоксильную группу
—соон.
общая формула: сnH2n+1COOH.
24.1.1. нОменКлаТУра. ИЗОмерИя
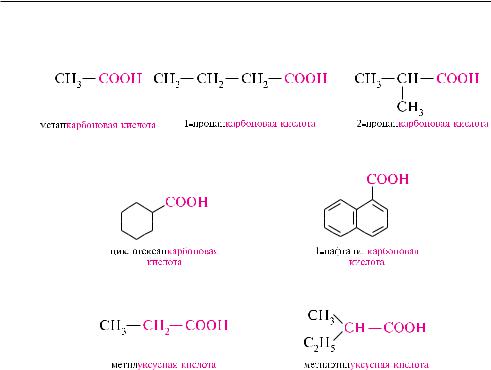
в названиях карбоновых кислот широко используют тривиальную номенклатуру: H—COOH — муравьиная кислота, CH3—COOH — уксусная кислота, CH3—CH2—COOH — пропионовая и т. д. Положение заместителей по отношению к карбоксильной группе в тривиальных названиях обозначают греческими буквами и др.:
По заместительной номенклатуре IUPAC названия карбоновых кислот образуют из названий углеводородов, включая и атом углерода карбоксильной группы, к которым прибавляют суффикс -овая кислота. нумерацию главной углеродной цепи начинают с атома углерода карбоксильной группы:
КарБОнОВЫе КИСлОТЫ. мОнОКарБОнОВЫе КИСлОТЫ
425
иногда названия карбоновых кислот образуют от названия углеводорода, содержащего в качестве заместителя карбоксильную группу, и словосочетания
-карбоновая кислота:
данный способ чаще применяют в случаях, когда карбоксильная группа связана с циклической структурой.
По рациональной номенклатуре насыщенные монокарбоновые кислоты рассматривают как производные уксусной кислоты:
названия некоторых монокарбоновых кислот приведены в табл. 24.1.
|
|
|
|
|
Таблица 24.1. |
|
названия насыщенных монокарбоновых кислот |
|
|||
|
|
|
|
|
|
формула |
|
|
название кислоты по номенклатуре |
||
|
|
|
|
|
|
|
тривиальной |
|
заместительной |
рациональной |
|
|
|
|
|||
|
|
|
|
|
|
нсоон |
|
Муравьиная |
|
Метановая |
— |
|
|
|
|
|
|
сн3соон |
|
уксусная |
|
Этановая |
уксусная |
|
|
|
|
|
|
сн3сн2соон |
|
Пропионовая |
|
Пропановая |
Метилуксусная |
|
|
|
|
|
|
сн3сн2сн2соон |
|
Масляная |
|
бутановая |
Этилуксусная |
|
|
|
|
|
|
(CH3)2CHCOOH |
|
изомасляная |
|
2-Метилпропановая |
диметилуксусная |
сн3сн2сн2сн2соон |
|
валериановая |
|
Пентановая |
Пропилуксусная |
(CH3)2CHCH2COOH |
|
изовалериановая |
|
3-Метилбутановая |
изопропилуксусная |
CH3CH2сн(CH3)COOH |
|
-Метилмасляная |
|
2-Метилбутановая |
Метилэтилуксусная |
|
|
|
|
|
|
сн3(сн2)4соон |
|
капроновая |
|
Гексановая |
бутилуксусная |
|
|
|
|
|
|
сн3(сн2)10соон |
|
лауриновая |
|
додекановая |
— |
|
|
|
|
|
|
сн3(сн2)12соон |
|
Миристиновая |
|
тетрадекановая |
— |
|
|
|
|
|
|
сн3(сн2)14соон |
|
Пальмитиновая |
|
Гексадекановая |
— |
сн3(сн2)16соон |
|
стеариновая |
|
октадекановая |
— |
сн3(сн2)18соон |
|
арахиновая |
|
Эйкозановая |
— |
Глава 24
42
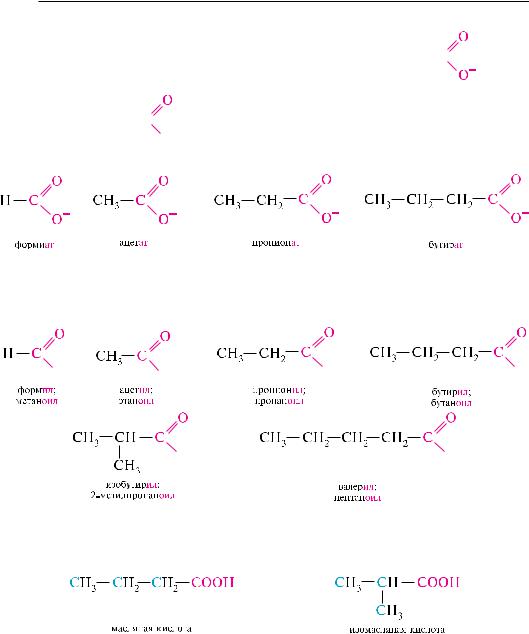
остаток карбоновой кислоты, образующийся в результате удаления атома во-
дорода от карбоксильной группы, называется ацилоксигруппой 
 , а оста-
, а оста-
ток, образующийся в результате удаления гидроксильной группы, называется
ацильной группой 

 .
.
названия ацилоксигрупп обычно образуют из тривиальных латинских названий кислот и суффикса -ат:
названия ацильных групп образуют из тривиальных латинских названий кислот и суффикса -ил. По заместительной номенклатуре IUPAC названия ацильных групп образуют от названия кислоты, заменяя суффикс -овая кислота на суффикс
-оил:
изомерия насыщенных монокарбоновых кислот обусловлена разной структурой углеводородного радикала, связанного с карбоксильной группой. Первые три представителя гомологического ряда изомеров не имеют. четвертый гомолог существует в виде двух структурных изомеров:
с увеличением количества углеродных атомов в молекуле карбоновой кислоты количество структурных изомеров резко возрастает.
24.1.2. СПОСОБЫ ПОлУЧенИя
существует множество способов получения карбоновых кислот.
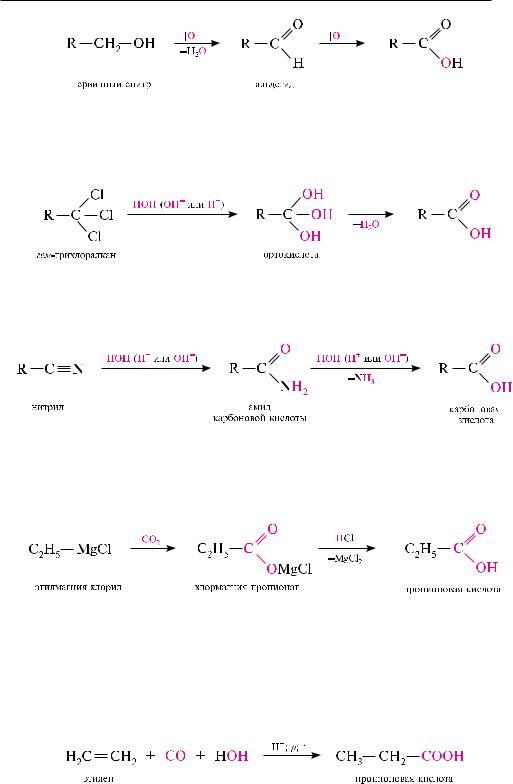
Окисление первичных спиртов и альдегидов (см. с. 344). Первичные спирты окисляются до карбоновых кислот через стадию образования альдегида. в качестве окислителей используют K2Cr2O7, KMnO4, HNO3 и др.:
КарБОнОВЫе КИСлОТЫ. мОнОКарБОнОВЫе КИСлОТЫ
427
Гидролиз геминальных тригалогенопроизводных углеводородов. реакция проте-
кает в кислой или щелочной среде. в качестве промежуточного соединения образуется ортокислота, которая отщепляет молекулу воды и превращается в карбоновую кислоту:
Гидролиз нитрилов. При нагревании нитрилов с водными растворами кислот или щелочей они подвергаются гидролизу с образованием карбоновых кислот. в качестве промежуточных продуктов реакции образуются амиды кислот:
Карбоксилирование магнийорганических соединений. При действии на маг-
нийорганические соединения (реактивы Гриньяра) углерода (IV) оксидом образуются соли карбоновых кислот, из которых в кислой среде выделяют соответствующие кислоты:
Окисление алканов. Метод используется в промышленности для получения многих карбоновых кислот. При окислении алканов кислородом воздуха в присутствии катализатора образуется смесь карбоновых кислот, которую затем разделяют. реакция сопровождается разрывом углерод-углеродных связей (см. с. 142).
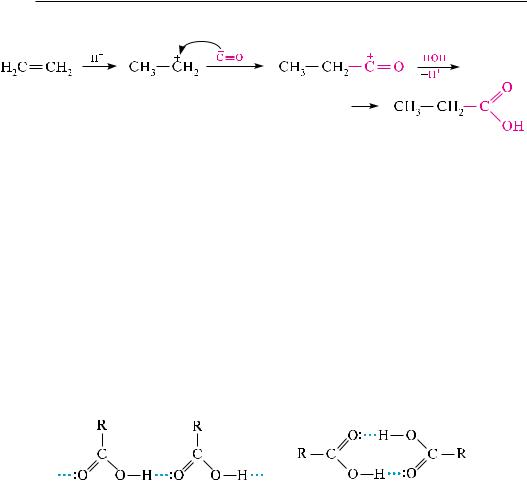
Гидрокарбонилирование алкенов. алкены с углерода (II) оксидом и водой в присутствии кислотного катализатора при нагревании и давлении образуют карбоновые кислоты:
Глава 24
428
Механизм реакции:
Метод применяют в промышленности для получения ряда кислот.
24.1.3. ФИЗИЧеСКИе СВОЙСТВа
низшие карбоновые кислоты состава с1—с3 в обычных условиях представляют собой легкоподвижные жидкости с острым запахом. кислоты состава с4—с9 — маслянистые жидкости с неприятным запахом, напоминающим запах пота. карбоновые кислоты с количеством атомов углерода 10 и выше являются твердыми веществами. Муравьиная, уксусная и пропионовая кислоты смешиваются с водой в любых соотношениях. с увеличением молекулярной массы кислот растворимость в воде сильно снижается. высшие карбоновые кислоты не растворимы в воде. температуры кипения кислот значительно выше температур кипения спиртов с тем же количеством атомов углерода (табл. 24.2). Это свидетельствует о том, что кислоты более ассоциированы, чем спирты. в отличие от спиртов, для которых характерны только линейные ассоциаты, карбоновые кислоты, вследствие образования межмолекулярных водородных связей, образуют как линейные, так и циклические ассоциаты (димеры):
|
|
|
Таблица 24.2 |
|
Физические характеристики насыщенных монокарбоновых кислот |
|
|||
|
|
|
|
|
соединение |
название кислоты |
температура, °с |
||
|
|
|||
плавления |
кипения |
|||
|
|
|||
|
|
|
|
|
нсоон |
Муравьиная |
8,4 |
100,7 |
|
|
|
|
|
|
сн3соон |
уксусная |
16,7 |
118,1 |
|
сн3сн2соон |
Пропионовая |
–22,4 |
141,1 |
|
сн3сн2сн2соон |
Масляная |
–7,9 |
163,5 |
|
(CH3)2снсоон |
изомасляная |
–47,0 |
154,4 |
|
сн3сн2сн2сн2соон |
валериановая |
–34,5 |
187,0 |
|
(CH3)2снсн2соон |
изовалериановая |
–37,6 |
176,7 |
|
сн3(сн2)4соон |
капроновая |
–1,5 |
205,3 |
|
сн3(сн2)14соон |
Пальмитиновая |
64,0 |
271,5 (100 мм) |
|
сн3(сн2)16соон |
стеариновая |
70,0 |
291 (110 мм) |
|
КарБОнОВЫе КИСлОТЫ. мОнОКарБОнОВЫе КИСлОТЫ
42
24.1.4. хИмИЧеСКИе СВОЙСТВа
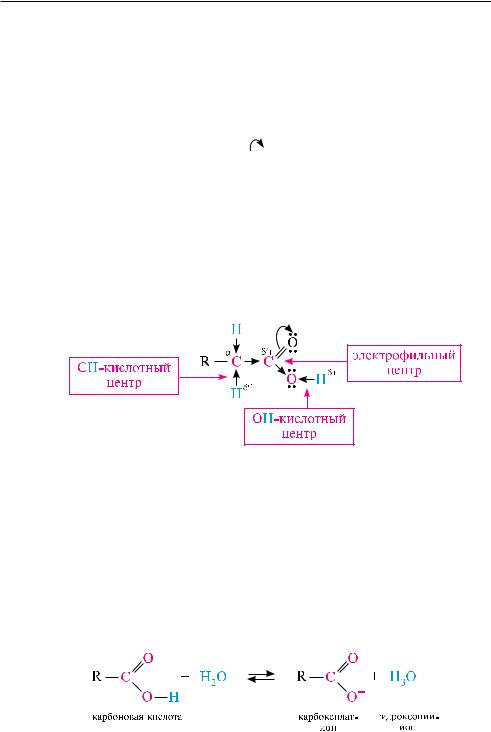
реакционная способность карбоновых кислот определяется в основном наличием в их структуре карбоксильной группы. карбоксильная группа представляет собой сопряженную систему, в которой неподеленная пара электронов атома кислорода гидроксильной группы вступает в сопряжение с -электронами карбонильной группы (p, -сопряжение). вследствие +М-эффекта со стороны группы
—он электронная плотность в сопряженной системе смещена в сторону атома кислорода карбонильной группы  , неподеленные пары электронов кото-
, неподеленные пары электронов кото-
рого не участвуют в сопряжении. в результате смещения электронной плотности связь о—н оказывается сильно поляризованной, что приводит к появлению в карбоксильной группе он-кислотного центра. но в то же время за счет +М-эффек- та со стороны группы —он в молекулах карбоновых кислот в некоторой степени уменьшается частичный положительный заряд на атоме углерода карбонильной группы по сравнению с альдегидами и кетонами. кроме того, вследствие –I-эф- фекта карбоксильной группы в молекуле карбоновой кислоты происходит смещение электронной плотности с углеводородного остатка, что приводит к появлению с—н-кислотного центра у -углеродного атома:
исходя из приведенного строения карбоновых кислот, основные их реакции можно условно разделить на четыре группы:
реакции с участием связи о—н (кислотные свойства);
реакции нуклеофильного замещения с участием атома углерода карбоксильной группы;
замещение атомов водорода у -углеродного атома;
окисление и восстановление.
КИСлОТнЫе СВОЙСТВа
кислотные свойства карбоновых кислот обусловлены их способностью отщеплять атом водорода карбоксильной группы в виде протона.
вводных растворах карбоновые кислоты диссоциируют:
впроцессе диссоциации образуется карбоксилат-ион, в котором оба атома кислорода равноценны, а отрицательный заряд равномерно делокализован между ними. делокализацию заряда в карбоксилат-ионе можно представить в виде двух

