
304-_Organicheskaya_khimia_Chernykh_V_P_i_dr_Kh__2007_-776s
.pdf
амины |
|
|
|
|
|
|
|
|
|
313 |
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
+ |
|
|
H |
|
|
||
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
||
NH Cl– |
–ClH N |
|
|
|
|
|
|
|||
|
N |
|
|
|
||||||
3 |
|
|
3 |
|
H2C |
|
|
|
||
CH2 |
+ |
|
CH2 t |
|
CH2 |
•2HCl |
+ 2NH4Cl |
|||
CH2 |
|
CH2 |
|
H2C |
|
CH2 |
||||
|
|
|
|
|
|
|||||
+ |
– |
– |
+ |
|
|
N |
|
|
|
|
NH3Cl |
|
|
ClH3N |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
H |
|
|
|
|
пиперазина дигидрохлорид
о-Фенилендиамин вступает в реакции конденсации с α-диальдегидами, дикетонами, альдегидо- и кетокислотами, а также карбоновыми кислотами, образуя гетероциклические продукты. Так, при конденсации о-фенилендиамина с глиоксалем образуется хиноксалин:
N H2 |
|
O |
Í |
N |
|
+ |
C |
|
+ 2H2O |
|
O C |
|
||
N H2 |
|
Í |
N |
|
î-фенилендиамин |
|
глиоксаль |
хиноксалин |
|
В процессе конденсации с карбоновыми кислотами образуются производные бензимидазола:
N H2 |
O |
|
4 |
N |
|
|
||||
+ |
C ÑÍ3 |
6 |
3 |
Ñ ÑÍ |
+ 2H O |
|||||
|
2 |
|||||||||
|
|
|
|
|
5 |
7 |
1 |
3 |
2 |
|
|
|
|
|
|
|
|||||
N H |
ÍO |
|
|
N |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
|
|
H |
|
|
||
î-фенилендиамин |
|
|
|
2-метилбензимидазол |
|
|||||
20.5. ИДЕНТИФИКАЦИЯ АМИНОВ
20.5.1. химические меТоды
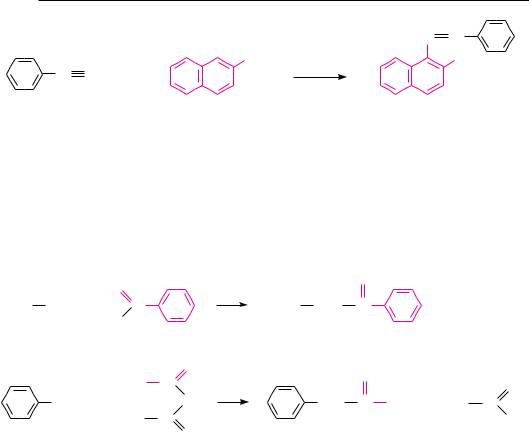
Первичные алифатические и ароматические амины можно обнаружить с помощью изонитрильной реакции (см. с. 301) по характерному неприятному запаху образующихся изонитрилов:
R |
|
NH2 + CHCl3 + 3NaOH |
+ |
|
C– + 3NaCl + 3H2O |
|||
|
|
R |
|
N |
|
|||
|
|
|
|
|||||
|
|
|
|
|||||
|
|
|
изонитрил |
|||||
Для обнаружения первичных ароматических аминов используют реакцию диазотирования (см. с. 318) с последующей конденсацией образовавшейся соли диазония с β-нафтолом (см. реакцию азосочетания, с. 324). Образуется азокраситель оранжево-красного цвета:
NH |
|
NaNO2 + HCl (èçá.) |
+ |
|
NCl– |
2 |
|
N |
|
||
–NaCl; –H2Î |
|
||||
|
|||||
|
|
|
|
бензолдиазония хлорид
Глава 20
314
|
|
N N |
+ |
OH |
ONa |
N |
NCl– + |
2NaÎÍ |
|
|
–NaCl; |
|
β-нафтол |
–H2O |
|
азокраситель; |
|
|
|
натрия 1-(бензолазо)-2-нафтолят |
Первичные, вторичные и третичные амины алифатического и ароматического рядов можно отличить друг от друга реакцией с азотистой кислотой (см. с. 300
и 306).
Идентификацию первичных и вторичных аминов часто осуществляют через образование N-ацильных производных. Причем для характеристики алифатических аминов обычно получают N-бензоильные производные, для ароматических — N-ацетильные. Бензоильные производные легко образуются при обработке аминов бензоилхлоридом, а ацетильные — действием уксусного ангидрида:
|
|
O |
|
|
O |
|
C2H5 NH2 |
+ |
|
|
|
|
|
Ñ |
|
C2H5 NH |
Ñ |
+ HCl |
||
|
|
Cl |
|
|
|
|
|
|
бензоилхлорид |
этиламид бензойной кислоты |
|
||
|
|
|
O |
|
O |
|
|
|
CH3 |
C |
|
O |
|
|
|
|
|
|||
NH2 |
+ |
CH3 |
O |
NH |
Ñ CH3 |
+ CH3 C |
|
|
C |
ацетанилид |
OH |
||
|
|
|
O |
|
||
|
|
|
|
|
|
|
N-Ацильные производные аминов представляют собой кристаллические вещества с четкими температурами плавления.
20.5.2.Физические меТоды
ВИК-спектрах аминов наблюдаются полосы поглощения, обусловленные валентными колебаниями связи C–N. В алифатических аминах vC—N проявляются
вобласти 1230—1030 см–1, в ароматических — 1300—1250 см–1. ИК-Спектры пер-
вичных и вторичных аминов имеют полосы поглощения в области 3550—3320 см–1, отвечающие валентным колебаниям связи N—H. У первичных аминов в этой области имеются две полосы поглощения, а у вторичных — одна. Образование
межмолекулярных водородных связей приводит к смещению полос поглощения связи N—H в область 3330—3000 см–1.
Метод УФ-спектроскопии применяется в основном для идентификации ариламинов. Алифатические амины поглощают УФ-излучение в дальней ультрафиолетовой области, которая малодоступна для измерения. Наличие в молекуле ариламина аминогруппы, связанной с бензольным ядром, приводит к значительному смещению полосы бензольного поглощения в длинноволновую область и увеличению ее интенсивности.
Так, в УФ-спектре анилина бензольная полоса проявляется при λmax = 280 нм
(ε = 1430).


316 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Глава 20 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
|
|
CH2 |
|
|
CH2 |
|
CH2 |
|
CH2 |
|
CH |
|
COOH |
|
|
|
CH2 |
|
CH2 |
|
CH2 |
|
CH2 |
|
CH2 |
|
|
|
|
|
|
|
|
|
–CO2 |
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||
|
|
NH2 |
|
NH2 |
NH2 |
кадаверин |
|
|
|
NH2 |
||||||||||||||||
лизин |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
Кадаверин, как и путресцин, образуется при гнилостном разложении трупов
и принадлежит к группе птомаинов. |
|
|||||
|
|
|
|
|
|
Бензогексоний ([1,6-бис-(N-триме- |
|
H3C |
+ |
CH3 |
|
тиламмоний)-гексана дибензолсуль- |
|
+ |
CH3 |
— |
фонат], или N,N'-гексаметил-1,6- |
|||
|
H3C N |
(CH2)6 N |
2C6H5SO3 |
гексаметилендиаммония дибензол- |
||
|
H3C |
|
CH3 |
|
сульфонат). Белое кристаллическое |
|
|
|
|
|
|
|
вещество (т. пл. 196—202 °С), легко |
растворяется в воде. Применяется в медицине как ганглиоблокирующее и гипотензивное средство.

Глава 21
ДИАЗО- И АЗОСОЕДИНЕНИЯ
21.1 ДИАЗОСОЕДИНЕНИЯ
Диазосоединениями называют органические вещества, содержащие в своей структуре группировку из двух атомов азота, связанную с углеводородным радикалом и остатком минеральной кислоты.
Общая формула диазосоединений:
RN2X,
где R — углеводородный радикал;
X — остаток минеральной кислоты (Cl–, Br–, NO3–, HSO4–, OH–, CN–, SO3H–, SH– и др.).
В зависимости от природы углеводородного радикала различают алифатические и ароматические диазосоединения. В этой главе рассмотрены ароматические диазосоединения, имеющие большое практическое значение в синтезе красителей, лекарственных препаратов, в фармацевтическом анализе и др.
Общая формула ароматических диазосоединений:
Ar—N2X.
В зависимости от природы кислотного остатка (аниона) связь между Ar—N2 и X может быть ионной или ковалентной. Если X — остаток сильной минеральной
кислоты (Cl–, Br–, HSO–, NO– и др.), то диазосоединения имеют ионное строение |
|
4 |
3 |
|
+ |
и их называют соли диазония Ar—N—NX–. Если же X — остаток слабой мине- |
|
ральной кислоты (CN–, HSO–, ОН–, SH– и др.), диазосоединения имеют ковалент- |
|
ное строение Ar—N—N—X. |
3 |
|
|
Диазосоединения общей формулы Ar—N—N—O–M+, где M — металл, по- |
|
лучили название «диазотаты». В растворе указанные формы диазосоединений,
взависимости от pH среды, могут превращаться друг в друга. В кислой среде диазосоединения существуют в форме солей диазония, в среде, близкой к нейтральной, имеют ковалентное строение, а в щелочной среде находятся в форме диазотатов. Так, при действии на соль диазония водного раствора натрия гидроксида
внейтральной среде образуется диазосоединение ковалентного строения (диазогидроксид), которое в щелочной среде превращается в диазотат. И наоборот, под действием хлороводородной кислоты диазотат в нейтральной среде переходит
вдиазогидроксид, а в кислой среде образует соль диазония:
кислая среда |
|
|
|
нейтральная среда |
|
|
|
|
щелочная среда |
|||||||||||||||||
|
+ |
|
NCl– |
|
NaÎÍ |
|
|
|
|
|
|
|
|
|
NaÎÍ |
|
|
|
|
|
|
|
|
– |
||
Ar |
|
|
N |
|
|
|
|
Ar |
|
N |
|
N |
|
OH |
|
|
|
Ar |
|
|
N |
|
N |
|
O Na+ |
|
|
|
|
|
HCl |
|
|
|
|
|
HCl |
|
|
|
|
|
|||||||||||
|
соль диазония |
|
арилдиазогидроксид |
|
|
|
натрия арилдиазотат |
|||||||||||||||||||
|
|
|
|
|
|
|
||||||||||||||||||||

Глава 21
318
21.1.1. номенкЛаТура. изомериЯ
Согласно номенклатурным |
правилам |
||||||||||||||||||||||||||
IUPAC, названия ароматических диазосо- |
|||||||||||||||||||||||||||
единений образуют путем добавления к на- |
|||||||||||||||||||||||||||
званию |
исходного углеводорода |
суффикса |
|||||||||||||||||||||||||
-диазо-,аназваниясолейдиазония — добавле- |
|||||||||||||||||||||||||||
нием окончания -диазоний с последующим |
|||||||||||||||||||||||||||
указанием аниона: |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
N |
|
|
|
|
OH |
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
|
бензолдиазогидроксид; |
|
|
||||||||||||||||||||||||
иоганн Петер грисс |
диазогидрат |
|
|
|
|
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(1829—1888) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Немецкий химик-органик. Основ- |
Cl |
|
|
|
|
|
|
|
|
|
N |
|
|
|
|
N |
|
CN |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
ные научные работы относятся к хи- |
4-хлорбензолдиазоцианид |
|
|||||||||||||||||||||||||
мии азотсодержащих органических |
|
||||||||||||||||||||||||||
соединений. Впервые получил (1857) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
диазосоединения и предложил термин |
|
|
|
|
|
|
|
|
|
|
|
|
+ |
|
|
|
|
|
NBr– |
|
|||||||
«диазо». Открыл реакцию диазотиро- |
CH3 |
|
|
|
|
|
|
|
|
N |
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
вания ароматических аминов азотис- |
4-метилбензолдиазония бромид |
|
|||||||||||||||||||||||||
той кислотой в среде минеральной |
|
||||||||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
кислоты. Предложил (1864) способ |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
восстановления диазосоединений. По- |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
– |
|
||
лучил (1864) новый тип красителей — |
|
|
|
|
|
|
|
N |
|
|
N |
|
|
ONa+ |
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||||||||
азокрасители. Открыл красители, ис- |
|
|
нартия бензолдиазоòàò |
|
|||||||||||||||||||||||
пользуемые для крашения хлопка. |
|
|
|
||||||||||||||||||||||||
Ковалентнопостроенные диазосоединения могут существовать в виде двух геометрических изомеров — син-(цис-) и анти-(транс-), из которых более устойчивой является анти-форма (см. с. 87):
N |
N |
X |
N N |
||
Ar |
X |
Ar |
ñèí-диазосоединение |
àíòè-диазосоединение |
|
|
||
21.1.2. сПосоБы ПоЛучениЯ соЛеЙ арендиазониЯ
реакция диазотирования. Реакция, открытая в 1858 году немецким химиком Иоганном Петером Гриссом, основана на взаимодействии первичных ароматических аминов с азотистой кислотой в среде сильной минеральной кислоты, чаще хлороводородной или серной. Поскольку сама азотистая кислота очень неустойчива, обычно на практике ароматический амин обрабатывают раствором соли азотистой кислоты (NaNO2, KNO2) в присутствии сильной минеральной кислоты, причем на один моль амина используют не менее 2,5 моль минеральной кислоты. Один моль минеральной кислоты расходуется на получение азотистой кислоты, другой — на образование соли диазония, а избыток кислоты необхо-


 C CH
C CH N + 4
N + 4
 NH.
NH. N
N N
N
 ..
..