
- •Предмет, задачи общей и неорганической химии. Роль химии в естественных науках.
- •Основные понятия химии
- •Основные понятия химии.
- •Основные стехиометрические законы.
- •Газовые законы: г. Люссака, Авогадро, объединенный газовый закон.
- •Строение атома; развитие учения о строении атома; модели Томсона, Резерфорда, Бора.
- •Характеристика основных квантовых чисел.
- •Важнейшие классы и номенклатура неорганических веществ.
- •Периодический закон и периодическая система элементов.
- •Ковалентная химическая связь. Способы образования ковалентной связи. Основные характеристики.
- •Геометрия структур с ковалентным типом связи (гибридизация sp, sp2, sp3)
- •Метод валентных связей и метод молекулярных орбиталей.
- •Ионная и металлическая связь.
- •Межмолекулярное взаимодействие. Водородная связь.
- •Кристаллическое, жидкое и аморфное состояние веществ.
- •Скорость химических реакций. Константа скорости и ее физические свойства
- •Влияние температуры на скорость химических реакций. Основные положения теории активации Аррениуса.
- •Катализ. Влияние катализаторов на скорость химических реакций.
- •Необратимые и обратимые реакции. Принцип Ле Шателье.
- •Дисперсные системы и их характеристика.
- •3. По агрегатному состоянию дисперсионной среды и дисперсной фазы.
- •Способы выражения концентрации растворов.
- •Энергетика химических связей. Характеристика систем. Функции состояния.
- •Внутренняя энергия. Энтальпия и энтропия.
- •Энергия Гиббса.
- •Закон Генри. Законы Рауля.
- •Осмотическое давление. Закон Ван-Гоффа.
- •Особенности растворов электролитов. Основные положения электролитической диссоциации.
- •Буферные растворы и их характеристика. Уравнение Гендерсона-Хассельбаха.
- •Ионное произведение воды. Водородный показатель.
- •Произведение растворимости. Реакции обмена в растворах электролитов.
- •Гидролиз солей. Количественные характеристики гидролиза.
- •Теория овр. Важнейшие окислители и восстановители. Метод электронного баланса.
- •Ионно-электронный метод (метод полуреакций).
- •Классификация овр.
- •Электрохимические процессы. Электронный потенциал. Водородный электрод.
- •Электрохимический ряд напряжения металлов. Уравнение Нернста.
- •Гальванический элемент и его влияние на протекание овр.
- •Электролиз растворов и расплавов.
- •Комплексные соединения. Номенклатура и классификация.
- •Константа устойчивости и константа неустойчивости (характеристика кс)
Характеристика основных квантовых чисел.
Четыре квантовых числа описывают состояние электрона в атоме, характеризуют его энергию, спин, формулу электронного облака и его ориентацию в пространстве.
Главное квантовое число – n:
определяет энергетический уровень электрона, удалённость энергетического уровня от ядра и размер электронного облака. Главное квантовое число принимает любые целочисленные значения, начиная с n=1 (n=1,2,3,…) и соответствует номеру периода.
Орбитальное квантовое число – L:
определяет геометрическую форму атомной орбитали. Имеет значения от 0,1,2,3…(n-1). Независимо от номера энергетического уровня, каждому значению орбитального квантового числа соответствует орбиталь особой формы. “Набор” таких орбиталей с одинаковыми значениями главного квантового числа называется энергетическим уровнем. Каждому значению орбитального квантового числа соответствует орбиталь особой формы.
0=s, 1=p, 2=d, 3=f
Магнитное квантовое число - m:
определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Магнитное квантовое число принимает любые целочисленные значения от -l до +l, включая 0.
Для s-орбитали:
l=0, m=0 - одна равноценная ориентация в пространстве (одна орбиталь).
Для p-орбитали:
l=1, m=-1,0,+1 - три равноценные ориентации в пространстве (три орбитали).
Для d-орбитали:
l=2, m=-2,-1,0,1,2 - пять равноценных ориентаций в пространстве (пять орбиталей).
Для f-орбитали:
l=3, m=-3,-2,-1,0,1,2,3 - семь равноценных ориентаций в пространстве (семь орбиталей).
Спиновое квантовое число – ms (s):
определяет магнитный момент, возникающий при вращении электрона вокруг своей оси. Спиновое квантовое число может принимать лишь два возможных значения +1/2 и -1/2
Принцип Паули:
– в атоме не может быть 2 электронов у которых все 4 квантовые числа были бы одинаковыми.
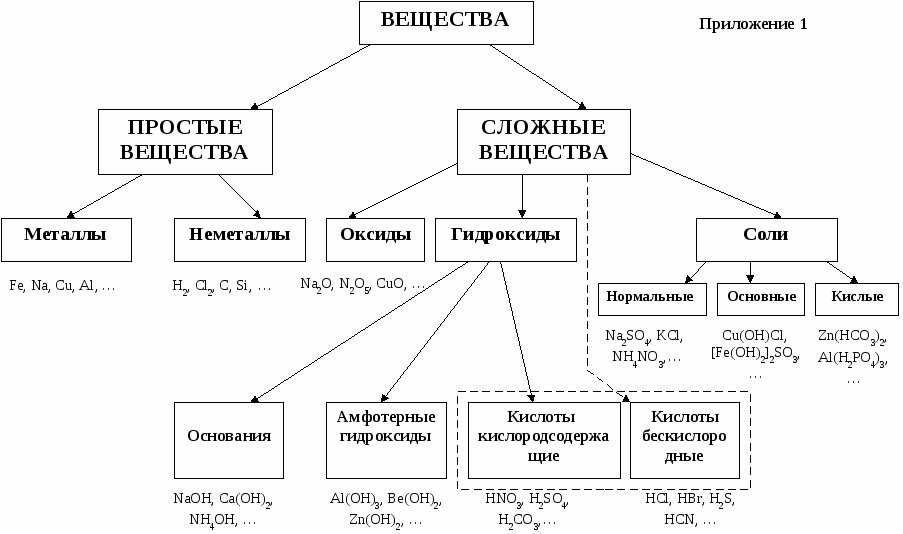
Важнейшие классы и номенклатура неорганических веществ.
Все в-ва в природе делят на простые и сложные. Простые вещества состоят из атомов одного элемента, например S, O2, Cl2, Na, P. Простые вещества разделяют на металлы и неметаллы. Это деление основано на различиях в физических свойствах простых веществ.
В состав сложных в-в входят два или более элемента (например, Н2О, НСl, Н3РО4, Na2CO3). Сложные вещества делятся на органические и неорганические.
Органическими принято называть соединения углерода (например, СН3СООН - уксусная кислота, С2Н5ОН - этиловый спирт). Простейшие соединения углерода (СО, СO2, Н2СО3 и карбонаты, HCN и цианиды, карбиды и некоторые другие) обычно рассматривают в курсе неорганической химии.
Все остальные вещества называются неорганическими (иногда - минеральными). Неорганические вещества делятся на пять главных классов: оксиды, кислоты, основания, амфотерные гидроксиды и соли. Кислородсодержащие кислоты, основания и амфотерные гидроксиды по своей природе можно объединить в самостоятельный класс гидроксидов.
Бинарные соединения – на первом месте стоит Ме, как наиболее электроположительный элемент. Если бинарные соединения не содержат Ме, то на первое место помещается более электроотрицательный элемент.
Галогениды — соединения галогенов с другими химическими элементами. При этом галоген, входящий в соединение, должен быть более электроотрицательным, чем другой элемент соединения.
Оксиды:
1) солеобразующие – оксиды, которые при химических реакциях с кислотами основаниями образуют соль и воду.
2) несолеобразующие – оксиды неМе которые не имеют соответствующих гидроксидов и не вступают в реакции солеобразования (CO, NO, N2O, SiO).
Солеобразующие оксиды делятся на:
1) основные оксиды;
2) кислотные оксиды;
3) амфотерные оксиды, которые могут реагировать и как кислотные, и как основные оксиды (ZnO, PbO, Al2O3 , Cr2O3 ).
Пероксиды — сложные вещества, в которых атомы кислорода соединены друг с другом. Содержащие пероксогруппу —О—О— (например, пероксид водорода Н2О2, пероксид натрия Na2O2). В пероксидах кислород имеет степень окисления −1. (надпероксиды 1\2, озониды 1\3)
Халькогениды – бинарные соединения элементов 6 группы с менее электороотрицательными элементами (CdS, H2Te)
Нитриды – соединения азота с менее электроотрицательными элементами. Нитриды Ме – это твердые кристаллические в-ва, с высокими t кипения.
Гидриды – соединения Н2 с Ме (твердые хрупкие в-ва) или неМе (ковалентные соединения, многие газообразны, разлагаются водой с образованием к-т).
Интерметаллиды – хим соединения двух или нескольких Ме ( хрупкие в-ва со смешанным типом межатомной связи – металлическая, ионная, ковалентная ).
Гидроксиды – это сложные многоэлементные химические соединения, в состав которых входят атомы какого-либоэлемента, кислорода и водорода.Химический характер гидроксидов определяется свойствами соответствующих им оксидов. Поэтому гидроксиды делятся на три большие группы:
1.Гидраты кислотных оксидов, называемые кислотами, например, H2SO4.
2.Гидраты основных оксидов, называемые основаниями, например, Ba(OH)2.
3.Гидраты амфотерных оксидов, называемые амфотерными гидроксидами, например, Be(OH)2.
Основания – сложные в-ва состоящие из Ме и одной или нескольких гидроксильных групп ( тв кристаллические в-ва, реагирующие с кислотами и кислотными оксидами с образованием солей ).
Кислоты – сложные в-ва состоящие из кислотных остатков и одного или нескольких атомов водорода, способных замещаться на атомы Ме.
Номенклатура.
В соответствии с ЮПАК сначала называется электороположительная часть, затем электоотрицательная.
Названия оксидов
Названия оксидов в соответствии с номенклатурными правилами образуются из слова «оксид» и названия оксидообразующего элемента в родительном падеже, например, СаО – оксид кальция, К2О – оксид калия.
В случае, когда элемент обладает переменной степенью окисления и образует несколько оксидов, после названия этого элемента указывают его степень окисления римской цифрой в скобках, или прибегают к помощи греческих числительных (1-моно,2-ди,3-три,4-тетра,5-пента,6-гекса,7-гепта,8-окта). Например:
VO – оксид ванадия (II) или монооксид ванадия;
V2O3 – оксид ванадия (III) или триоксид диванадия;
VO2 – оксид ванадия (IV) или диоксид ванадия;
V2O5 – оксид ванадия (V) или пентаоксид диванадия.
