
Химия [РТФ, Ваганова, 1 семестр] / Методички / #2 Сборник лабораторных работ по химии
.pdfСБОРНИК ЛАБОРАТОРНЫХ РАБОТ
ПО ХИМИИ
Методические указания
к лабораторным работам по химии
для студентов всех специальностей и форм обучения
Часть 2
Ульяновск 2007
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
Государственное образовательное учреждение высшего профессионального образования
УЛЬЯНОВСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ
СБОРНИК ЛАБОРАТОРНЫХ РАБОТ ПО ХИМИИ
Методические указания к лабораторным работам по химии
для студентов всех специальностей и форм обучения
Часть 2
Составители: Е. Н. Калюкова Л. В. Петрова В.Т. Письменко Е.С. Гиматова
Ульяновск 2007
УДК 546 (076)
Сборник лабораторных работ по химии: Методические указания
к лабораторным работам по химии для студентов всех специаль ностей и форм обучения
/ Сост.: Е.Н.Калюкова, Л.В. Петрова, В.Т. Письменко, Е.С. Гиматова. - Уль яновск: УГТУ, 2007, - 55 с.
Настоящие методические указания составлены в соответствии с про граммой по химии для нехимических технических вузов, утвержденной Глав ным учебно-методическим управлением высшего образования 17. 05. 1988г. (индекс ГУМУ-3/1).
Данные методические указания предназначены для студентов первых кур сов нехимических специальностей вузов. Они помогут студентам приобрести практические навыки экспериментальной работы и обработки эксперимен тальных данных, позволят более глубоко усвоить теоретический материал. Помогут усвоить способы выражения состава растворов и способы их приго товления. Познакомят с одним из способов определения концентрации рас твора, с жесткостью воды, способами ее определения и умягчения.
Методические указания содержат примеры решения задач по материалу связанному с лабораторными работами и задания для самостоятельной работы студентов.
Табл. 8. Библиогр.: 12 назв.
Рецензент:
Доктор технических наук, профессор В.М. Николаев (Ульяновский государственный технический университет)
Одобрено редакционно-издательским советом Ульяновского государственного технического уни верситета
©УлГТУ, 2007

Содержание |
|
Содержание |
з |
1. Лабораторная работа № 1. Способы выражения состава |
|
растворов и их определение |
4 |
1.1. Примеры решения задач |
9 |
1.2. Техника безопасности |
15 |
1.3. Экспериментальная часть |
i в |
1.3.1.Приготовление раствора кислоты с заданной массовой долей из раствора кислоты с более высокой концентрацией....!6
1.3.2.Приготовление раствора кислоты с заданной молярной
концентрацией или молярной концентрацией эквивалента |
м |
1.3.3. Определение концентрации растворов |
|
титриметрическом методом |
18 |
1.4. Контрольные вопросы и задачи |
20 |
Список литературы |
22 |
2. Лабораторная работа № 2. Жесткость воды. Определение |
|
жесткости воды и ее умягчение |
23 |
2.1. Примеры решения задач |
21 |
2.2. Техника безопасности |
29 |
2.3. Экспериментальная часть |
зо |
2.4. Контрольные вопросы и задачи |
35 |
Список литературы |
37 |
3. Лабораторная работа № 3. Окислительно-восстановительные
процессы |
37 |
3.1. Техника безопасности |
42 |
3.2. Экспериментальная часть |
43 |
3.3. Контрольные вопросы |
52 |
Список литературы |
54 |
Приложение |
55 |
з
1. Лабораторная работа № 1.
Способы выражения состава растворов и их определение
Цель работы. Приобрести навыки расчета и приготовления растворов с заданной концентрацией. Познакомится с одним из методов объемного анализа - методом титрования.
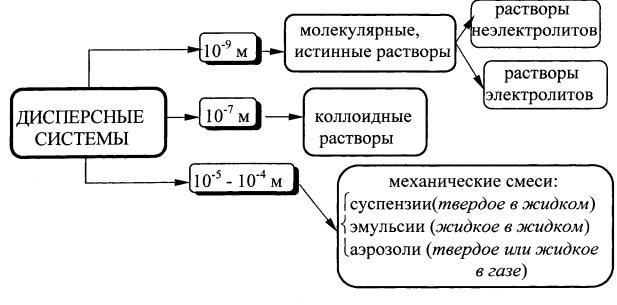
Большинство веществ, с которыми мы сталкиваемся в повседнев ной жизни, представляют собой смеси, а не чистые вещества. Ве щества, образующие смеси, могут находиться в различных агрегат ных состояниях, образуя гомогенные и гетерогенные системы.
Системы, в которых составные части более или менее равно мерно распределены (диспергированны) друг в друге, называются дисперсными.
Дисперсные системы делят на гомогенные и гетерогенные сис темы.
В гомогенной дисперсной системе компоненты равномерно распределены друг в друге и составляют одну фазу.
Гетерогенные дисперсные системы содержат несколько фаз, равномерно распределенных друг в друге.
Смеси веществ по степени дисперсности условно делят на грубо дисперсные или механические смеси, коллоидные растворы и ис тинные растворы.
Устойчивость дисперсных систем определяется размером частиц дисперсной фазы.
4

В химии большое значение имеют молекулярные или истинные растворы, в которых размер частиц веществ дисперсионной среды и дисперсной фазы соответствуют размеру молекул и ионов.
Раствором называется гомогенная система, состоящая из двух или более независимых компонентов, соотношение между кото рыми может изменяться.
Компоненты раствора подразделяются на растворитель и раство ренные вещества.
Компонент, количественно преобладающий в системе и не изме няющий своего агрегатного состояния при приготовлении раство ра, называется растворителем.
Остальные компоненты, входящие в состав раствора, называ ются растворенными веществами. Однако это деление носит ус ловный характер.
Растворы, которые содержат большое количество растворен ного вещества, называют концентрированными, а с малым со держанием растворенного вещества - разбавленными.
Концентрированные растворы могут образовывать только хоро шо растворимые вещества, а разбавленные растворы - вещества с любой растворимостью.
Важнейшей характеристикой растворов, влияющей на их свойст ва, является состав раствора, т.е. содержание растворенного веще ства в определенной массе или объеме раствора или растворителя. Существуют различные способы выражения состава растворов. Со став раствора может быть выражен безразмерными (доли, отноше ния) и размерными величинами (молярная концентрация, массовая концентрация, моляльность, титр и т.д.).
Термин "концентрация" потерял в настоящее время прежнее слишком широкое значение.
Концентрацией называют отношение массы или количества вещества к объему системы (раствора).
Рассмотрим некоторые широко распространенные способы вы ражения состава растворов.
1. Массовая доля - отношение массы растворенного вещест ва к массе раствора.
5
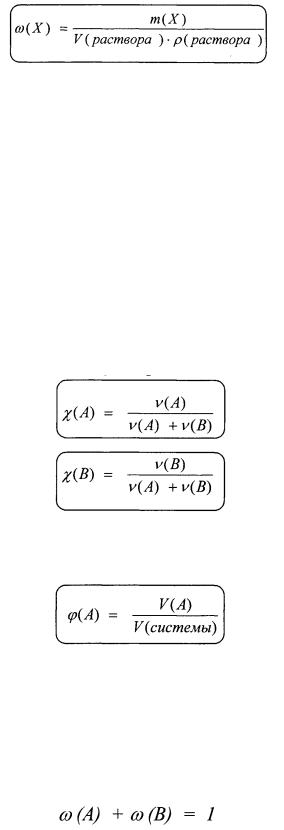
Для растворов проще измерить объем, а не массу. Массу и объем раствора связывает между собой плотность раствора:
р(раствора) = т(раствора) / V(pacmeopa).
Этот способ выражения состава растворов часто используют в быту, на производстве, в медицине.
С изменением содержания растворенного вещества в растворе изменяется и плотность раствора. Используя таблицы, для раствора с определенной массовой долей можно определить плотность рас твора и, наоборот, по плотности можно определить массовую долю вещества в растворе. (Приложение)
2. Молярная доля - отношение количества вещества данного компонента, содержащегося в системе, к общему количеству ве щества этой системы.
Если система состоит из двух компонентов - веществ А и В, то молярная доля веществ А и В будет равна:
3. Объемная доля - отношение объема данного компонента, со держащегося в системе, к объему всей системы.
Массовая доля, молярная доля, объемная доля - относительные безразмерные величины. Выражать их можно в долях от единицы или в процентах.
Для раствора состоящего из двух компонентов А и В сумма мас совых, молярных и объемных долей компонентов системы равны единице:
б

4. Молярная концентрация - отношение количества вещества X, содержащегося в растворе, к объему этого раствора.
Молярная концентрация показывает, какое количество раство ренного вещества (число моль) содержится в одном литре данного раствора.
Для более краткого обозначения этой концентрации используют условное обозначение "М".
Например, для раствора с молярной концентрацией карбоната на трия 0,5 моль/л можно сделать запись:
C(Na2C03) = 0,5 моль/л или 0,5MNa2CO3
5. Молярная концентрация эквивалента - отношение количе ства вещества эквивалента данного вещества X, содержащегося в растворе, к объему этого раствора.
Молярная концентрация эквивалента вещества X показывает, ка кое количество вещества эквивалента (число моль эквивалентов данного вещества X) содержится в одном литре раствора.
Для обозначения молярной концентрации эквивалента раньше использовали термины "эквивалентная концентрация", "нормальная концентрация" и символы: Сн , Сэ , N или Н.
Например, для раствора карбоната натрия с молярной концентра цией эквивалента 0,5 моль/л можно встретить такие формы записи:
C(l/z* Na2CO3) = 0,5 моль/л; C(l/2Na2CO3) = 0,5 моль/л; C3(Na2CO3) = 0,5 моль/л; 0,5 н. Na2CO3
6. Моляльность - отношение количества растворенного веще ства к массе растворителя.
1
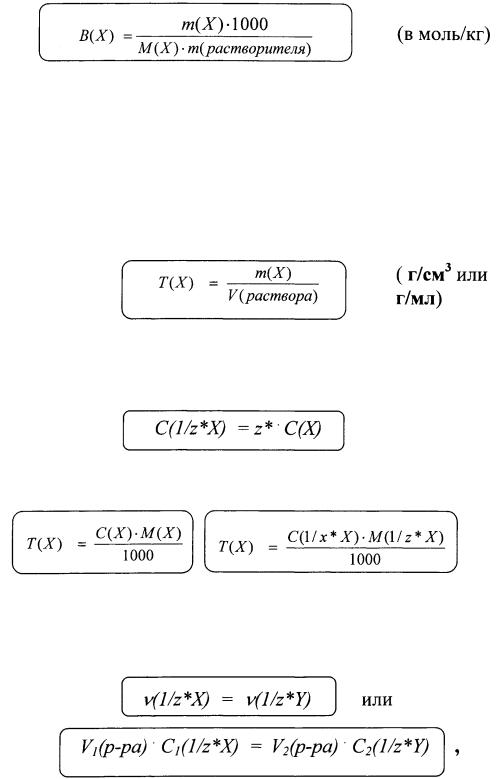
Если массу растворенного вещества и растворителя выражать в граммах, то выражение моляльности можно записать в виде, более удобном для расчетов:
Моляльность показывает, |
какое количество растворенного ве |
щества приходится на один килограмм растворителя. |
|
Например, в(Ка2СОз) = 0,5 |
моль/кг означает, что на 1 кг раство |
рителя (воды) в данном растворе приходится 0,5 моль карбоната натрия.
7. Титр раствора - масса растворенного вещества, содержаще гося в 1 см3 или 1мл раствора.
Различные способы выражения состава раствора связаны между собой. Например, молярная концентрация и молярная концентрация эквивалента связаны между собой соотношением:
Титр раствора связан с молярной концентрацией и с молярной концентрацией эквивалента:
Для реакций, протекающих в растворах, при проведении вычис лений часто используют закон эквивалентов, который в этом слу чае может быть выражен следующим образом:
т.е. количества вещества эквивалента или число частиц, иг рающих роль эквивалента, для веществ X и Y, вступающих во взаимодействие, должно быть равно.
8

По закону эквивалентов объемы реагирующих растворов обрат но пропорциональны их молярным концентрациям эквивалентов.
Закон эквивалентов, записанный в таком виде, называют законом объемных отношений.
Рассмотрим несколько примеров расчета задач, связанных с раз личными способами выражения состава растворов, их взаимными пересчетами, с расчетами, выполняемыми по уравнениям реакции и по закону эквивалентов.
9
