
Химия [РТФ, Ваганова, 1 семестр] / Методички / #2 Сборник лабораторных работ по химии
.pdf
|
|
|
|
|
Таблица 3 |
||
|
Экспериментальные и расчетные данные |
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
Молярная |
Титр |
|||
|
Объем раствора |
концентрация |
|||||
Номер |
раствора |
||||||
|
|
эквивалента |
|||||
опыта |
|
|
кислоты |
||||
|
|
|
|
||||
|
Соды |
Кислоты |
Соды |
Кислоты |
|
|
|
|
л |
л |
моль/л |
моль/л |
г/мл |
||
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Приведите в порядок рабочее место и оформите отчет.
1.4.Контрольные вопросы и задачи
1.Что такое раствор? Какими способами можно выразить содер жание растворенного вещества в растворе?
2.Дайте определение величин, характеризующих состав раство ра, которые имеют наибольшее применение.
3.В 300 г воды растворили 30 г хлорида натрия. Определите мас совую долю соли в полученном растворе.
4.Определите молярную концентрацию раствора хлорида аммо ния, содержащего 40 г соли в 500 мл раствора.
5.Какая масса фосфорной кислоты содержится в растворе объе мом, равным 0,3 л, если его молярная концентрация эквивален та равна 0,5 моль/л?
6.После упаривания раствора гидроксида натрия с массовой до лей 10 % (р = 1,115 г/мл) и объемом, равным 6 л, масса раство ра стала равной 1420 г. Вычислите массовую долю щелочи в полученном растворе.
7.В 250 мл раствора содержится 7,5 г сульфата алюминия. Чему равна молярная концентрация и молярная концентрация экви валента данного раствора?
8.Чему равна моляльность раствора, приготовленного из глюко зы (С6 Н12 O6 ) массой 9 г и воды объемом, равным 500 мл?
20
9. Рассчитайте |
титр |
раствора |
соляной |
кислоты: |
а) с молярной концентрацией, |
равной 0,05 |
моль/л; |
||
б) с массовой долей 2 % и плотностью, равной 1,008 г/мл.
10.Сколько мл раствора серной кислоты с массовой долей, равной 94 % (р = 1,84 г/мл), потребуется для приготовления 3 л рас твора этой же кислоты с массовой долей, равной 40 %, и плот ностью 1,31 г/мл?
11.Какой объем раствора соляной кислоты с массовой долей, рав ной 20 % (р = 1,10 г/мл), потребуется для приготовления 800 мл раствора этой кислоты с молярной концентрацией 0,5 моль/л?
12. Дан раствор фосфорной кислоты с массовой долей 40 % (р = 1,25 г/мл). Определите молярную концентрацию, моляр ную концентрацию эквивалента, моляльность и титр данного раствора кислоты.
13. Смешали 300 г раствора серной кислоты с массовой долей, ра ной 40 %, и 250 мл 10 % раствора этой же кислоты (р = 1,07 г/мл). Определите массовую долю кислоты в получен ном растворе.
14.Вычислите, какая масса гидроксида калия потребуется для ней трализации 0,5 л раствора азотной кислоты с массовой долей 40 %( р = 1,25 г/мл)?
15.На нейтрализацию раствора щелочи объемом, равным 60 мл, израсходовано 35 мл раствора серной кислоты с молярной кон центрацией эквивалента 0,5 моль/л. Вычислите молярную кон центрацию эквивалента щелочи.
16.К 1 л соляной кислоты с массовой долей 30 % (р = 1,15 г/мл) прибавили 2 л воды. Найдите массовую долю кислоты в полу ченном растворе.
17.Для растворения гидроксида железа(Ш) потребовалось 0,3 л раствора азотной кислоты с массовой долей 30 % (р=1,18 г/мл). Какая масса исходного гидроксида железа(Ш) была растворена данной кислотой?
18.Рассчитайте, какой объем диоксида углерода (н.у.) можно по
лучить при действии на раствор карбоната натрия 100 мл сер ной кислоты с молярной концентрацией эквивалента 0,6 моль/л?
21
19.К 200 мл раствора хлорида бария с массовой долей 20 % (р = 1,203 г/мл) прибавили избыток раствора сульфата калия. Вы
числите массу образовавшегося осадка.
20.Каким объемом раствора соляной кислоты с молярной концен трацией 0,25 моль/л можно нейтрализовать: а) 111 г гидроксида кальция; б) 250 мл раствора гидроксида бария с молярной кон центрацией 0,5 моль/л?
Список литературы
1.Глинка Н.Л. Общая химия.- Л.: Химия, 1987. - с. 205-215
2.Курс общей химии / Под ред. Н.В. Коровина. - М.: Высшая школа, 1990.-с. 145-156.
3.Карапетьянц М.Х., Дракин СИ . Общая и неорганическая хи мия. - М.: Химия, 1993. - с. 245-256.
4.Степин Б.Д., Цветков А.А. Неорганическая химия. - М.: Выс шая школа, 1994. - с. 151-166.
5.Глинка Н.Л. Задачи и упражнения по общей химии.- Л.: Химия,1985.- с. 103-114.
6.Любимова Н.Б. Вопросы и задачи по общей и неорганической химии. - М.: Высшая школа, 1990. - с. 174-190.
7.Романцева Л.М., Лещинская З.Л., Суханова В.А. Сборник задач
иупражнений по общей химии. М.: Высшая школа, 1991. - с. 101-113.
8.Основные понятия и законы химии. Растворы. Методические указания по химии для индивидуальной и самостоятельной ра боты студентов всех специальностей и форм обучения /Сост. Е.Н. Калюкова, В.Д. Бычков. - Ульяновск: УлПИ, 1991. - 44с.
9.Задания для самостоятельной работы по курсу химии: Основ ные понятия и некоторые законы химии. Часть I. Методические указания по химии для студентов всех специальностей. /Сост. Е.Н. Калюкова. - Ульяновск: УлГТУ, 1998. - 56с.
10.Письменко В.Т. Дисперсные системы Ч. 1 .Молекулярнодисперсные системы (истинные растворы): учебное пособие / В.Т. Письменко. - Ульяновск: УлГТУ, 2003.- 96 с.
22
3. Лабораторная работа № 2.
Жесткость воды. Определение жесткости воды и ее умяг чение
Цель работы. Познакомиться с методами определения и спосо бами устранения жесткости воды.
Большее влияние на качество воды оказывают содержащиеся в ней соли кальция, магния и железа(П), которые и обуславливают жесткость воды.
Природная вода, проходя через известковые горные породы и почвы, обогащается солями кальция и магния и становится жест кой.
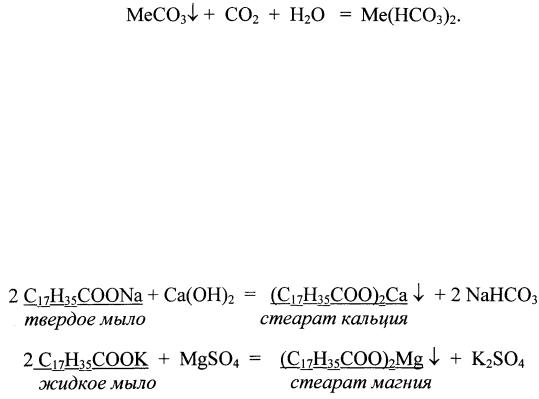
Нерастворимые карбонаты металлов под действием углекислого газа и воды переходят в растворимые гидрокарбонаты и растворя ются в грунтовых водах:
Жесткая вода непригодна для многих технологических процес сов. Нерастворимые соли кальция и магния осаждаются на внут ренних стенках паровых котлов и трубопроводов, образуя слой на кипи, который плохо проводит теплоту. Это вызывает перерасход топлива и преждевременный износ котлов. В результате перегрева котлов могут происходить аварии. В жесткой воде значительно бы стрее протекает процесс коррозии.
В жесткой воде при стирке белья увеличивается расход мыла (мыло - натриевая или калиевая соль высших карбоновых кислот), так как образуется осадок стеарата кальция и магния:
Этим и объясняется незначительное пенообразование и снижение моющего действия мыла. Калиевые соли по сравнению с натрие выми солями лучше растворимы в воде и поэтому обладают более сильными моющими свойствами. При стирке белья жесткая вода ухудшает качество тканей. Ткань, впитывая нерастворимые соли, желтеет и быстро ветшает.

24

25

26

27


xr (urn. i |
т[Са(НС03)2] |
7,5кг |
|
|
||||||
v\Ca(HCO-,)7 = |
—т |
|
^ = — |
г |
|
|
= 46,3 моль |
|||
|
|
|||||||||
|
||||||||||
1 |
ъпх |
М[Са(НСО,)2] 162-10"3 кг/моль |
||||||||
По уравнению реакции: |
|
|
|
|
|
|
|
|||
|
|
v(Ca(HC03)2) = v(Na2C03), |
||||||||
m(Na2C03) = v(Na2C03) |
M(Na2C03) = 46,3 |
моль 106 г/моль = |
||||||||
= 4907 г -4,9 кг.
Задача 3. Для устранения временной жесткости воды к 100 л во ды было прибавлено 16 г гидроксида натрия. Рассчитайте жест кость данной воды.
Дано: У(Н2 О)=100л m(NaOH)=16,0r
Найти: Ж = ?
Решение.
В условии задачи не сказано, соли какого металла обуславливают жесткость данной воды и каково их соотношение в воде. Хотя мы можем представить, какие процессы могут протекать в системе при добавлении гидроксида натрия к воде:
Ме(НС03)2 + 2 NaOH = MeC0 3 | +Na2C03 + 2H 2 0 или 2Mg(HC03)2 + 2NaOH = (MgOH)2C03|+ Na2C03 + 2H20 + 2C02t,
но задачу решаем по закону эквивалентов. Количество вещества эквивалента гидроксида натрия и количество вещества эквивалента солей, обуславливающих жесткость воды, должно быть одинаково:
v(l/z*NaOH) |
= v(l/z*X), |
|||
Ж-У(Н20) _ |
m(NaOH) |
|||
103 |
~ |
M(\/z*NaOHy |
||
|
|
16г-103 |
|
|
Ж = |
|
|
|
= 4 ммоль I л |
|
|
|
||
40г/моль-ЮОл
2.2.Техника безопасности
1.Перед выполнением работы разберитесь с методикой выпол нения эксперимента.
2.Аккуратно работайте со стеклянной посудой.
3.Соблюдайте осторожность при нагревании пробы на элек
троплитке и спиртовке.
4. Не загрязняйте катионит посторонними реактивами.
29
