
6 семестр / Физическая химия 2-ая аттестация 6 семестр
.docxΔrG,
определяется
как наклон касательной к кривой
зависимости энер- гии Гиббса системы
от степени протекания химической
реакции (т.е. «кси»).
Как
видно из рисунка, минимуму энергии
Гиббса соответствует состояние,
отмеченное звездочкой (*). В этой точке
![]() Слева
от минимума:
Слева
от минимума:
![]() и
р-ия самопроизв протекает в прямом
направлении, справа от минимума:
(ΔG/Δε)p,T=ΔrG>0
и
самопроизвольно
протекает
обратная
реакция.
Чтобы рассчитывать химические равновесия,
т.е. определять состав
равновесной
смеси, надо конкретизировать вид
зависимости химических потенциалов
реагентов и продуктов от переменных,
выражающих
состав,
p
и
T.
Условия
хим. равновесия. Условием
равновесия системы с хим. реакцией
является равенство полных химических
потенциалов исходных веществ и продуктов.
Умножение химических потенциалов
реагентов на их стехиометрические
коэффициенты отражает взаимную
зависимость масс участников реакции
из уравнения материального баланса.
За-н
действующих масс и его т/д вывод.
Различные виды констант равновесия и
связь между ними. Помимо
константы равновесия, выраженной через
парциальные давления (9.8), в термодинамических
расчетах используют константы равновесия,
выраженные через другие переменные,
например, мольную долю, x,
или молярность, с.
В
этом случае для реакции (I):
и
р-ия самопроизв протекает в прямом
направлении, справа от минимума:
(ΔG/Δε)p,T=ΔrG>0
и
самопроизвольно
протекает
обратная
реакция.
Чтобы рассчитывать химические равновесия,
т.е. определять состав
равновесной
смеси, надо конкретизировать вид
зависимости химических потенциалов
реагентов и продуктов от переменных,
выражающих
состав,
p
и
T.
Условия
хим. равновесия. Условием
равновесия системы с хим. реакцией
является равенство полных химических
потенциалов исходных веществ и продуктов.
Умножение химических потенциалов
реагентов на их стехиометрические
коэффициенты отражает взаимную
зависимость масс участников реакции
из уравнения материального баланса.
За-н
действующих масс и его т/д вывод.
Различные виды констант равновесия и
связь между ними. Помимо
константы равновесия, выраженной через
парциальные давления (9.8), в термодинамических
расчетах используют константы равновесия,
выраженные через другие переменные,
например, мольную долю, x,
или молярность, с.
В
этом случае для реакции (I):
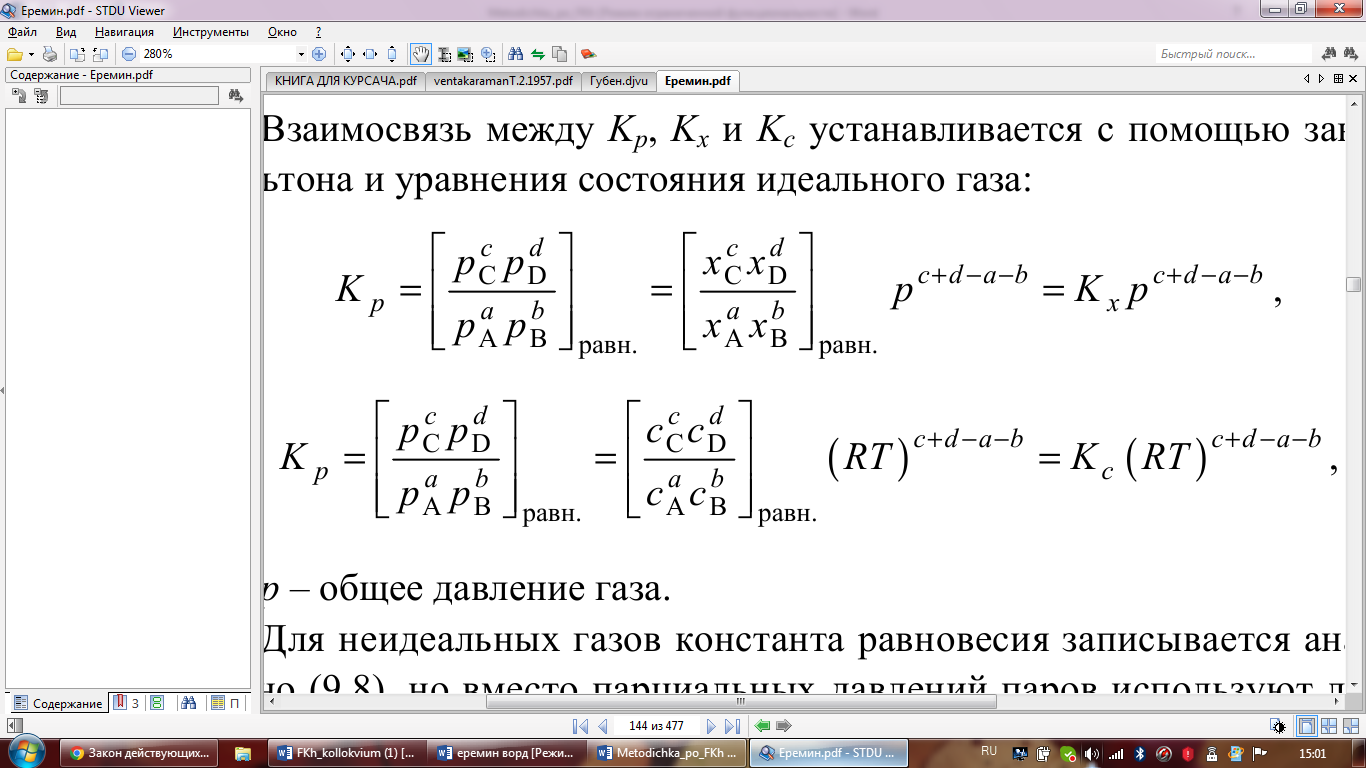
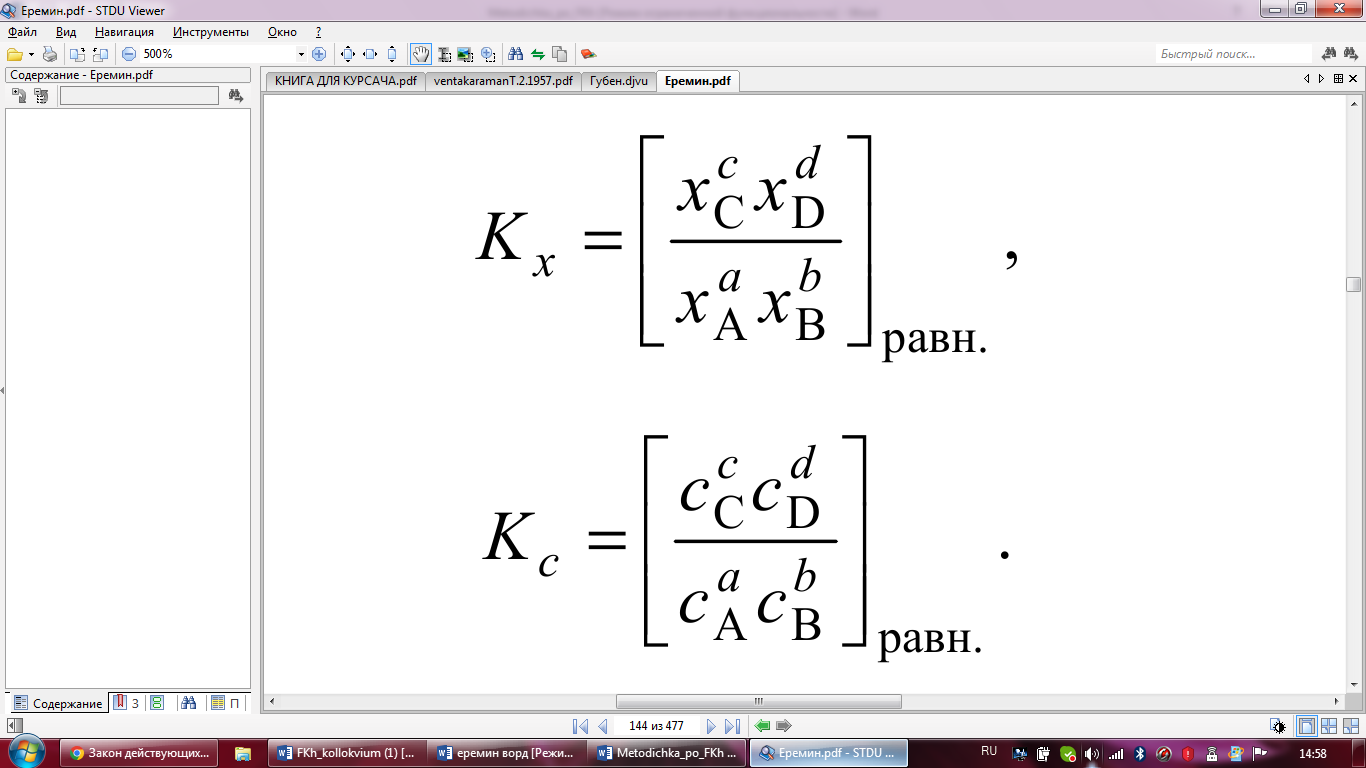 Взаимосвязь между Kp, Kx и Kc устанавливается
с помощью закона Дальтона и уравнения
состояния идеального газа:
Взаимосвязь между Kp, Kx и Kc устанавливается
с помощью закона Дальтона и уравнения
состояния идеального газа:
 Если
реакция (I) протекает в конденсированной
фазе, то в случае идеальных растворов
Если
реакция (I) протекает в конденсированной
фазе, то в случае идеальных растворов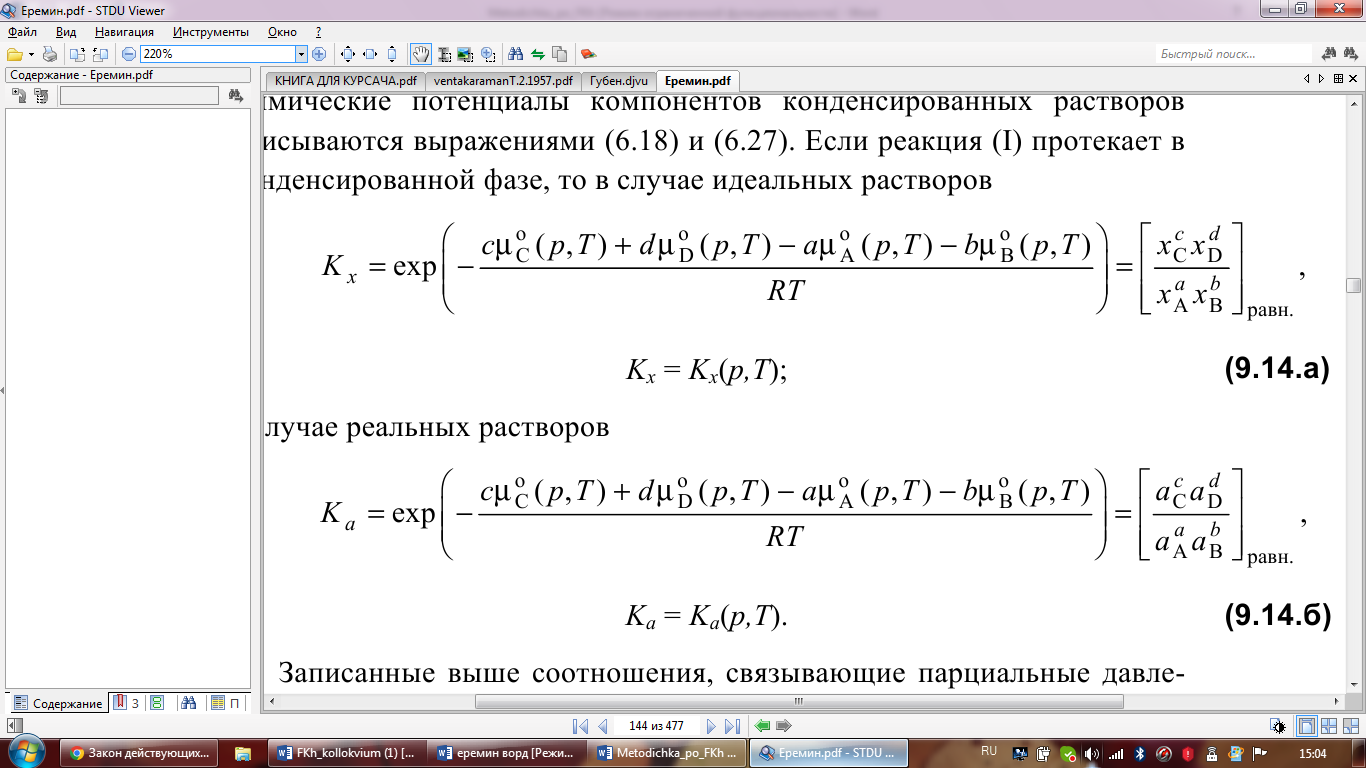 А
в случае реальных ра-ров:
Записанные
выше соотношения, связывающие парциальные
давления, концентрации, мольные доли,
летучести или активности участников
р-ии, носят название закона
действующих масс.
Эмпирические
закономерности для коэф. активностей
в ра-рах различного типа
А
в случае реальных ра-ров:
Записанные
выше соотношения, связывающие парциальные
давления, концентрации, мольные доли,
летучести или активности участников
р-ии, носят название закона
действующих масс.
Эмпирические
закономерности для коэф. активностей
в ра-рах различного типа
|
|
