
6 семестр / Физическая химия 2-ая аттестация 6 семестр
.docx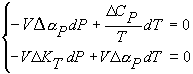 (3.25)
(3.25)
Однородная система линейных уравнений (3.25) имеет ненулевое решение при условии равенства нулю определителя системы:
![]() (3.26)
(3.26)
Таким
образом, скачки вторых производных не
являются независимыми, а связаны между
собой соотношением (3.26). Решение системы
уравнений (3.25) при условии (3.26) имеет
вид:
![]() (3.27)
(3.27)
Формулы (3.26) и (3.27) называются уравнениями Эренфеста.
В отличие от кривой фаз равновесия Клайперона-Клаудиуса, это ур-ие определяет линию фазового перехода, т.к. при фазовых переходах 2-го рода не существует метастабильных состояний. Новая фаза появляется сразу во всем объеме вещества и, соответственно, не существует межфазной поверхности раздела и поверхностной энергии.
Интересно,
что предположения о возможности
метастабильных фазовых состояний при
фазовых переходах 2-го рода приводит к
выводу о том, что фазовые переходы 2-го
рода вообще не возможны. Действительно,
в точке непрерывного фазового перехода
точка пересечения m 1 и
m 2 должна
быть и точкой касания (общая касательная),
но в случае простого касания m 2 < m 1, как
при T > T0,
так и при T < T0,
т.е. перехода быть не может. Следовательно
нужно,
чтобы
точка T0 была
точкой перегиба кривых m 1(T)
и m 2(T),
что означает![]() в этом случае разрывной функцией может
быть только третья производная, что
соответствует фазовому переходу 3-го
рода.
в этом случае разрывной функцией может
быть только третья производная, что
соответствует фазовому переходу 3-го
рода.
Таким образом, теория Эренфеста дает связь между скачками соответствующих термодинамических коэффициентов (3.26) и определяет производную линию фазового превращения (3.27).
Взаимосвязь составов пара и ж для идеальных и неидеальных ра-ров Если компоненты А и В смеси обладают близкими свойствами (сходное строение молекул и близкие молекулярные массы, одинаковая полярность и т.д.), то можно считать одинаковыми и силы взаимодействия F между однородными и разнородными молекулами, т.е. FA-A = FB-B = FА-В
Образование ра-ра из этих компонентов не сопровождается изменением суммарного объема и теплового эффекта. При этом изменение состава ра-ра не приводит к образованию новой фазы (например, к кристаллизации одного из компонентов). Такие ра-ры называются идеальными. В качестве примеров ра-ров, близких к идеальным, можно привести смеси оптических изомеров амилового спирта; смеси, компоненты которых отличаются по изотопному составу: Н2О – Д2О. К ним близки по свойствам смеси изомеров н-С5Н12- изо-С5Н12и гомологов С6Н12-С7Н16.
Давление пара над ра-ром зависит от температуры и состава ра-ра, а при постоянной температуре – только от состава.
Идеальные
ра-ры подчиняются закону Рауля, согласно
которому парциальное давление пара
компонента над ра-ром равно произведению
давления пара чистого компонента на
его мольную долю в ра-ре:
![]() отвечающее
уравнению прямой (рисунок 2.1).В этой
формулировке з-н Рауля справедлив для
низких давлений.
Р
отвечающее
уравнению прямой (рисунок 2.1).В этой
формулировке з-н Рауля справедлив для
низких давлений.
Р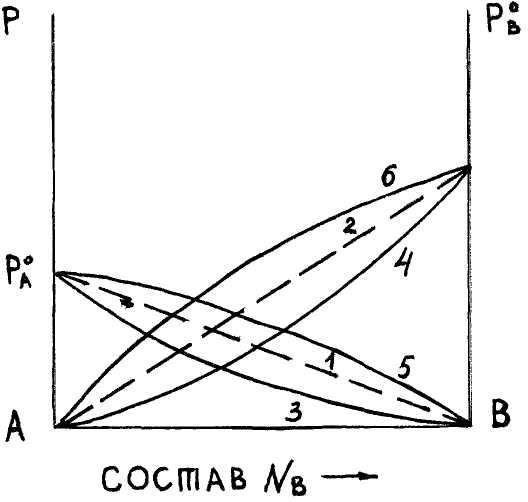 исунок
2.1. Давление пара системы А-В.1-2
– изменение парциальных давлений
компонентов А и В для случая образования
идеальных ра-ров.3-4 – изменение
парциальных давлений компонентов А и
В для случая отрицательных отклонений
их от закона Рауля.5-6 – изменение
парциальных давлений компонентов А и
В для случаев положительных отклонений
их от закона Рауля.
Неидеальные
ра-ры.
Отклонения
от идеальности обусловлены как
физическими, так и химическими причинами
(дипольные взаимодействия, поляризация,
различная интенсивность Ван-дер-Вальсовых
сил, ассоциация, диссоциация, сольватация
и др.). Все эти взаимодействия настолько
переплетаются, что трудно предугадать
суммарный результат. Однако благодаря
преобладанию одной из форм взаимодействия,
можно произвести классификацию ра-ров
по признаку отрицательного или
положительного отклонения от закона
Рауля.
исунок
2.1. Давление пара системы А-В.1-2
– изменение парциальных давлений
компонентов А и В для случая образования
идеальных ра-ров.3-4 – изменение
парциальных давлений компонентов А и
В для случая отрицательных отклонений
их от закона Рауля.5-6 – изменение
парциальных давлений компонентов А и
В для случаев положительных отклонений
их от закона Рауля.
Неидеальные
ра-ры.
Отклонения
от идеальности обусловлены как
физическими, так и химическими причинами
(дипольные взаимодействия, поляризация,
различная интенсивность Ван-дер-Вальсовых
сил, ассоциация, диссоциация, сольватация
и др.). Все эти взаимодействия настолько
переплетаются, что трудно предугадать
суммарный результат. Однако благодаря
преобладанию одной из форм взаимодействия,
можно произвести классификацию ра-ров
по признаку отрицательного или
положительного отклонения от закона
Рауля.
Если силы взаимодействия между однородными частичками А-А и В-В меньше, чем разнородными А-В, то есть если FА-А<FА-В>FВ-В, то имеет место стремление к взаимодействию компонентов, которые вызывают повышение ра-римости. Образование ра-ра сопровождается выделением тепла. Поэтому теплота парообразования компонентов из ра-ра оказывается большей, чем чистого компонента. Затруднение парообразования означает понижение давления пара. В этом случае говорят об отрицательном отклонении от закона Рауля (рисунок 2.1, кривые 3-4). Образование ра-ра как правило сопровождается уменьшением объема.
Если силы взаимодействия между однородными молекулами А-А и В-В больше, чем между разнородными А-В, т.е. если FА-А>FА-В<FВ-В, то процесс ра-рения сопровождается поглощением тепла. Это приводит к уменьшению теплоты парообразования, т.е. облегчает испарение. Если одинаковые молекулы стремятся к ассоциации, то ра-римость по сравнению с идеальной (рассчитанной по закону Рауля) понижается. Образование ра-ра, как правило, сопровождается увеличением объема. В этом случае говорят о положительном отклонении от закона Рауля (рисунок 2.1, кривые 5-6).
Весьма значительные положительные отклонения от закона Рауля приводят к нарушению гомогенности – обе жидкости оказываются ра-римыми до определенного предела.
Влияние температуры не одинаково сказывается на ограниченной ра-римости жидкостей, это зависит от того, вступает ли они друг с другом в химические взаимодействие или нет. В случае, когда жидкости химически не взаимодействуют, изменение температуры влияет на ра-римость лишь постольку, поскольку оно вызывает перераспределение энергии движения между молекулами. С ростом температуры увеличивается доля молекул с повышенным запасом энергии, способных, благодаря этому осуществить работу перехода из одной жидкости в другую. С ростом температуры взаимная ра-римость таких жидкостей будет увеличиваться. Составы сопряженных ра-ров будут все более и более сближаться и при некоторой температуре станут тождественными. Начиная с этой температуры и выше, будет наблюдаться неорганичная ра-римость жидкостей друг в друге. Температура, начиная с которой жидкости неограниченно смешиваются друг с другом, получила название верхней критич. температуры ра-рения.
В тех случаях, когда ограниченно ра-римые жидкости образуют молекулярные соединения, повышение температуры уменьшают их взаимную ра-римость. Повышение температуры способствует диссоциации сложных молекул в более простые, плохо ра-римые компоненты, что и ведет к уменьшению взаимной ра-римости. Наоборот, при понижении температуры взаимная ра-римость увеличивается. Может случиться, что прежде чем сопряженные ра-ры начнут затвердевать, состав их станет одинаковым. Температура, при которой это происходит, получила название нижней критической температурой ра-рения. Бывают такие смеси, которые обладают двумя критическими температурами ра-рения: верхней и нижней.
В ода–фенол
в жидком состоянии проявляют ограниченную
ра-римость, а в твердом – полностью
нера-римые друг в друге. Ограниченную
ра-римость ж можно наблюдать на примере
системы анилин-вода
Азеотропные
смеси и их св-ва.
Азеотро́пная
смесь — смесь двух или более жидкостей
с таким составом, который (при данном
конкретном давлении) не меняется при
кипении, то есть составы равновесных
жидкой и паровой фаз совпадают.
ода–фенол
в жидком состоянии проявляют ограниченную
ра-римость, а в твердом – полностью
нера-римые друг в друге. Ограниченную
ра-римость ж можно наблюдать на примере
системы анилин-вода
Азеотропные
смеси и их св-ва.
Азеотро́пная
смесь — смесь двух или более жидкостей
с таким составом, который (при данном
конкретном давлении) не меняется при
кипении, то есть составы равновесных
жидкой и паровой фаз совпадают.
Точка
на фазовой диаграмме, которая соответствует
равенству составов жидкости и пара,
называется азеотропной точкой.
Температура кипения для азеотропной
смеси может быть как меньше (положительные
азеотропы), так и больше (отрицательные
азеотропы) температуры кипения
низкокипящего компонента. Термодинамика
не накладывает ограничений на число
азеотропных точек в системе[1]. В основном
известны бинарные ра-ры с одной
азеотропной точкой. При изменении
давления изменяется не только температура
кипения, но и состав азеотропной смеси,
этим они отличаются от чистых
жидкостей.
Законы
Гиббса-Коновалова. Установливают
соотношения между составами равновесных
жидких ра-ров и составами их паров, а
также общим давлением насыщенного пара
над ними. Первый
закон Гиббса-Коновалова гласит: в
насыщенном паре над ра-ром преобладает
по сравнению с ра-ром тот компонент,
добавление которого к ра-ру приводит
к возрастанию общего давления насыщенного
пара (пар обогащен легколетучим
компонентом).
Данный закон выполняется для любых
ра-ров, а на рассматриваемом явлении
основана фракционная перегонка
(ректификация), позволяющая разделить
смесь взаимно-ра-римых жидкостей.
Докажем
первый закон Гиббса-Коновалова, для
чего воспользуемся уравнением
Дюгема-Маргулеса (8.10), устанавливающим
связь между изменениями парциальных
давлений пара компонентов и составом
ра-ра при постоянных температуре и
давлении. В расчете на 1 моль жидкого
бинарного ра-ра указанное уравнение
принимает вид х1dlnP1+x2dlnP2=0![]() . (8.35)
. (8.35)
Преобразуем
уравнение (8.35):![]() .
(8.36) Учтем, что
.
(8.36) Учтем, что![]() ,
, ![]() ,
тогда
,
тогда![]() .
(8.37)
.
(8.37)
Поскольку
P=P1+P2,dP=dP1+dP2 ,то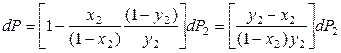 .
(8.38)
.
(8.38)
Разделим
правую и левую части уравнения (8.38)
на dx2,
получим: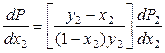 .
(8.39)
.
(8.39)
Поскольку производная (dP2/dx2) > 0 (парциальное p второго компонента в паре увеличивается с ростом его мольной доли в ра-ре), то знак производной (dP/dx2) определяется знаком разности (y2 – x2). Если y2 > x2, то (dP/dx2) > 0, что и требовалось доказать.
С учетом вышеизложенного первый закон Гиббса-Коновалова может быть сформулирован и так: общее давление пара над ра-ром растёт с ростом доли в ра-ре того компонента, который богаче представлен в паре (более летучего компонента).
Второй закон Гиббса-Коновалова касается более частных случаев и выполняется для реальных ра-ров с большими отклонениями от закона Рауля, на кривых «общее давление пара – состав» для которых имеются минимумы или максимумы. Второй закон Гиббса-Коновалова гласит: максимум на кривой общего давления соответствует минимуму на кривой температур кипения и отвечает такому равновесию ра-ра и насыщенного пара, при котором составы фаз одинаковы, и наоборот.
Экстремумы на кривой зависимости общего давления насыщенного пара от состава ра-ра удовлетворяют условию (dP/dx2) = 0, а в соответствии с уравнением (8.39) это возможно, только если в этих точках y2 = x2. Итак, в экстремумах общего давления пара (или температур кипения) ра-р и насыщенный пар имеют одинаковый состав.
Возможные диаграммы состояния бинарных систем с максимумом на кривой давления пара и минимумом на кривой температур кипения представлены на рис. 8.7.
Р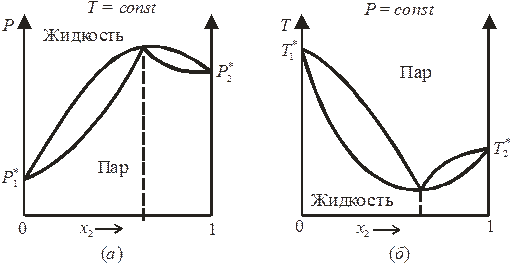 ис.
8.7. Диаграммы состояния бинарных систем
с максимумом на кривой давления пара
(а)
и минимумом на кривой температур кипения
(б).
ис.
8.7. Диаграммы состояния бинарных систем
с максимумом на кривой давления пара
(а)
и минимумом на кривой температур кипения
(б).
Смеси, у которых ра-р и пар одинаковы по составу, называются азеотропными, или нераздельнокипящими. Путём перегонки азеотропные ра-ры не разделяются (составы фаз равны). Но их можно разделить следующими методами: — путём химического связывания одного из компонентов; — путем добавления в систему третьего компонента;— путем ректификации на двух последовательных колонках при различных давлениях. Примерами азеотропных смесей с минимумами на кривых температур кипения являются ра-ры, содержащие Н2О и С2Н5ОН (96,5%), метанол и ацетон. Примерами азеотропных смесей с максимумами на кривых кипения являются ра-ры, содержащие Н2О и НСl (20%), ацетон и хлороформ.
Т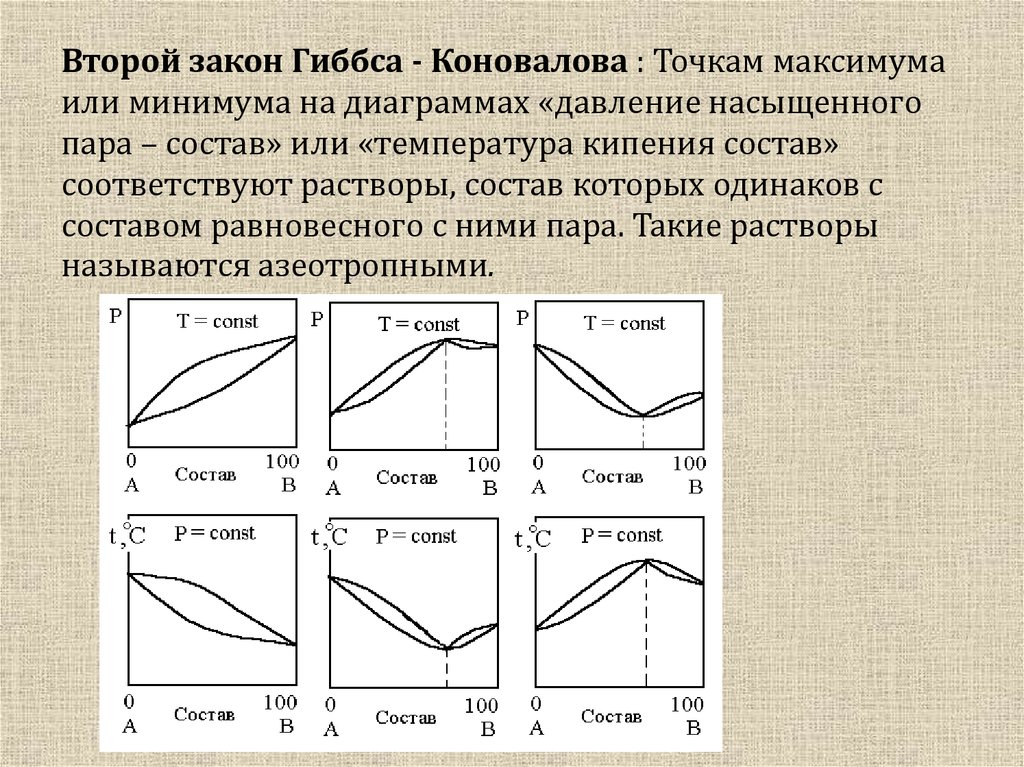 ретий
закон Гиббса-Коновалова гласит: в
изотермических или изобарических
условиях состав насыщенного пара и
состав жидкого ра-ра меняются синбатно
(составы обеих фаз меняются в одном
направлении).
Данный закон логично следует из
изученного материала и для его обоснования
достаточно еще раз внимательно изучить
диаграммы состояния, представленные,
например, на рис. 8.3 – 8.5.
Второй закон
Гиббса-Коновалова: точка максимума или
минимума на диаграммах «давление
насыщенного пара-состав» или «температура
кипения-состав» соответствуют ра-ры,
состав которых одинаков с составом
равновесного с ним пара. Такие ра-ры
называют азеотропными.
Равновесие
ж-пар в двухкомпонентных системах
Если
при образовании ра-ра не происходит
изменение объема (V=0) и энтальпии
системы (H=0), то такой ра-р называется
идеальным. Идеальные ра-ры образуются
тогда, когда исходные компонента близки
по свойствам (смеси изотопов, гомологов
и т.п.). Во всем интервале концентрации
ра-ритель А и ра-ренное вещество В
идеального ра-ра подчиняются закону
Рауля:
(7.1)
(7.2) где, PA
и РВ
– парциальные давления паров летучих
компонентов А и В над ра-ром.
и
- давление паров над чистыми компонентами.
и
- молярные доли этих компонентов в ра-ре
(
+
=1).
При невысоких давлениях пар можно
считать смесью идеальных газов. Тогда,
согласно закону Дальтона, общее давление
пара над идеальным ра-ром будет равно
сумме парциальных (частичных), давлений
пара компонентов:
(7.3)
ретий
закон Гиббса-Коновалова гласит: в
изотермических или изобарических
условиях состав насыщенного пара и
состав жидкого ра-ра меняются синбатно
(составы обеих фаз меняются в одном
направлении).
Данный закон логично следует из
изученного материала и для его обоснования
достаточно еще раз внимательно изучить
диаграммы состояния, представленные,
например, на рис. 8.3 – 8.5.
Второй закон
Гиббса-Коновалова: точка максимума или
минимума на диаграммах «давление
насыщенного пара-состав» или «температура
кипения-состав» соответствуют ра-ры,
состав которых одинаков с составом
равновесного с ним пара. Такие ра-ры
называют азеотропными.
Равновесие
ж-пар в двухкомпонентных системах
Если
при образовании ра-ра не происходит
изменение объема (V=0) и энтальпии
системы (H=0), то такой ра-р называется
идеальным. Идеальные ра-ры образуются
тогда, когда исходные компонента близки
по свойствам (смеси изотопов, гомологов
и т.п.). Во всем интервале концентрации
ра-ритель А и ра-ренное вещество В
идеального ра-ра подчиняются закону
Рауля:
(7.1)
(7.2) где, PA
и РВ
– парциальные давления паров летучих
компонентов А и В над ра-ром.
и
- давление паров над чистыми компонентами.
и
- молярные доли этих компонентов в ра-ре
(
+
=1).
При невысоких давлениях пар можно
считать смесью идеальных газов. Тогда,
согласно закону Дальтона, общее давление
пара над идеальным ра-ром будет равно
сумме парциальных (частичных), давлений
пара компонентов:
(7.3)
З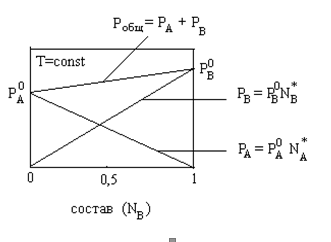 ависимость
общего и парциального давлений пара
от состава идеального ра-ра показано
на рис. 7.1.
ависимость
общего и парциального давлений пара
от состава идеального ра-ра показано
на рис. 7.1.
В большинстве случаев состав пара отличается от состава жидкого ра-ра, из которого он получен. Если пар подчиняется законам идеальных газов и находится в равновесии с идеальным ра-ром , то его состав можно найти, зная состав жидкого ра-ра:
; (7.4)
На практике имеют дело с неидеальными ра-рами, имеющими отклонения от идеальности, которые вызываются как физическими, так и химическими величинами (дипольные взаимодействия, поляризация, образования водородных связей, ассоциация, диссоциация, сольватация и др.). Отклонения могут быть положительными и отрицательными.
В
ра-рах с положительными отклонениями
от идеальности (рис. 7.2). U>0. Образование
таких ра-ров сопровождается поглощением
теплоты и увеличением объема.
Рис.7.2
В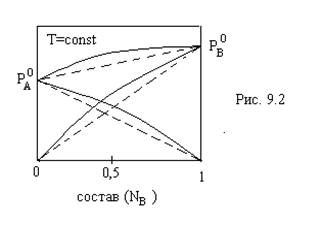 ра-рах с отрицательным отклонением от
идеальности U<0. Образование таких
ра-ров сопровождается выделением
теплоты и уменьшением объема. (рис.7.3)
ра-рах с отрицательным отклонением от
идеальности U<0. Образование таких
ра-ров сопровождается выделением
теплоты и уменьшением объема. (рис.7.3)
Д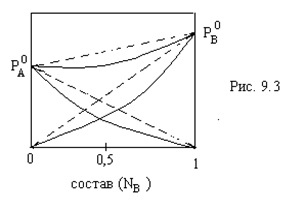 ля
неидеального ра-ра состав пара находиnся
не по уравнению (7.4), а экспериментальным
путем. Для изучения равновесия пар-жидкий
ра-р применяют два типа диаграмм
состояния: 1) диаграммы давления
пара-состав (Т=const) и 2) диаграммы
температура кипения-состав (P=const). Чаще
пользуются вторыми диаграммами. Разные
виды диаграмм даны на рис. 7.4.
ля
неидеального ра-ра состав пара находиnся
не по уравнению (7.4), а экспериментальным
путем. Для изучения равновесия пар-жидкий
ра-р применяют два типа диаграмм
состояния: 1) диаграммы давления
пара-состав (Т=const) и 2) диаграммы
температура кипения-состав (P=const). Чаще
пользуются вторыми диаграммами. Разные
виды диаграмм даны на рис. 7.4.
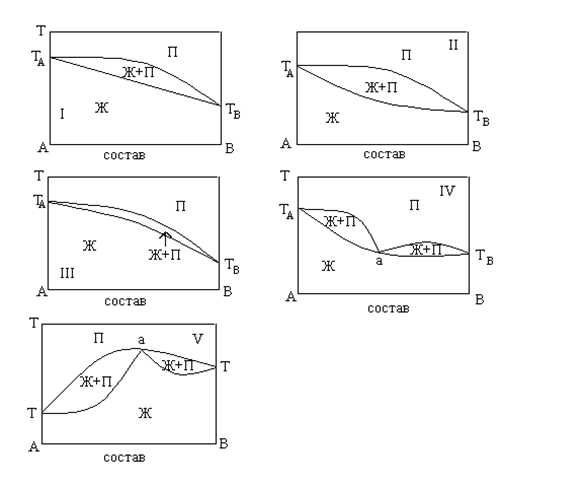 Диаграммы
кипения бинарных систем (изобары,
Р=const):
Диаграммы
кипения бинарных систем (изобары,
Р=const):
I – идеальный ра-р;
II – неидеальный ра-р с незначительным положительным отклонением;
III – неидеальный ра-р с незначительным отрицательным отклонением;
IV - неидеальный ра-р со значительным положительным отклонением;
V - неидеальный ра-р со значительным отрицательным отклонением от закона Рауля.
На этих диаграммах фигуративные точки TA и TB изображают температуры кипения чистых компонентов при данном внешнем давлении P. Каждая из диаграмм кипения имеет две кривые, разделяющие диаграмму на три области:
1) Область пара (П) 2) Область жидкости (Ж) 3) Область равновесия пара и жидкости ( ).
Число степеней свободы соответственно равно: С1=2-1+1=2 С2=2-1+1=2 С3=2-2+1=1
Фигуративные точки, лежащие на нижней кривой, характеризуют составы кипящих жидкостей и температуры при которых начинают кипеть жидкости заданного состава при данном давлении Р. Фигуративные точки, лежащие на верхней кривой, характеризуют составы насыщенного пара и температуры, при которой исчезают последние капли жидкости при кипении исходных смесей.
Характерной особенностью неидеальных ра-ров со значительным положительным или отрицательным отклонениями от закона Рауля является их способность образовывать азеотропные смеси, которые на диаграммах состояния изображена точкой а.
Азиотропные смеси – это ра-ры при испарении которых получается пар того же состава, что и исходная жидкая смесь. На диаграммах появляются экстремальные точки а.
Поскольку азеотропные смеси кипят при данном внешнем давлении при постоянной температуре ,как и чистые вещества ,то правило фаз для них рассчитывается так:
С=2-2+1-1=0
По диаграммам состояния можно определять качественные и количественные состава равновесных фаз. Рассмотрим диаграмму (Рис. 7.5.).
Д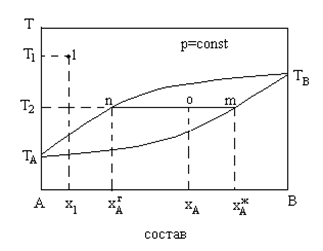 иаграмма
кипения системы для азеотропной смеси.
иаграмма
кипения системы для азеотропной смеси.
Точка 1 – фигуративная точка, отвечающая составу Х1. Отрезок АХ1 определяет массовую долю компонента В в данной системе, а отрезок ВХ1 – массовую долю компонента А. Внутри «линзы» система имеет гетерогенность. Точка О отвечает составу ХА. При проведении соединительной прямой (ноды) получаем точки n и m, проекции которых на горизонтальную ось дают составы парообразной и жидкой фаз соответственно.
Для определения количественных соотношений между фазами применяют «правило рычага». Для точки О масса системы m=m*+mП. Из уравнения mxA=m* +mП+m ,
выражающего распределение вещества А между жидкой и парообразными фазами получаем: (7.5) Масса равновесных фаз обратно пропорционально отрезкам, но которые делит ноду фигуративная точка гетерогенной системы.
Бинарные
системы с образованием эвтектики с тв
ра-рами, с конгруэнтной и инкогруэнтной
tпл.
Диаграмма
состояния системы с эвтектикой.
Наиболее проста диаграмма состояния
системы, в которой компоненты
неограниченного смешиваются в жидком
состоянии, совершенно не смешиваются
в твердом, химически не взаимодействуют
друг с другом и не образуют твердых
ра-ров. Образование таких диаграмм
наблюдается, как правило, в том случае,
когда компоненты А и В имеют разные
типы кристаллических решеток и различные
размеры радиусов частиц решетки, или
при наличии одинакового типа решетки
резко различных радиусов частиц.
Диаграмма состояния системы с простой
эвтектикой для компонентов А и В
схематически представлена на рис.2
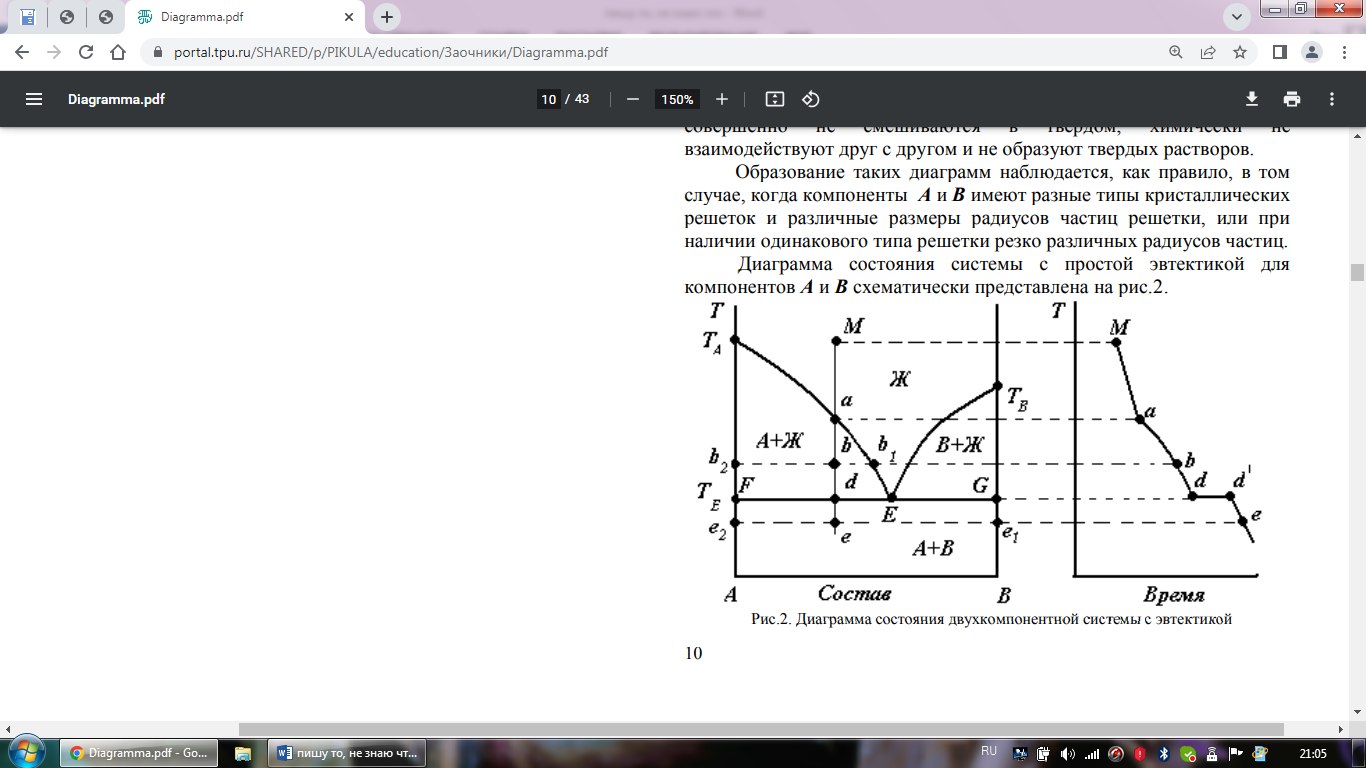
Эвтектика – механическая смесь кристаллов двух компонентов, обладающая самой низкой температурой кристаллизации (плавления).
Фазовая диаграмма с конгруэнтно плавящимся химическим соединением Если компоненты А и В образуют одно устойчивое химическое соединение состава АхВy , плавящееся без разложения, то на диаграмме состояния кривая ликвидуса образует максимум в точке Д (рис.4). В этой точке состав кристаллической фазы совпадает с составом жидкой фазы. В случае, если максимум на диаграмме имеет острую форму, химическое соединение АВ устойчиво при плавлении; если максимум «пологий», то химическое соединение частично диссоциирует при плавлении. Как видно из рис.4, фазовая диаграмма представляет собой как бы две диаграммы с простой эвтектикой: А-АВ и В-ВА. Можно разделить такую диаграмму на две части по вертикали, соответствующей химическому соединению, и рассматривать каждую часть диаграммы отдельно.
Диаграммы с конгруэнтно плавящимися химическими соединениями образуют системы: Ca-Mg, Mg-Pb, Mg-Sn, NaF-AlF3.
Ф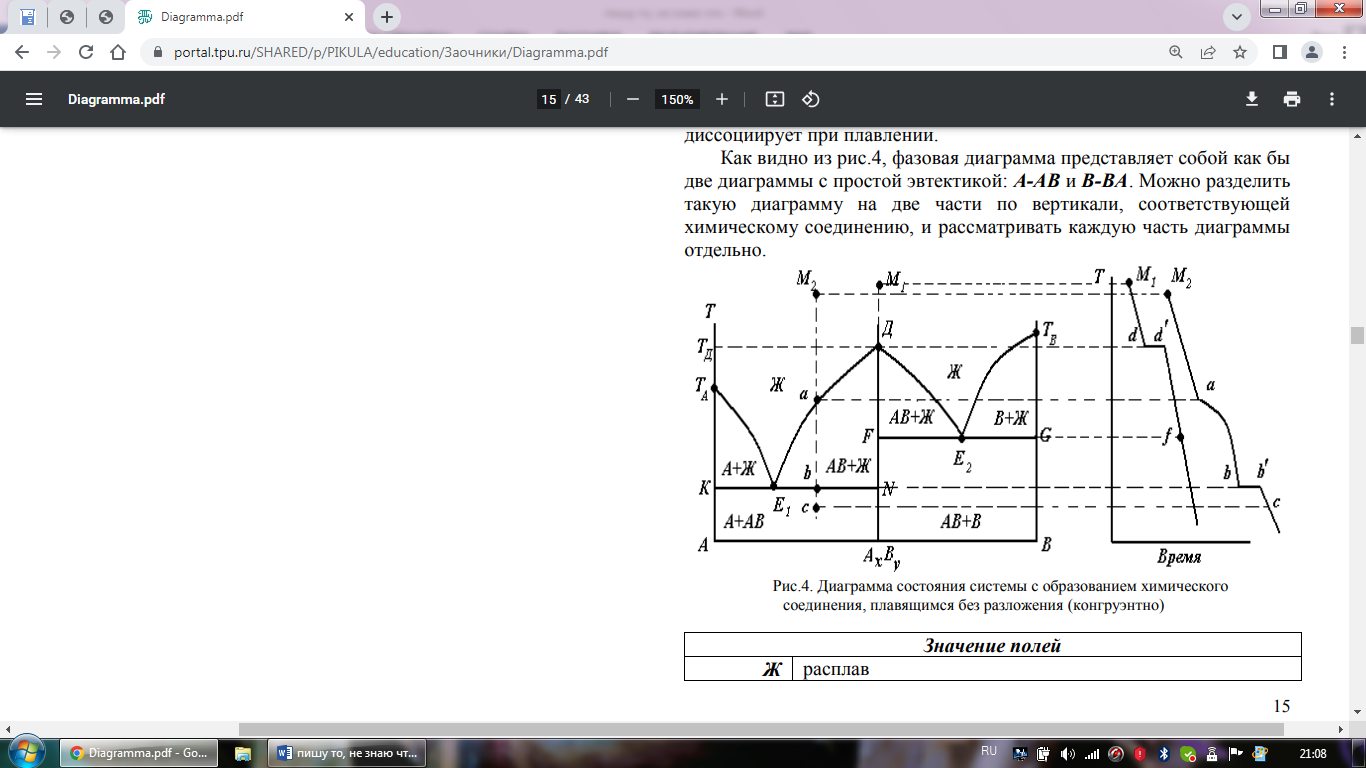 азовая
диаграмма с инконгруэнтно плавящимся
химическим соединением
азовая
диаграмма с инконгруэнтно плавящимся
химическим соединением
Диаграмма, когда компоненты А и В могут образовывать химическое соединение АхВy, плавящееся с разложением, т.е. инконгруэнтно, приведена на рис.5.
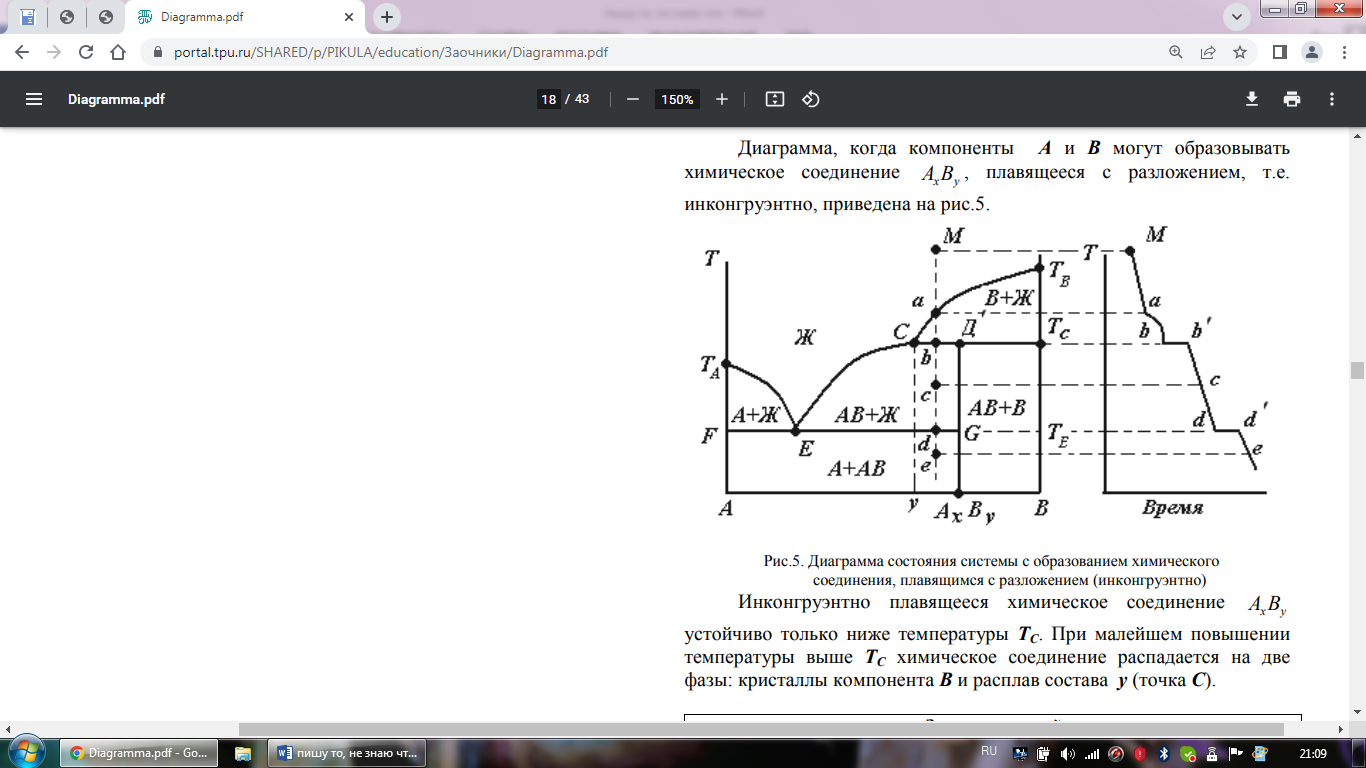 Инконгруэнтно
плавящееся химическое соединение АхВy
устойчиво только ниже температуры ТС.
При малейшем повышении температуры
выше ТС химическое соединение распадается
на две фазы: кристаллы компонента В и
расплав состава y (точка С).
Инконгруэнтно
плавящееся химическое соединение АхВy
устойчиво только ниже температуры ТС.
При малейшем повышении температуры
выше ТС химическое соединение распадается
на две фазы: кристаллы компонента В и
расплав состава y (точка С).
Диаграммы с инконгруэнтно плавящимися химическими соединениями образуют системы: Al2O3 - SiO2, CaSiO3 - BaSiO3, Fe - P, Li - Sn и др.
Твердые ра-ры – гомогенные системы переменного состава, состоящие из двух или более компонентов.
Ф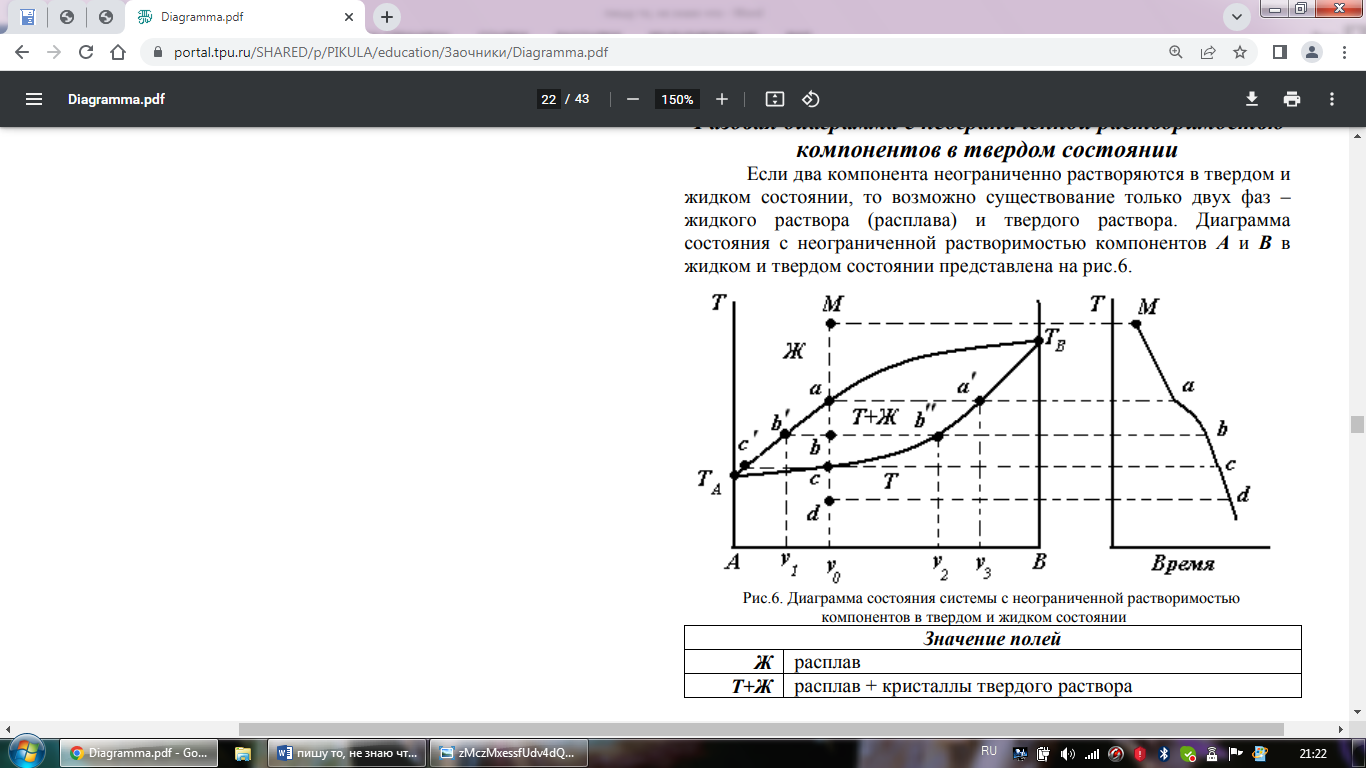 азовая
диаграмма с неограниченной ра-римостью
компонентов в твердом состоянии
азовая
диаграмма с неограниченной ра-римостью
компонентов в твердом состоянии
Если два компонента неограниченно ра-ряются в твердом и жидком состоянии, то возможно существование только двух фаз – жидкого ра-ра (расплава) и твердого ра-ра. Диаграмма состояния с неограниченной ра-римостью компонентов А и В в жидком и твердом состоянии представлена на рис.6.
Фазовые диаграммы с ограниченной ра-римостью компонентов в твердом состоянии
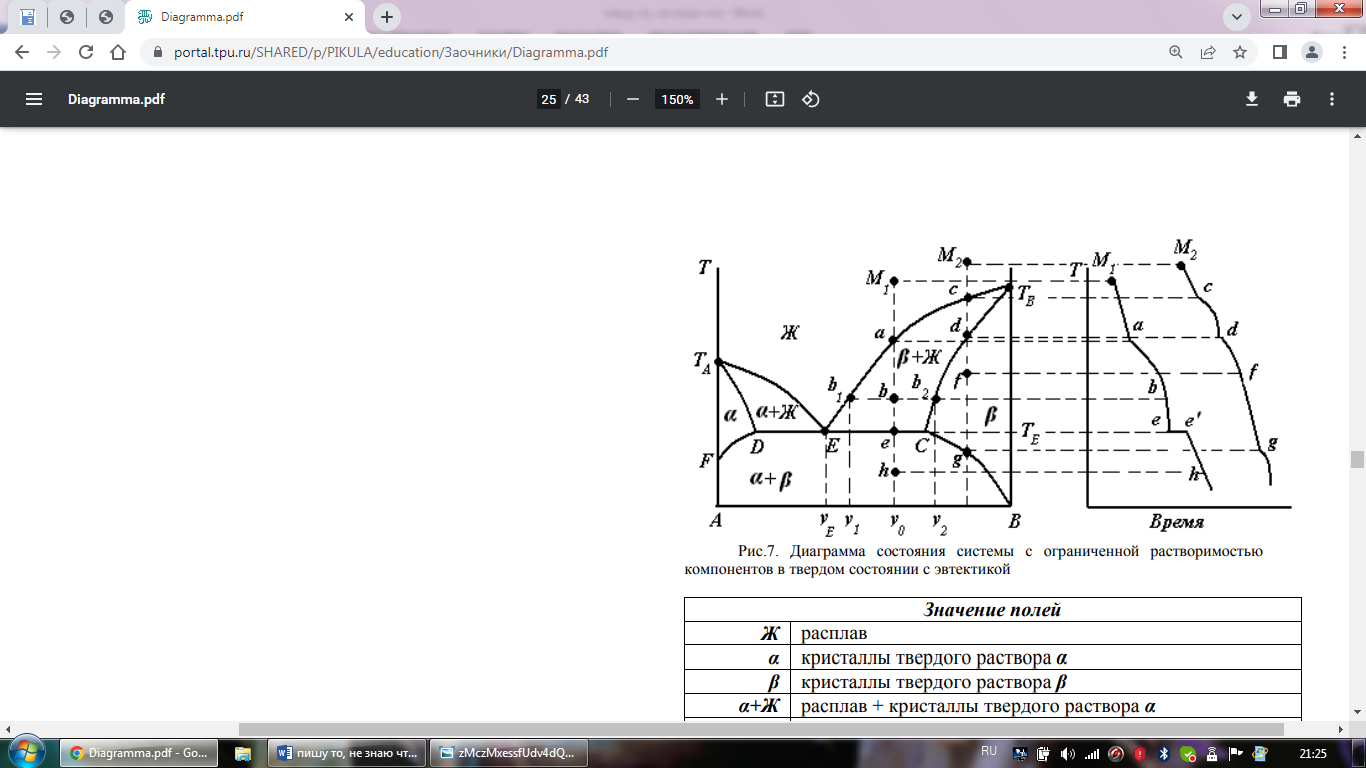
Различают два типа диаграмм: 1.Диаграмма с эвтектикой (I типа) – твердые ра-ры образуют эвтектическую смесь. 2.Диаграмма с перитектикой (II типа) – твердые ра-ры образуют перитектическую смесь (один из твердых ра-ров устойчив только до определенной температуры).
Диаграммы состояния с ограниченной ра-римостью компонентов с эвтектикой (I типа)
В такой системе не образуются фазы, представляющие собой чистые компоненты. Из расплава могут кристаллизоваться только твердые ра-ры α или β.
 Диаграммы
состояния с ограниченной ра-римостью
компонентов с перитектикой (II типа)
Диаграммы
состояния с ограниченной ра-римостью
компонентов с перитектикой (II типа)
Рассмотрим фазовую диаграмму образования твердых ра-ров с ограниченной ра-римостью компонентов и с образованием перитектической смеси (рис.8).
Расчеты выходов продуктов для неидеальных систем
Д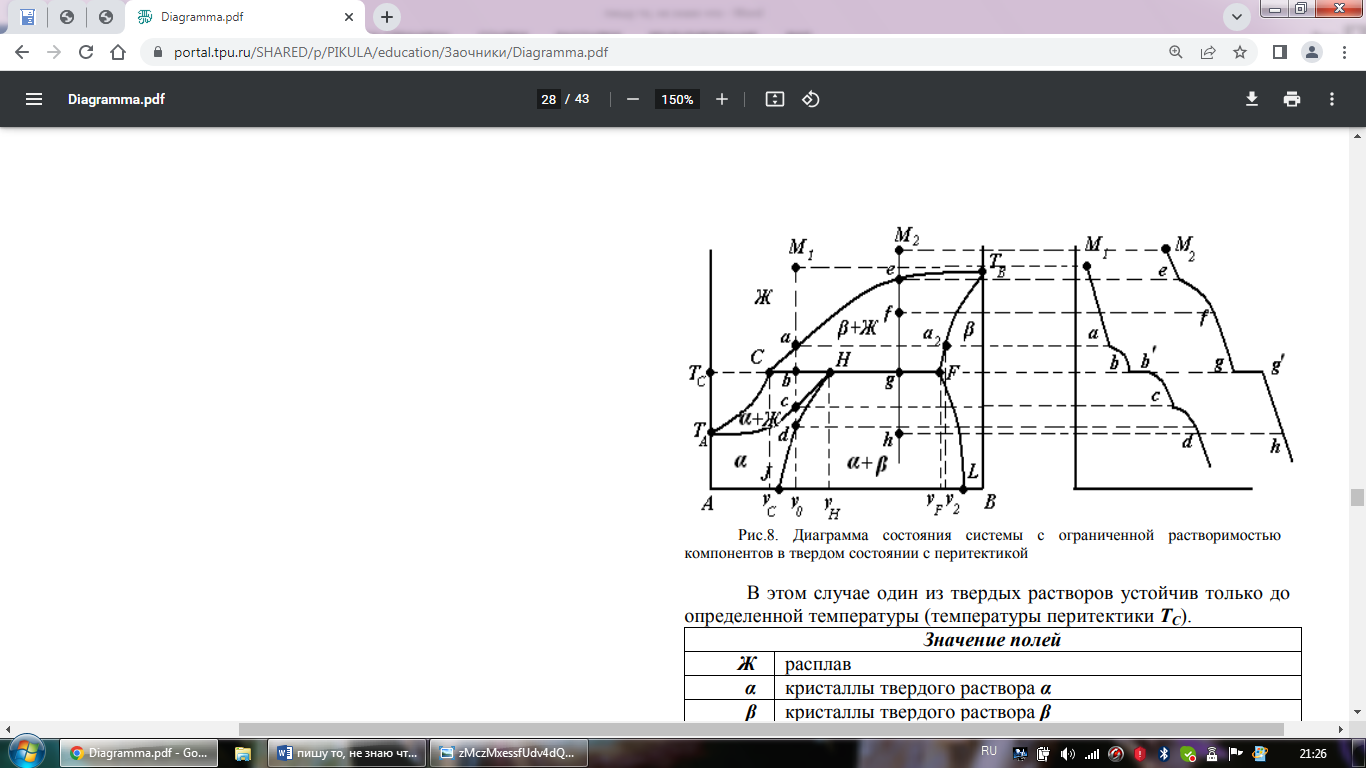 ля
расчета равновесного состава была
введена универсальная величина –
химическая переменная или глубина
превращения ξ (кси), равная отношению
изменения количества вещества данного
реагента или продукта реакции к его
стехиометрическому коэффициенту в
уравнении химической реакции:
ля
расчета равновесного состава была
введена универсальная величина –
химическая переменная или глубина
превращения ξ (кси), равная отношению
изменения количества вещества данного
реагента или продукта реакции к его
стехиометрическому коэффициенту в
уравнении химической реакции:
![]() ,
,
где знак “+” используется для продуктов реакции, а знак “ – “ для исходных веществ.
Равновесное
количество вещества для каждого
участника реакции выразим через глубину
превращения:
![]()
Подставив полученное выражение в уравнение, связывающее термодинамическую Ka = и практическую Kn константы равновесия, получим
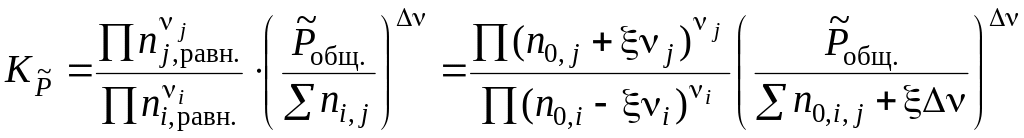
Решив это уравнение относительно химической переменной ξ, можно рассчитать: равновесные количества вещества каждого участника реакции, равновесные концентрации реагентов, степень превращения исходных веществ и выход продуктов реакции.
Зависимость выхода от природы инертного ра-рителя
Инертные ра-рители не способны отдавать протоны, они также не способны изменять основных, кислых или амфотерных свойств химических соединений, которые в них ра-рены. К группе углеводных ра-рителей относятся углеводороды и их галогенопроизводные. Инертные ра-рители применяют для того, чтобы замедлить скорость присоединения. Но есть жидкости, например, ледяная уксусная кислота, которые применяют в качестве ра-рителя. В ней отлично ра-ряются бромистый и хлористый водород.
Также инертные ра-рители применяются для смол, у которых плохая вязкость. В природе существуют инертные ра-рители, которые не проявляют своих основных или кислотных свойств – это диоксан, гексан, диоксан, бензол, ацетон и хлороформ. Инертные ра-рители помогают выделяться продуктам нейтрализации в форме кристаллов. Это очень помогает при титровании, потому что помогает усиливать четкость цветовых переходов на индикаторе, к примеру, когда отделятся сульфамиды.
Идеальные жидкие ра-ры и их св-ва. Под идеальным обычно понимают ра-р, для компонентов которого при всех составах и температурах выполняется закон Рауля. Согласно закону Рауля,
Давление
пара ра-рителя pi
над ра-ром пропорционально
мольной
доле
ра-рителя
xi
в
ра-ре: pi
=
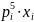
Для
бинарного
ра-ра
закон
Рауля
можно
представить
в
следую
щем
виде:
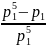 = 1 – x1
= x2,
то
есть
относительное
понижение
давления
пара
ра-рителя
над
рас-
твором
равно
мольной
доле x2
ра-ренного
вещества.
= 1 – x1
= x2,
то
есть
относительное
понижение
давления
пара
ра-рителя
над
рас-
твором
равно
мольной
доле x2
ра-ренного
вещества.
Общее
давление
пара
над
ра-ром
равно
сумме
парциальных
дав-
лений
p1
и
p2:
p
= p1
+ p2
=
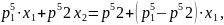 то
есть
давление
пара
линейно
зависит
от
состава
ра-ра.
то
есть
давление
пара
линейно
зависит
от
состава
ра-ра.
Закон
Рауля и его т/д вывод
При
равновесии химический потенциал
вещества одинаков во всех существующих
фазах. Очевидно, хим. Потенциал компонента
жидкого ра-ра μi(Ж) будет
равен химическому потенциалу пара
этого компонента μi(П) над
ра-ром: μi(Ж)=
μi(П).
Подставляем
уравнения химических потенциалов
идеальных ра-ров
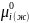 + RTln
xi
=
+ RTln
xi
=
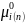 + RTln
pi
+ RTln
pi
Давление пара вещества над чистым ра-рителем равно Р0i, поэтому при хi=1 (чистое вещество) уравнение переходит в = + RTln p0i
Подстановка соотношения (2) в (1) дает + RTln p0i + RTln xi = + RTln pi. Откуда после небольших упрощений получается уравнение р1=р01х1
Если ра-р состоит из 2-х летучих компонентов. А пар обладает свойствами идеального газа, то закон Рауля будет справедлив как для р-ля, так и для ра-ренного вещества: р1=р01х1 (3); Р2=р02х2 (4)
