
Гомеостаз
.docx1. Внутренняя среда организма, ее основные составляющие. Гомеостаз. Значение гомеостаза. Основные показатели состояния внутренней среды - константы внутренней среды. Принципы поддержания констант внутренней среды.
Внутренняя среда организма включает все жидкости внеклеточного пространства: интерстициальную, или тканевую жидкость, кровь, лимфу, трансцеллюлярные жидкости, заполняющие полости организма и некоторых органов: спинномозговую, внутриглазную, внутрисуставную (синовиальную) жидкость, жидкости серозных пространств (плевральную, перикардиальную).
Гомеостаз – поддержание постоянства внутренней среды организма. Это постоянство достигается благодаря деятельности нервной и эндокринной систем, которые «следят» за составом и свойствами внутренней среды и при их изменениях влияют на работу различных систем организма таким образом, чтобы эти изменения были устранены.
Гомеостатические константы — это контролируемые гомеостатической системой параметры (показатели), отражающие её функциональное состояние. Гомеостаз определяет динамическое постоянство внутренней среды и ее колебания в допустимых пределах.
Основные константы гомеостаза:
1. Жёсткие: коллоидно-осмотическое давление крови и тканевой жидкости, рН крови и тканевой жидкости, ионный состав крови, температура тела, уровень глюкозы в крови, количество белков, газовый состав крови.
2. Пластичные: объём циркулирующей крови, количество форменных элементов, гемоглобина, гематокрит, СОЭ, кровяное давление.
Принципы поддержания констант внутренней среды:
1. Принцип неравновесности или градиента — это свойство живых систем поддерживать динамическое неравновесное состояние, асимметрию относительно окружающей среды. Например, температура тела теплокровных животных может быть выше или ниже температуры окружающей среды;
2. Принцип замкнутости контура регулирования. Каждый организм не просто отвечает на раздражение, а еще и оценивает соответствие ответной реакции действующему раздражителю. Чем сильнее раздражитель, тем больше ответная реакция. Принцип осуществляется за счет положительной и отрицательной обратной связи в нервной и гуморальной регуляции, т.е. контур регуляции замкнут в кольцо. Например, нейрон обратной афферентации в двигательных рефлекторных дугах;
3. Принцип прогнозирования. Биологические системы способны прогнозировать результат ответной реакции на основе прошлого опыта. Например, избегание уже знакомых болевых раздражителей;
4. Принцип целостности. Для нормального функционирования организма необходима его целостность.
2. Кислотно-щелочное состояние крови. Значение постоянства pH для организма. Диапазон нормальных значений pH и понятие о возможных отклонениях от нормы. Системы, поддерживающие постоянство pH.
Значение кислотно-щелочного равновесия определяется прежде всего тем, что белки, будучи амфотерными соединениями, при изменениях реакции среды меняют свою конформацию; следовательно, изменяются активность ферментов, функция рецепторов (для гормонов, медиаторов и т. п.), структура ионных каналов и так далее. В связи с этим реакция внутренней среды, и в том числе крови, является одной из самых жестких констант.
К![]() оличественным
показателем реакции среды является
водородный показатель
рН, отражающий
концентрацию свободных ионов водорода.
Точнее, рН равен отрицательному
десятичному логарифму этой концентрации:
оличественным
показателем реакции среды является
водородный показатель
рН, отражающий
концентрацию свободных ионов водорода.
Точнее, рН равен отрицательному
десятичному логарифму этой концентрации:
Например, если концентрация ионов водорода равна 10-8 моль/л, то рН=8.
В норме рН колеблется от 7,35 (для венозной крови) до 7,4 (для артериальной крови). Предельные значения рН, совместимые с жизнью, составляют 6,8—8,0.
Отклонение рН в кислую сторону называется ацидозом, в щелочную — алкалозом. В клинике об ацидозе или алкалозе говорят не только при явных сдвигах рН, но также при таких изменениях в системах регуляции кислотно-щелочного равновесия, при которых эти сдвиги могут наступить.
Постоянство рН поддерживается:
1. Буферными системами;
2. Выделительными системами — легкими и почками.
Буферные системы сглаживают резкие колебания рН при внезапном увеличении содержания кислых либо щелочных продуктов в крови, но не выводят эти продукты из организма. За выведение же кислых и щелочных продуктов отвечают выделительные системы.
3. Принцип работы буферных систем. Состав буферных систем. Буферная емкость. Буферные системы организма, их состав и функциональное значение. Особая роль бикарбонатного буфера. Выделительные системы, их функция по поддержанию pH.
Буферные системы — это такие химические системы, рН которых не изменяется (точнее, мало изменяется) при добавлении некоторого количества кислоты либо основания.
К![]() омпонентами
буферных систем являются любые вещества,
способные сравнительно прочно, но
обратимо связывать протоны:
омпонентами
буферных систем являются любые вещества,
способные сравнительно прочно, но
обратимо связывать протоны:
Е
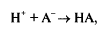 сли
к раствору такого вещества добавить
сильную (то есть легко диссоциирующую
с образованием протонов) кислоту, то
равновесие сместится в сторону НА:
сли
к раствору такого вещества добавить
сильную (то есть легко диссоциирующую
с образованием протонов) кислоту, то
равновесие сместится в сторону НА:
В результате протоны будут связаны, и рН (показатель концентрации свободных протонов!) не изменится.
Е
 сли
к раствору такого вещества добавить
основание (диссоциирующее с образованием
гидроксид-ионов), то равновесие, напротив,
сместится в сторону Н+
+ А-:
сли
к раствору такого вещества добавить
основание (диссоциирующее с образованием
гидроксид-ионов), то равновесие, напротив,
сместится в сторону Н+
+ А-:
В результате протоны высвободятся, нейтрализуют гидроксид-ионы, рН тоже не изменится:
![]()
В большинстве случаев буферными веществами являются анионы слабых кислот, то есть плохо диссоциирующих кислот, в которых протоны связаны прочно, хотя и обратимо. Буферные системы, как правило, состоят из слабой кислоты и ее аниона в виде соли с сильным основанием (поскольку соли слабых кислот и слабых оснований обычно плохо диссоциируют):
1. При добавлении к такой системе кислоты анион соли связывает протоны;
2. При добавлении к такой системе основания кислота высвобождает протоны.
Количественно буферная система характеризуется буферной емкостью. Этот показатель отражает, какое количество кислоты или щелочи надо добавить к буферной системе, чтобы рН раствора изменился на 1.
рН буферной системы определяется соотношением буферных компонентов (кислоты и соли). Если это соотношение не меняется (например, оба компонента возрастают в одинаковой степени), то не меняется и рН буферной системы.
В организме существуют четыре буферные системы:
1. Бикарбонатный буфер;
2. Фосфатный буфер;
3. Белковый буфер;
4. Гемоглобиновый буфер (являющийся, разумеется, частью белкового буфера, но выделяемый отдельно в связи с особой локализацией — внутри эритроцитов).
Бикарбонатный буфер
Этот буфер образован угольной кислотой и ее натриевой солью (Nа+ — главный внеклеточный катион), то есть бикарбонатом натрия: Н2СО3 + NaНСО3.
При добавлении к бикарбонатному буферу кислоты протоны связываются с бикарбонатом:
![]()
В результате вместо сильной кислоты образуется слабая (плохо диссоциирующая) угольная кислота, и рН меняется мало.
При добавлении к бикарбонатному буферу основания протоны высвобождаются угольной кислотой и нейтрализуют гидроксил:

В результате вместо основания образуется соль, и рН также меняется мало.
Бикарбонатный буфер — не самый мощный буфер организма, по буферной емкости он существенно уступает, в частности, гемоглобиновому. Однако он играет самую большую физиологическую роль в связи со следующими моментами: это главный буфер плазмы (фосфатный, белковый и гемоглобиновый — это преимущественно внутриклеточные буферы, а фосфатный буфер — еще и важный буфер мочи); содержание обоих его компонентов — угольной кислоты и бикарбоната — непосредственно регулируется системами выделения: почки выводят бикарбонат, а легкие — углекислый газ, образующийся при распаде угольной кислоты.
Фосфатный буфер
Этот буфер образован одно- и двузамещенной солями фосфорной кислоты: НРО42- и H2PO4-.
При добавлении к фосфатному буферу кислоты протоны связываются с однозамещенной солью:
![]()
При добавлении к фосфатному буферу основания протоны высвобождаются двузамещенной солью и нейтрализуют гидроксид-ион:
![]()
Фосфатный буфер выполняет следующие функции: это важнейший буфер мочи; это один из внутриклеточных буферов. В плазме его роль невелика.
Белковый буфер
Буферные свойства белков обусловлены наличием у аминокислот групп, способных обратимо связывать протоны. Белковый буфер — главный внутриклеточный буфер. Определенную буферную роль играют и белки плазмы.
Гемоглобиновый буфер
Буферные свойства гемоглобина обусловлены его белковой частью (глобином), в которой, как и в других белках, имеются группы, способные обратимо связывать протоны. Большая роль гемоглобинового буфера, благодаря которой его выделяют как отдельную буферную систему, обусловлена следующими моментами: это самый мощный буфер организма; это единственный буфер эритроцитов; его буферная емкость зависит от того, в какой мере гемоглобин насыщен кислородом.
Даже в норме организм постоянно подвергается воздействиям, стремящимся нарушить кислотно-щелочное равновесие.
В процессе метаболизма вырабатываются кислые вещества, прежде всего — СО2, но также другие, нелетучие кислоты.
В ЖКТ: всасываются кислые и щелочные вещества (компоненты пищи, лекарственные средства и пр.); секретируются в просвет желудка и кишечника кислые (соляная кислота в желудке) и щелочные (бикарбонаты в кишечнике) вещества; при секреции соляной кислоты в крови остаются щелочные вещества, при секреции бикарбонатов — кислые.
Буферные системы не могут выводить все эти вещества из организма; они могут лишь временно сглаживать вызванные этими веществами изменения рН. В то же время кислые и щелочные вещества должны быстро выводиться в таком же количестве, в котором они поступают в кровь. Эту функцию выполняют выделительные системы — легкие и почки:
1. Легкие выводят летучие вещества, прежде всего — СО2;
2. Почки выводят нелетучие вещества, прежде всего, — бикарбонат.
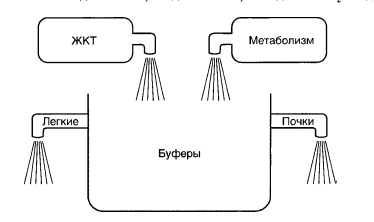
Как говорилось выше, особую физиологическую роль играет бикарбонатный буфер, так как он, с одной стороны, является главным буфером плазмы, с другой — взаимодействует с выделительными системами. Рассмотрим подробно это взаимодействие.
Компоненты бикарбонатного буфера — это угольная кислота Н2СО3 и бикарбонат НСО3-. Угольная кислота способна распадаться на СО2 и Н2О (под действием фермента карбоангидразы),
а концентрация СО2 в крови регулируется легкими: избыток СО2 вызывает усиление интенсивности дыхания и, следовательно, выведения СО2. Недостаток СО2, напротив, вызывает снижение интенсивности дыхания и задержку СО2. С другой стороны, концентрация бикарбоната в крови регулируется почками: при избытке НСО3—, усиливается его выведение с мочой, при недостатке — наоборот.
Итак, при поступлении в кровь любых кислых соединений они прореагируют с бикарбонатом, что приведет к снижению концентрации NаНСО3 и повышению концентрации Н2СО3; в ответ на это почки уменьшат выведение НСО3—, а легкие увеличат выведение СО2 (и тем самым — Н2СО3). В результате концентрации компонентов бикарбонатного буфера восстановятся. При поступлении в кровь щелочных веществ произойдут обратные процессы.
Все буферные системы находятся друг с другом в состоянии динамического равновесия, постоянно обмениваясь друг с другом: например, при высвобождении протонов гемоглобиновым буфером они будут связаны бикарбонатом. Это означает, что если поддерживается нормальное состояние бикарбонатного буфера (то есть нормальное соотношение его компонентов), то тем самым будет автоматически поддерживаться и нормальное состояние остальных буферов.
4. Кислые и основные вещества, поступающие в кровь, и способы их выведения. Компенсированный и некомпенсированный. Отличия респираторного от метаболического ацидоза и алкалоза.
В норме задача выделительных систем — удалять кислые и щелочные вещества с такой же скоростью, с какой они поступают в кровь. Рассмотрим обычное суточное поступление и выведение кислых и щелочных веществ.
Подавляющая часть кислых веществ приходится на СО2 — главный продукт распада всех веществ (белков, липидов, углеводов, нуклеиновых кислот). Будучи летучим соединением, СО2 удаляется легкими. Сам по себе СО2, разумеется, кислотой не является, но при соединении с водой образует угольную кислоту Н2СО3.
Небольшое количество нелетучих кислот (в 200—300 раз меньше, чем СО2) образуется в процессе метаболизма (продукт окисления серосодержащих аминокислот — серная кислота; продукт распада нуклеиновых кислот — мочевая кислота; в определенных условиях — молочная кислота, кетоновые тела и пр.). Еще меньшее количество нелетучих кислых веществ (иногда, в зависимости от характера питания, щелочных) поступает из ЖКТ. Все нелетучие кислоты сначала реагируют в крови с бикарбонатом; затем они удаляются почками (серная кислота в виде сульфата) или метаболизируются (молочная кислота, кетоновые тела), а концентрация бикарбоната в крови восстанавливается почками. Более того, в почках может образовываться и поступать в кровь дополнительное количество бикарбоната. Таким образом, в норме выделительные системы поддерживают на постоянном уровне концентрации обоих компонентов бикарбонатного буфера — Н2СО3 (путем поддержания постоянства СО2) и NaНСО3.
В случае если какая-то из выделительных систем (легкие либо почки) не справляется с выведением кислых или щелочных веществ либо, напротив, выводит их в избытке, принцип регуляции кислотно-щелочного равновесия становится иным: если нет возможности вывести избыток какого-либо вещества (кислоты или щелочи), то в организме задерживается противоположное вещество (щелочь или кислота) (и наоборот, если в избытке теряется какое-то вещество, то усиленно выводится и противоположное вещество).
Представим себе, например, что возникло нарушение дыхания — снизилось выделение легкими СО2, и это соединение накапливается в крови. В ответ на это почки уменьшают выделение бикарбоната. В результате нарастает содержание в крови одновременно и СО2, и НСО3-, а, как мы уже знаем, если соотношение между концентрациями буферных компонентов не меняется, то не меняется и рН.
Иными словами, при нарушениях в деятельности одной из выделительных систем задача второй выделительной системы заключается в том, чтобы поддерживать на постоянном уровне не абсолютные концентрации компонентов бикарбонатного буфера, а соотношение между этими концентрациями.
Таким образом, при нарушениях кислотно-щелочного равновесия имеются отклонения двух типов:
1. Первичное, обусловленное нарушением выведения какого-либо из компонентов бикарбонатного буфера одной из выделительных систем (легкими или почками);
2. Компенсаторное — задержка или усиленное выведение другого компонента второй выделительной системой;
Причем отклонения эти однонаправленные: первичное накопление СО2 приведет к компенсаторному накоплению НСО3-, первичная потеря НСО3- приведет к компенсаторному усиленному выведению СО2.
Из приведенной схемы видно, что нарушения кислотно-щелочного равновесия (ацидоз и алкалоз) могут быть вызваны: нарушениями метаболизма; нарушениями функции ЖКТ или поступлением в ЖКТ больших количеств кислых или щелочных соединений; нарушениями дыхания; нарушениями функции почек.
Лабораторная диагностика нарушений кислотно-щелочного равновесия основана на определении соотношения между кислыми и щелочными компонентами буферных систем.
В связи с этим все нарушения кислотно-щелочного равновесия разделяют на:
1. Респираторные (газовые, дыхательные), связанные с нарушениями выделения легкими СО2;
2. Нереспираторные (негазовые). В клинике последние неточно называют метаболическими. Важно помнить, что так называемые метаболические нарушения (например, метаболический ацидоз) могут быть обусловлены не только расстройствами собственно метаболизма, но и поражениями почек, ЖКТ, отравлениями кислыми либо щелочными соединениями.
Как говорилось в начале раздела, об ацидозе или алкалозе говорят не только при явных сдвигах рН, но также при таких изменениях в системах регуляции кислотно-щелочного равновесия, при которых эти сдвиги могут наступить. Таким образом, выделяют:
1. Компенсированные нарушения кислотно-щелочного равновесия (ацидоз или алкалоз), при которых рН остается в пределах нормы, но имеются изменения в составе буферных систем;
2. Некомпенсированные нарушения кислотно-щелочного равновесия, при которых значения рН выходят за пределы нормы.
Выше мы выяснили, что при нарушении деятельности одной из выделительных систем (легких или почек) наступают компенсаторные изменения в деятельности второй системы. Эти изменения направлены на то, чтобы поддержать соотношение между концентрациями компонентов бикарбонатного буфера; если это соотношение остается постоянным, то не меняется и рН (а также состояние прочих буферных систем).
Таким образом, главные отличия компенсированных нарушений кислотно-щелочного равновесия от некомпенсированных следующие.
1. При компенсированных нарушениях: рН в пределах нормы; абсолютные значения концентраций СО2 и НСО3- изменены однонаправленно (оба увеличены или уменьшены) и в одинаковой степени; соотношение концентраций СО2 и НСО3- в пределах нормы.
2. При некомпенсированных нарушениях: рН выходит за пределы нормы; абсолютные значения концентраций СО2 и НСО3- изменены однонаправленно, но в разной степени; соотношение концентраций СО2 и НСО3- изменено.
5. Осмос и осмотическое давление. Факторы, определяющие осмотическое давление раствора. Показатели осмотического состояния раствора: осмотическое давление, осмолярность, осмоляльность и тоничность, их связь. Изотонические, гипертонические и гипотонические растворы.
Предположим, что некий сосуд разделен на две части избирательно проницаемой мембраной. В левый отсек (1) налита вода, в правый (2) — раствор некоего вещества. Очевидно, что если мембрана будет проницаема для данного вещества, то оно пойдет путем диффузии в отсек 1 по своему концентрационному градиенту. Но если мембрана будет проницаема только для воды, то, напротив, вода пойдет в отсек 2 по своему концентрационному градиенту — концентрация (массовая доля) воды в отсеке 1 больше, чем в отсеке 2. При этом объем раствора в отсеке 1 будет снижаться, в отсеке 2 — повышаться. Такой переход воды из раствора с меньшей концентрацией растворенных веществ в раствор с большей концентрацией называется осмосом.
Представим себе теперь, что мы закрыли отсек 2 поршнем и прикладываем к этому поршню такое давление, при котором переход воды прекратится (объемы отсеков меняться не будут). В этом случае давление, действующее на поршень, будет равно тому давлению, с которым раствор в отсеке 2 притягивает воду, то есть осмотическому давлению.
Осмотическое давление (в идеальном случае) не зависит от природы частиц, а зависит только от их числа в единице объема раствора. Иными словами, 100 мелких ионов Nа+ создадут такое же осмотическое давление, как 100 крупных молекул глюкозы.
Для живых клеток и внутриклеточная, и внеклеточная жидкость представляют собой растворы, в которых большинство частиц — это ионы (во внеклеточной жидкости — в основном Nа+ и Cl-, во внутриклеточной — К+ и Cl-). Мембраны клеток гораздо более проницаемы для воды, чем для ионов. В связи с этим, например, при повышении внеклеточной концентрации ионов (осмотического давления внеклеточной жидкости) вода будет выходить из клеток, а при снижении — входить. Однако если некое вещество легко проходит через мембраны, то при повышении его внеклеточной концентрации не вода будет выходить из клеток, а это вещество будет в них входить. Следовательно, эффективное осмотическое давление создают только непроникающие (или плохо проникающие) через клеточные мембраны вещества.
Таким образом, значение осмоса и осмотического давления для организма заключается в том, что от осмотического давления зависит переход воды через клеточные мембраны, то есть — объем клеток.
Осмотическое давление
Сущность осмотического давления рассмотрена выше. Как уже говорилось, осмотическое давление зависит только от числа частиц в единице объема раствора. Отсюда понятно, почему мелкие молекулы иногда называют «осмотически активными» — в 100 г NаСl, например, содержится на несколько порядков больше частиц, чем в 100 г белка.
Осмотическое давление измеряется, разумеется, в единицах давления, например в атмосферах (атм) или миллиметрах ртутного столба (мм рт. ст.). Подавляющая часть осмотического давления крови создается главным ее электролитом — NaCl. Осмотическое давление крови составляет около 7,2 атм, то есть (поскольку 1 атм = 760 мм рт. ст.) 7,2 х 760 = 5500 мм рт. ст.
Осмолярность
Поскольку осмотическое давление прямо пропорционально количеству частиц в единице раствора, то это количество обычно и используют как более удобный показатель. Оно называется осмолярностью и измеряется в осмолях на литр. 1 осмоль = 1 моль частиц в растворе. Для недиссоциирующих веществ осмолярность равна молярности: 1 моль глюкозы даст в растворе 1 осмоль. Для диссоциирующих веществ картина иная: так, каждая молекула NaCl в растворе даст две частицы, и поэтому 1 моль NaCl даст 1 моль Nа+ и 1 моль Сl-, то есть 2 осмоля. Поскольку один моль любого вещества содержит одинаковое количество молекул, осмолярность отражает количество молекул в 1 л раствора. Осмолярность прямо пропорциональна осмотическому давлению: 1 мосмоль/л создает осмотическое давление, равное 19,3 мм рт. ст. Таким образом:
Росм = Осм х 19,3
Нетрудно подсчитать, что при осмотическом давлении в 5500 мм рт. ст. осмолярность крови будет равна около 285 мосмоль/л.
Осмоляльность
Этот показатель часто используют вместо осмолярности. Он измеряется в осмолях на 1 кг растворителя (а не на 1 л раствора). Осмолярность и осмоляльность крови близки.
Тоничность
В отличие от остальных, это не количественный и не столько физический, сколько биологический показатель. Он характеризует поведение данной клетки в данном растворе. Так, эритроцит сморщивается в растворе NaCl с осмолярностью 400 мосмоль/л, но может не менять свой объем в аналогичном растворе другого вещества (например, мочевины), легко проходящего через его мембрану. Раствор, в котором клетка не меняет свой объем, называют изотоническим; раствор, в котором вода входит в клетку, и та набухает — гипотоническим; раствор, в котором вода выходит из клетки и та сморщивается — гипертоническим. В норме для практических целей можно считать, что любые растворы, изоосмолярные крови (с такой же осмолярностью), являются изотоническими, но бывают и важные исключения (например, раствор мочевины, которая легко проникает через клеточные мембраны и потому не создает эффективного осмотического давления, то есть меняет осмолярность раствора, но не его тоничность).
Главное вещество, создающее осмотическое давление внеклеточной жидкости, — NaCl:
это главный электролит внеклеточной жидкости, то есть его концентрация во внеклеточной жидкости (в том числе — в плазме) высока; это мелкая молекула, вдобавок диссоциирующая на две частицы (Nа+ и Cl-); следовательно, в пересчете на единицу массы NaCl создает высокое осмотическое давление; это вещество не проникает через клеточные мембраны и поэтому создает эффективное осмотическое давление.
Как уже говорилось, от осмотического давления внеклеточной жидкости зависит транспорт воды через клеточные мембраны, то есть объем внутриклеточного пространства:
1. При гиперосмолярности крови вода выходит из клеток, и они сморщиваются — объем внутриклеточного пространства снижается;
2. При гипоосмолярности крови вода входит в клетки, и они набухают — объем внутриклеточного пространства повышается.
6. Водные пространства организма. Локализация осморецепторов, волюморецепторов и барорецепторов, их значение в поддержании осмотического давления. Поддержание объема крови: роль волюморецепторов и барорецепторов. Гормоны, участвующие в регуляции объема крови.
Вода организма образует два водных пространства: внутриклеточное (2/3 общей воды) и внеклеточное (1/3 общей воды). К внеклеточному пространству относится: внутрисосудистая жидкость, интерстициальная (тканевая) жидкость, трансцеллюлярная жидкость (жидкости, заполняющие полости организма и некоторых органов).
Поддержание осмотического давления крови достигается в основном за счет регуляции потребления и выведения воды (а не NaCl или иных осмотически активных веществ).
За поддержание осмотического давления, как и многих других констант внутренней среды отвечает гипоталамус. Гипоталамическая система поддержания осмотического давления устроена следующим образом:
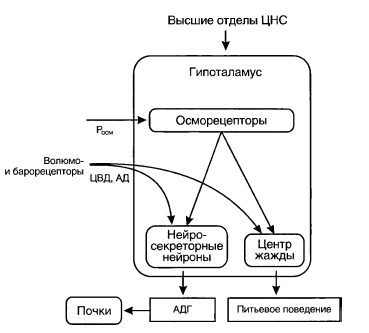
Основные входы этой системы:
1. Центральный вход — пути от вышележащих центров;
2. Сенсорные входы:
а) Осморецепторы, расположенные в самом гипоталамусе; воспринимают (увеличение) осмотическое давление плазмы;
б) Волюморецепторы и барорецепторы. Волюморецепторы, расположенные в предсердиях и полых венах, воспринимают центральное венозное давление и тем самым (косвенно) объем крови; барорецепторы, расположенные в крупных артериях, воспринимают артериальное давление.
Основные выходы:
1. Центр жажды, запускающий питьевое поведение и тем самым регулирующий потребление воды;
2. АДГ— гормон, вырабатываемый нейронами гипоталамуса и хранящийся в их окончаниях в нейрогипофизе. Под действием этого гормона уменьшается выведение воды почками.
Центр жажды и секреция АДГ стимулируются:
1. Активацией осморецепторов;
2. Уменьшением активации волюмо- и барорецепторов.
