
- •СD-антигены
- •Центральные органы иммунной системы
- •Периферические органы иммунной системы
- •В-лимфоциты (бурсозависимые)
- •Антитела, их структура и функции
- •Применение иммунологических методов в практике
- •Серологические реакции и их применение
- •Аллергическая гиперчувствительность
- •Методы диагностики аллергических заболеваний
- •Аутоиммунные заболевания
γδТ-клетки
В период эмбриогенеза развиваются в тимусе, к моменту рождения быстро его покидают и заселяют барьерные ткани: слизистую оболочку кишечника и респираторного тракта, эпидермис кожи. В
периферической крови их относительное содержание мало и составляет около 5%. Они в большинстве своем лишены СD4 и СD8 и распознают антиген без участия молекул МНС. Вариабельность γδТCR ограничена и поэтому спектр антигенов, распознаваемый ими, очень узок.
γδТ-клетки выполняют следующие функции:
ограничивают чрезмерно интенсивный иммунный ответ и аутоагрессию;
мигрируя в лимфоузлы, выполняют роль полноценных АПК;
участвуют в формировании врожденного иммунитета, проявляя цитотоксические свойства в отношении клеток-мишеней.
В-лимфоциты (бурсозависимые)
В-лимфоциты получили свое название при изучении процессов их созревания в сумке (бурсе) Фабрициуса на модели птиц. У
млекопитающих образование и созревание различных групп В-лимфоцитов может проходить на территории костного мозга, в серозных полостях,
сальнике. Для всех зрелых В-лимфоцитов основными мембранными маркерами являются СD19 (СD20) и мембранный иммуноглобулин,
формирующий В-клеточный антигенраспознающий рецептор (BCR).
Для В-лимфоцитов характерна слабая рециркуляция через кровоток и относительно малое содержание в периферической крови (1018%). Основными функциями В-лимфоцитов являются:
1)антителообразующая;
2)антигенпредставляющая.
Внастоящее время выделяют 3 субпопуляции В-лимфоцитов:
1)В1 (полостные);
2)В2 («классические», или «обычные» - основная, доминирующая
субпопуляция);
3)В-лимфоциты маргинальной зоны селезенки (MZB).
В2-лимфоциты имеют костномозговое происхождение,
субпопуляционный маркер СD23. После созревания и выхода в кровоток заселяют лимфоидные фолликулы селезенки, лимфоузлов, лимфоидную ткань кишечника. Подвергаются селекции, назначение которой — элиминация аутоспецифических клонов. Маркеры наивных В2-клеток -
мембранные иммуноглобулины (Ig) классов М в мономерной форме и D;
после активации антигеном вместо IgМ и IgD на мембране могут появляться IgG, IgE и IgA.
В1-лимфоциты называют «полостными», поскольку они еще в период эмбриогенеза отселяются из костного мозга в серозные полости
(брюшную, плевральную), сальник, автономно самоподдерживаются там и после рождения на протяжении всей индивидуальной жизни.
Отличительными особенностями данной субпопуляции являются:
1)наличие в качестве субпопуляционного мембранного маркера молекулы СD5;
2)наличие на поверхности молекул иммуноглобулинов только класса М;
3)отсутствие процессов селекции клонов;
4)возможность дифференцировки в антителообразующие клетки без стимуляции антигеном;
5)участие в продукции естественных (нормальных) антител, для которых свойственны аутореактивность, полиспецифичность, низкая афинность, принадлежность преимущественно к классу М, А, участие в реакциях врожденного иммунитета.
Главный комплекс гистосовместимости
Главный комплекс гистосовместимости — это совокупность генов,
кодирующих уникальный набор белков, свойственный данному организму,
различие по которым обусловливает отторжение трансплантатов.
Первоначально генетический комплекс был описан на модели мышей,
позже - на модели лейкоцитов человека, что позволило дать ему название
HLA (от англ. Human leukocyte antigens). Аналогичные комплексы были также обнаружены у всех изучавшихся млекопитающих и птиц. В связи с этим было введено общее название — МНС (от англ.Major histocompatibility complex).
У человека он расположен в 6-ой хромосоме и включает более 200
генов, сгруппированных в 3 класса (I, II, III). Гены I класса кодируют молекулы гистосовместимости, участвующие в отторжении несовместимых трансплантатов и в презентации антигена СD8 Т-лимфоцитам; гены II класса кодируют молекулы, участвующие в презентации антигена СD4 Т-
лимфоцитам, III класса - компоненты комплемента, цитокины, белки теплового шока.
Молекулы МНС-I представлены на поверхности всех ядросодержащих клеток, за исключением эритроцитов и клеток ворсинчатого трофобласта, а
молекулы МНС-II — на поверхности «профессиональных» АПК, при воспалении также на активированных эпителиальных, эндотелиальных и др.
клетках. Молекулы I и II классов синтезируются на рибосомах в эндоплазматическом ретикулуме клеток организма. Они являются «эталоном своего», от которого Т-лимфоцитам необходимо отличить потенциально опасные объекты — антигены. В своей структуре эти молекулы имеют антигенсвязывающую щель - участок для встраивания эпитопов,
образующихся при деградации антигенов во внутренней среде клетки . После встраивания образующиеся комплексы доставляются на мембрану клетки и представляются Т-лимфоцитам.
Основные формы и стадии адаптивного иммунитета
В зависимости от характера продуктов, появляющихся в результате иммуногенеза, выделяют антителозависимую (гуморальную) и Т-
лимфоцитзависимую (клеточную) формы иммунного ответа. В свою очередь Т-лимфоцитзависимый ответ подразделяется на:
цитотоксический;
воспалительный;
трансплантационный.
Выделяют 2 стадии формирования первичного иммунного ответа на Т-зависимые антигены:
1)индукции;
2)эффекторную (продуктивную), которая начинается в конце первой — начале второй недели от момента контакта с антигеном.
Виндуктивную стадию происходит:
1)доставка антигена из места проникновения в периферические органы иммунной системы;
2)процессинг антигена;
3)презентация антигена;
4)дифференцировка и пролиферация клонов лимфоцитов, имеющих комплементарные антигену распознающие рецепторы;
5)секреция цитокинов;
6)формирование эффекторных клеток и клеток иммунологической памяти.
Вэффекторной фазе происходит:
1)накопление продуктов иммунной реакции, направленных на элиминацию антигена; в зависимости от формы иммунного ответа продуктами могут быть антитела, цитотоксические лимфоциты, а
также макрофаги и NK, активированные цитокинами Т-лимфоцитов;
2)формирование иммунологической памяти – запоминание Т- и В-
лимфоцитами информации о контакте с антигеном - эффективного способа защиты от реинфекции.
Доставка антигена из места проникновения в периферические органы иммунной системы в большинстве случаев осуществляется следующим образом. Дендритные клетки в барьерных тканях поглощают патоген и с током лимфы перемещаются в Т-зоны регионарных лимфоузлов,
превращаясь в интердигитальные клетки. Одновременно с миграцией дендритные клетки осуществляют процессинг и презентацию антигена.
Процессинг антигена – это его деградация внутри антигенпрезентирующих клеток (АПК) с последующим встраиванием эпитопов антигена в молекулы МНС I и/или II класса. Встраивание происходит в области эндоплазматического ретикулума АПК, а
образовавшиеся комплексы с помощью секреторных везикул выносятся на мембрану АПК и встраиваются в нее.
Презентация антигена - представление эпитопов антигена в составе молекул МНС I и II классов Т-лимфоцитам. Т-клеточный рецептор распознает сразу два объекта – эпитоп и молекулы МНС I и/или II класса – феномен «двойного распознавания». Установившийся контакт дестабилизирует мембрану Т-лимфоцита и приводит его в активное состояние, при котором лимфоцит начинает дифференцироваться в определенные субпопуляции, пролиферировать, выделять цитокины.
В целом для полноценной активации Т-лимфоцита необходимо не только «двойное распознавание», но и воздействие на него дополнительных сигналов :
1)костимуляция — дополнительный сигнал, усиливающий активацию лимфоцита; возникает при контактном взаимодействии между двумя комплементарными молекулами: одна костимулирующая молекула из каждой пары располагается на мембране Т-лимфоцита, другая — на АПК (наиболее важная из пар СD28 — СD80/СD86);
2)действие цитокинов. Основным является ИЛ-2, он активно секретируется лимфоцитами - Th1, нулевыми CD4+ и в меньшей степени CD8, является ростовым фактором Т-лимфоцитов,
обеспечивает их пролиферацию в течение 3-5 сут.
Формирование Т-лимфоцитзависимого цитотоксического иммунного
ответа
Данная форма иммунного ответа наиболее эффективна при вирусных инфекциях и опухолевых процессах. Клетками-мишенями,
подлежащими уничтожению, становятся клетки собственного организма,
инфицированные вирусами и несущие на поверхности вирусные антигены, а
также опухолевые клетки, экспрессирующие молекулы — образцы опасности.
Этапы формирования Т-лимфоцитзависимого цитотоксического иммунного ответа :
1)презентация дендритными клетками антигена в составе молекулы MHC I нулевым СD8+- лимфоцитам;
2)пролиферация СD8+Лф при участии ИЛ-2 (основным источником ИЛ-2
являются Тh1);
3)дифференцировка нулевых СD8+Лф в ЦТЛ;
4)контактный цитолиз клеток-мишеней, несущих на поверхности антиген,
цитотоксическими Т-клетками.
Формирование Т-лимфоцитзависимого воспалительного иммунного
ответа
Данная форма иммунного ответа - наиболее эффективный способ защиты при бактериальных инфекциях, вызванных патогенами с внутриклеточной локализацией, когда имеет место незавершенный характер фагоцитоза.
Этапы формирования Т-лимфоцитзависимого воспалительного
иммунного ответа :
1)презентация дендритными клетками антигена в составе молекулы МНС-
II нулевым СD4+лимфоцитам;
2)дифференцировка нулевых СD4+лимфоцитов в Th1 при участии ИЛ-12
и ИФН-γ;
3)презентация антигена макрофагами Т-хелперам 1;
4)активация макрофагов под действием цитокинов, выделяемых Th1 (ИФН-γ, ФНО и др.) и контактного взаимодействия этих клеток между собой;
5)усиление внутриклеточного киллинга антигена в фагосомах макрофагов и переход фагоцитоза из незавершенного в завершенный,
заканчивающийся гибелью патогена («форсированный» фагоцитоз).
Формирование гуморального (антителозависимого)
иммунного ответа
Антителозависимый иммунный ответ наиболее эффективен в отношении внеклеточных бактерий. Территориально развивается в межфолликулярном пространстве вторичных лимфоидных органов, где создаются оптимальные условия для взаимодействия трех основных участников — антигена, В-клетки и Th2. Обычно антиген доставляется сюда из очага, в частности, из барьерных тканей, с током афферентной лимфы или через кровоток, причем не только в составе молекул MHC на поверхности дендритных клеток, но и в свободной форме.
Этапы формирования гуморального (антителозависимого)
иммунного ответа :
1)распознавание нативного антигена В-клетками;
2)процессинг и презентация антигена В-клетками Т-хелперам 2;
3)активация Тh2, секреция ими цитокинов (ИЛ-4, 5 и др.) и обратная презентация антигена В-лимфоцитам;
4)активация и пролиферация В-клеток в результате контактного взаимодействия с Тh2 и действия ИЛ-4, 5;
5)дифференцировка В-клеток в плазмобласты (далее в плазматические клетки) и В-клетки памяти;
6)секреция специфических к антигену антител плазматическими клетками.
Зрелые плазматические клетки утрачивают подвижность и способность реагировать почти на все внешние стимулы.
Продолжительность их жизни в лимфоузлах и селезенке составляет 4-7 нед.,
в костном мозге – десятки лет, что сопоставимо со сроком жизни индивидуума.
При любой из форм иммунного ответа активируются и начинают пролиферировать только те группы Т- и В-клеток, у которых имеются комплементарные конкретному антигену рецепторы; этим достигается высокая специфичность иммунной реакции и ее конечных продуктов.

Молекулы главного комплекса гистосовместимости
Главный комплекс гистосовместимости — это совокупность генов, кодирующих уникальный набор белков, свойственный данному организму, различие по которым обусловливает отторжение трансплантатов.
Первоначально подобный генетический комплекс был описан на модели мышей, позже - на модели лейкоцитов человека, что позволило дать ему название HLA (от англ. Humanleukocyteantigens). Аналогичные комплексы были также обнаружены у всех изучавшихся млекопитающих и птиц. В связи с этим было введено общее название — МНС (от англ.Majorhistocompatibilitycomplex)
В целом у человека он характеризуется:
1.расположением в 6-ой хромосоме,
2.наличием более 200 генов, сгруппированных в 3 класса (I, II, III),
3.высоким полиморфизмом классических генов,
4.кодированием молекул гистосовместимости, участвующих в отторжении несовместимых трансплантатов и презентации антигена Т-лимфоцитам,
5.кодированием некоторых компонентов комплемента, цитокинов, белков теплового шока.
Таблица
Молекулы, кодируемые генами МНС
|
Класс генов |
|
Кодируемые продукты |
||
|
МНС |
|
|||
|
|
|
|
||
|
|
|
|
|
|
|
I |
|
трансмембранные молекулы, участвующие в презентации |
||
|
|
антигенных детерминант СD8 Т-лимфоцитам |
|||
|
|
|
|
||
|
|
|
|
|
|
|
II |
|
|
трансмембранные молекулы, участвующие в презентации |
|
|
|
|
антигенных детерминант СD4 Т-лимфоцитам |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
III |
|
компоненты комплемента, цитокины |
||
|
|
|
|
|
|
Молекулы, являющиеся продуктами генов МНС I и II классов, участвуют в презентации антигена Т-лимфоцитам, являясь «эталоном» своего, от которого Т-клеткам необходимо отличить антиген.
Молекулы МНС-I представлены на поверхности всех ядросодержащих клеток, за исключением эритроцитов и клеток ворсинчатого трофобласта, а молекулы МНС-II — на поверхности преимущественно «профессиональных» АПК, при воспалении — также на активированных эпителиальных, эндотелиальных и др.клетках.
Молекулы МНС в своей структуре имеют участок для встраивания эпитопов — антигенсвязывающую щель — которому присущ высокий уровень вариабельности.
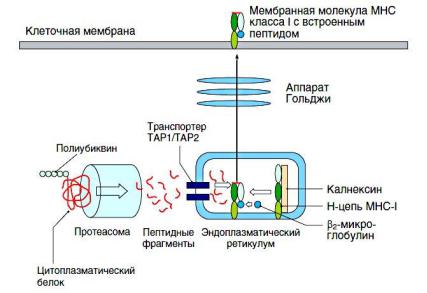
Для молекул МНС I и II классов принципиально различны как источник пептидов, так и механизм встраивания. Так, в молекулы МНС I встраиваются пептиды, образующиеся в цитоплазме клетки в процессе естественной деградации внутриклеточных белков в специальных структурах — протеосомах. Затем фрагменты белков транспортируются из цитоплазмы в эндоплазматический ретикулум, в котором на рибосомах синтезируются молекулы МНС I. Именно
здесь происходит встраивание пептида и перемещение уже в составе молекулы МНС I в аппарат Гольджи, а далее при помощи секреторных везикул — на поверхность клетки.
Рис. Процессинг молекул главного комплекса гистосовместимости класса I и цитоплазматических пептидов (12)
Пептиды, презентируемые в составе МНС II, имеют внеклеточное происхождение. АПК поглощают экзогенные антигены в процессе фагоцитоза. Формирующиеся эндосомы, в которых происходит расщепление антигена до пептидов, погружаются внутрь клетки и сливаются с секреторными везикулами, содержащими молекулы МНС II. После встраивания пептида в молекулу МНС II комплекс перемещается на поверхность клетки.
Однако существует феномен перекрестной презентации, объясняющий возможность встраивания внеклеточных белков и в молекулу МНС I (за счет их проникновения из эндосомы в цитозоль или непосредственно в эндоплазматический ретикулум).
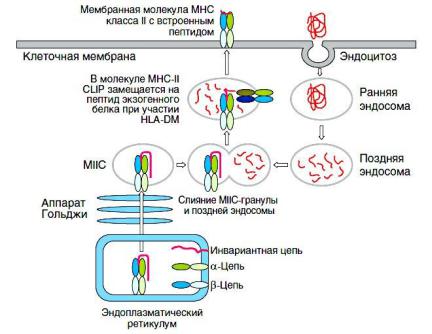
Рис. Процессинг молекул главного комплекса гистосовместимости класса II и внеклеточных пептидов (12)
Роль МНС сводится к кодированию и обеспечению следующих процессов:
регуляции иммунного ответа,
способности распознавать «своё» и «чужое»,
способности отторгать чужеродные ткани,
способности синтезировать ряд молекул иммунной системы (комплемента, цитокинов),
предрасположенности человека к ряду болезней (диабет, злокачественные опухоли,
артриты, амилоидоз, болезни сердечно-сосудистой системы, почек и др.).
Гены, контролирующие иммунный ответ, первоначально были названы Ir-генами (Immune response genes). В настоящее время известно, что основным локусом (но не единственным) является МНС II класса. Генетический контроль иммунного ответа в узком смысле подразумевает возможность варьирования его выраженности в зависимости как от генетических особенностей индивидуума, так и от характера антигена. Его действие реализуется практически всегда через влияние на презентацию антигена, поскольку эффективность такой презентации зависит от степени соответствия эпитопа и строения антигенсвязывающей щели молекул — продуктов МНС. Генетический контроль ограничивается не только контролем его уровня, но и определяет качество, в частности, преобладание Th1или Th2-зависимых процессов
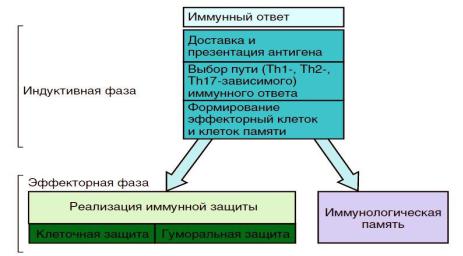
Механизмы формирования адаптивного иммунного ответа
Иммунным ответом называют комплекс реакций организма, индуцированных антигеном, направленных на его распознавание, элиминацию и запоминание информации о контакте с ним.
Основными формами адаптивного иммунитета являются:
1.антителозависимый иммунный ответ (гуморальный);
2.Т-лимфоцитзависимый имунный ответ (клеточный):
цитотоксический,
воспалительный,
трансплантационный.
Внастоящее время выделяют 2 стадии формирования иммунного ответа*(Рис.28):
индукции,
эффекторную (продуктивную).
Примечание*: далее рассматриваются механизмы формирования первичного иммунного ответа на тимусзависимые антигены.
В индуктивную стадию формирования адаптивного иммунитета происходит:
1.доставка антигена из места проникновения в периферические органы иммунной системы,
2.процессинг антигена,
3.презентация антигена,
4.дифференцировка и пролиферация клонов лимфоцитов, имеющих комплементарные антигену распознающие рецепторы,
5.секреция цитокинов,
6.формирование эффекторных клеток и клеток иммунологической памяти
Рис.28 Фазы адаптивного иммунного ответа (12)
Переход к эффекторной фазе происходит постепенно и соответствует концу первой — началу второй недели со времени контакта с антигеном. Собственные эффекторные механизмы адаптивного иммунитета немногочисленны, в связи с чем активно используются реакции врожденного иммунитета, эффективность которых многократно усиливается факторами адаптивного.
В эффекторную стадию иммунного ответа происходит накопление продуктов иммунной реакции, направленных на элиминацию антигена и формирование иммунологическогй памяти -
приобретение действенного способа защиты от реинфекции. |
|
В зависимости от формы иммунного ответа продуктами могут быть |
антитела, |
цитотоксические лимфоциты, а также макрофаги и NK, активированные цитокинами Т- лимфоцитов.
В большинстве случаев миграция клеток, участвующих в презентации антигена, включает взаимодействие и поглощение объекта дендритными клетками в барьерных тканях путем эндоцитоза, перемещение ДК в тканевую жидкость и затем в лимфу, где они приобретают характерную форму вуалевых клеток; далее с током лимфы они попадают в Т-зоны регионарных лимфоузлов, превращаясь в интердигитальные клетки. Одновременно с миграцией дендритные клетки осуществляют процессинг и презентацию антигена.
Процессинг антигена представляет собой его обработку внутри АПК со встраиванием в молекулы МНС I и/или II класса.
Презентация антигена — представление эпитопов в составе молекул МНС I и II классов Т- хелперам.
Антигенпредставляющие клетки, их роль в развитии иммунного ответа
В Т-зонах лимфоузлов антиген Т-клеткам представляют специализированные антигенпрезентирующие клетки (АПК) при прямом контактном взаимодействии.
Презентация сопровождается передачей Т-лимфоцитам дополнительных, усиливающих сигналов – костимуляцией, обеспечивающих активацию клеток, распознающих антиген
(активация - это процесс перехода клетки из покоящегося состояния в функционально активное со вступлением в клеточный цикл и размножением).
АПК — гетерогенная группа клеток; в качестве АПК может выступать любая клетка, имеющая на своей поверхности молекулы МНС обоих классов (I и II), а также костимулирующие молекулы. Таким набором обладают «профессионаьные» АПК: дендритные клетки, макрофаги, В-
лимфоциты; при воспалении презентирующую активность могут проявлять и другие клетки, например, эндотелиальные, эпителиальные. Однако при первичном иммунном ответе, требующем привлечения наивных Т-лимфоцитов, роль АПК эффективно выполняют только дендритные клетки, обладающие наиболее выраженным презентационным потенциалом. Следует отметить, что экспрессия ко-стимулирующих молекул происходит после распознавания РАМР при одновременном действии ряда цитокинов (ИЛ-2, ИЛ-12 и др.)
Таблица 9
Особенности процессинга и презентации антигенов для основных субпопуляций Т-лимфоцитов
Процессинг |
|
антигена в АПК для |
Механизм |
представления |
|
|
|
|
поглощение экзогенных молекул путем эндоцитоза, |
|
расщепление белков в эндосомах, слияние эндосом с |
1. СD4-лимфоцитам |
везикулами, содержащими молекулы МНС-II и |
|
встраивание в них образовавшихся пептидов, |
|
перемещение комплекса на поверхность АПК |
|
|
|
естественная деградация внутриклеточных |
|
цитоплазматических белков в протеосомах, транспорт |
2. СD8-лимфоцитам |
образовавшихся пептидов в эндоплазматический |
|
ретикулум, встраивание в молекулу МНС-I и |
|
перемещение комплекса на поверхность АПК |
|
|

Рис.30 Основные разновидности «профессиональных» антигенпредставляющих клеток (12)
Для активации Т-лимфоцитов и включения их в иммунный ответ необходимо воздействие на них 3 основных сигналов:
контактного взаимодействия Т-клеточного рецептора с эпитопом, встроенным в молекулу МНС на мембране АПК (феномен «двойного распознавания),
контактного взаимодействия между комплементарными костимулирующими молекулами мембран Т-лимфоцитов и АПК (известно несколько пар костимулирующих молекул, одна молекула из каждой пары располагается на мембране Т-лимфоцита, другая — на АПК; наиболее важная из пар: СD28 — СD80/СD86, также СD40 — СD154 — особенностью этой пары является направленность сигнала преимущественно в сторону АПК, а не Т-лимфоцита),
действие цитокинов, основным среди которых является ИЛ-2, активно секретируемый Th1, а также CD40 и в меньшей стпепни CD8 лимфоцитами.
Пролиферировать начинает лишь та группа Т-клеток, у которых имеются соответствующие антигену TCR, в результате чего формируется узкоспецифичный клон лимфоцитов.
ИЛ-2, синтезируемый и секретируемый активированными СD4+Т-лимфоцитами, служит основным ростовым фактором этих клеток, регулируя процесс по аутокринному типу и обеспечивая пролиферацию в течение 3-5 сут.
Рис.31 Схема презентации антигена с участием молекул МНС, TCR, корецепторов (СD4, СD8) и костимулирующих молекул (12)
ИЛ-2 имеет два основных физиологических эффекта — индуцирует антигензависимую пролиферацию всех разновидностей Т-клеток и способствует дифференцировке некоторых функциональных субпопуляций — цитотоксических лимфоцитов, регуляторных Т-клеток.
На этом этапе СD4+ лимфоциты хелперной субпопуляции обозначаются как Th0-клетки. Происходит секреция и других важных цитокинов (ИЛ 3, 4, 5, 6, 9, 10, 13, ИФ-γ, ФНО-α и др.).
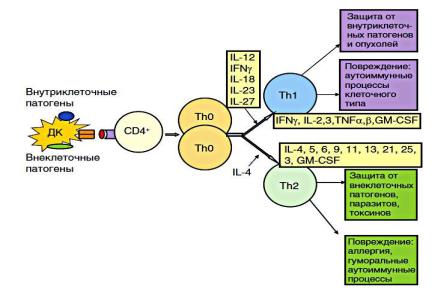
Далее запускается процесс дифференцировки (дихотомии) Th0 на адаптивные субпопуляции,
наиболее ранними из которых являются Th1 и Th2, различающиеся по спектру синтезируемых ими цитокинов и соответственно направлением запускаемого иммунного ответа.
Направление дихотомии в сторону той или иной субпопуляции зависит от ряда факторов, 2 из которых являются наиболее важными:
1.основной - характер антигена или РАМР, с которыми они связаны (сигналы от РАМР могут воспринимать рецепторы антигенпредставляющих клеток, участвующих в процессе, и передавать лимфоцитам), существуют перечни патогенов, являющихся избирательными индукторами Th1 и Th2;
2.спектр действующих цитокинов (основным индуктором Th1 служит ИЛ-12, в меньшей
степени — ИФ-γ и др.; для Th2 — только ИЛ-4).
Также существует ряд дополнительных факторов, например, путь поступления антигена в организм.
Рис.32 Дифференцировка Т-хелперов типов Th1 и Th2 и процессы, регулируемые ими
(12)
Несколько позже из активированных СD4+Т-лимфоцитов под влиянием ИЛ-6 и др. возникает еще одна адаптивная субпопуляция — Th17, независимо от Th1 и 2, хотя цитокины, секретируемые последними, подавляют развитие Th17.
Антитела, их стуктура и функции
Антителами (иммуноглобулинами) называют растворимые белки (гликопротеины), присутствующие в сыворотке крови и др. биологических жидкостях, синтезирующиеся в подавляющем большинстве случаев в ответ на контакт антигенов с клетками иммунной системы и предназначенные для их специфического связывания.
В организме молекулы антител, помимо растворимой, могут находиться и в других формах:
в составе иммунных комплексов (антиген-антитело),
в структуре BCR,
фиксированными на мембранах клеток, имеющих Fc-рецепторы (макрофагах, нейтрофилах и др.).
Существует 5 классов иммуноглобулинов: IgG, IgM, IgA (сыворотный и секреторный), IgD, IgE. Полипептидные цепи Ig существуют не в виде линейных последовательностей аминокислот, а
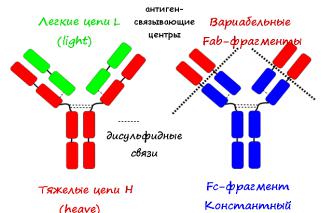
имея вторичную и третичную структуру, закручены в виде глобул, называемых доменами. Принципиально структура любого мономера Ig (рис.36) представлена двумя парами
полипептидных цепей — L (легких, от англ. light) и H (тяжелых, от англ. heave), связанных дисульфидными связями и распадающимися при обработке папаином на 3 фрагмента:
два вариабельных (Fab), каждый их которых представлен одним вариабельным доменом и имеет активный центр (паратоп), предназначенный для связывания с эпитопами антигена,
один константный (Fc) - представлен тремя константными доменами, ответственен за взаимодействие с компонентами комплемена и прикрепление к соответствующим
рецепторам на мембранах клеток.
Антитела, имеющие только один активный центр, называются неполными.
Рис.36 Строение молекулы иммуноглобулина
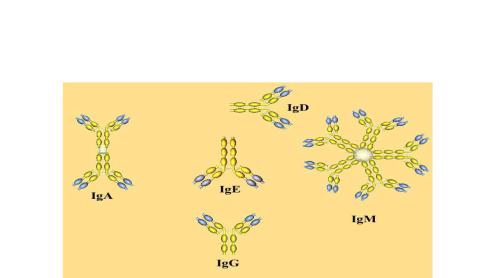
Таблица 10
|
|
|
|
Характеристика классов иммуноглобулинов |
||||
|
Класс |
|
Форма |
|
Относительное содержание (%) в |
|||
|
|
|
сыворотке крови, роль |
|||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
10%, синтезируются первыми в ответ |
|
|
IgM |
|
пентамер |
|
на контакт клеток иммунной системы с |
|||
|
|
|
антигеном; высоко-авидны и |
|||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
малоафинны (мало-специфичны) |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
75%, появляются позднее IgM при |
|
|
IgG |
|
|
|
|
первичном иммунном ответе (с конца 2- |
||
|
|
|
|
|
ой недели), при вторичном — на 3-4-й |
|||
|
(имеет 4 |
|
мономер |
|
||||
|
|
|
день, обычно минуя фазу образования |
|||||
|
подкласса) |
|
|
|
|
|||
|
|
|
|
|
IgM; высокоафинны (высокоспе- |
|||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
цифичны); проходят через плаценту |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Сывороточный — |
|
|
|
|
|
IgA |
|
мономер или димер; |
|
15%, высокоспецифичны, участвуют в |
|||
|
(имеют 2 |
|
секреторный — димер, |
|
||||
|
|
|
защите слизистых оболочек |
|||||
|
подкласса) |
|
соединенный секре- |
|
||||
|
|
|
|
|
||||
|
|
|
|
торным компонентом |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
IgE |
|
мономер |
|
Менее 0,01%, участвуют в развитии |
|||
|
|
|
аллергии |
|||||
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Менее 0,1%, роль изучена не |
|
|
IgD |
|
|
мономер |
|
|
достаточно; в мембраносвязанной |
|
|
|
|
|
|
форме присутствует на поверхности В2 |
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
наивных лимфоцитов в качестве BCR |
|
|
|
|
|
|
|
|
|
|
Рис.37 Строение иммуноглобулинов различных классов
Существуют следующие типы специфичности антител (АТ):
-изотипы - классы иммуноглобулинов - определяются типом тяжелой цепи (соответственно μ — для IgM, γ – IgG, α – IgA, δ – IgD, ε - IgE), одинаковы у всех особей данного вида (характеристика особенностей строения и роли каждого из классов представлены в табл.10, рис 37);
-аллотипы — варианты иммуноглобулинов в пределах одного изотипа, индивидуальные для каждой особи;
-идиотипы — Ig, различающиеся по специфичности к антигенам.
Впределах молекулы антитела возможно наличие идиотипа как индивидуального (частного), являющимися уникальным по спцифичности к конкретному эпитопу, так и общего (перекрестнореагирующего), характерного для антител к различным распространенным антигенам.
Идентичные антитела (одинаковой специфичности и изотипа), являющиеся продуктами одной плазматической клетки-предшественницы, полученные в лабораторных условиях методом «гибридом» и выделяемые из крови животных, называются моноклональными.
Взаимодействие антител с антигенами обратимо, причем прочность взаимодействия
напрямую зависит от степени комплементарности активного центра антитела и антигенной детерминанты, т. е. от уровня специфичности АТ, что выражается термином «афинность».
Существует и другое понятие, характеризующее процесс взаимодействия антител с антиггенами, - «авидность», или жадность, — термин, показывающий, какое количество антигенов одновременно способна связать молекула антитела.
Наиболее авидными (за счет наличия 10 активных центров в пентамере), но при этом малоафинными являются IgM; в то время, как IgG, обладая более низкой авидностью, являются высокоафинными и тем самым наиболее эффективно блокирующими антигены. Появление на первом этапе инфекционного процесса (при первичном иммунном ответе) именно IgM обусловлено их способностью связывать большое количество антигенов, что позволяет в начале эффективно сдерживать развитие заболевания.
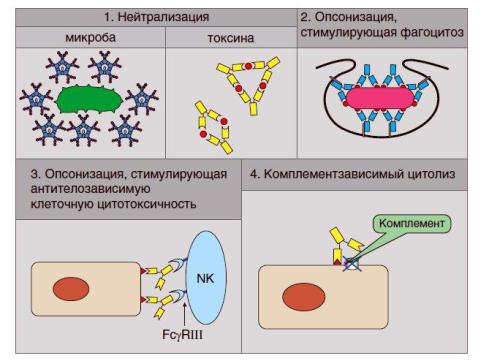
Защитная (эффекторная) роль антител выражается (рис.38) в:
прямом действии на молекулы или организмы — носители антигенов,
косвенном действии путем привлечения дополнительных механизмов (гуморальных — при активации системы комплемента — и клеточных - фагоцитоза, цитотксичности).
Прямое защитное действие антител реализуется за счет:
нейтрализации токсинов бактерий и других высокомолекулярных веществ биологического происхождения,
поверхностной блокады мембранных структур патогенов с угнетением их подвижности и
адгезии на клетках-мишенях, способности преодолевать тканевые барьеры.
Косвенное защитное действие антител, опосредованное привлечением эффекторных клеток, может реализоваться путем:
активации системы комплемента по классическому пути,
опсонизации антигена с облегчением его фагоцитоза и переваривания,
антителозависимой цитотоксичности, которая выражается в опсонизации клеток-мишеней с облегчением их узнавания нормальными киллерами и усилением цитолиза таких клеток киллерами.
Рис.38 Основные механизмы действия антител (12)
