
Органические производные металлов второй группы
Первым элементом во второй группе Таблицы Менделеева является бериллий. Его органические производные резко отличаются по свойствам от металлорганических соединений магния и щёлочноземельных металлов. Органические производные бериллия летучи, растворимы в неполярных органических растворителях. Чаще всего они представляют собой жидкости; только диметилбериллий образует кристаллы, которые, не переходя в жидкое состояние, возгоняются при температуре около 200 °С. Все соединения бериллия высокотоксичны. В соответствии с этим органические производные бериллия в органическом синтезе не используются
Магнийорганические соединения имеют солевой характер – это твёрдые неплавкие вещества. Органические соединения кальция, стронция и бария не имеют каких-либо преимуществ в сравнении с литий- и магнийорганическими соединениями и поэтому они не стали объектом детального изучения. В диалкильных производных элементов второй подгруппы – цинка, кадмия и ртути – связь металла с углеродом носит ковалентный характер. В соответствии с этим они представляют собой жидкости с невысокими температурами кипения. Так, например, диметилцинк кипит при температуре 46 °С, а диметилртуть имеет температуру кипения 92 °С.
В соответствии с электроотрицательностью металла низшие алкильные производные бериллия, магния и цинка реагируют с кислородом воздуха так активно, что происходит их самовозгорание; бурно протекает и их взаимодействие с водой. Окисление диметилкадмия идёт более гладко, а диметилртуть не реагирует с кислородом воздуха и не разлагается водой при комнатной температуре.
Магнийорганические соединения
Самыми широко используемыми в препаративной органической химии металлорганическими соединениями являются алкил- и арилгалогениды магния (реактивы Гриньяра). Реактивы Гриньяра генерируют карбанионы в реакциях нуклеофильного присоединения и в реакциях замещения, кроме того они участвуют в ряде других превращений. Эти металлорганические соединения были впервые получены в Лионском университете, где был разработан способ получения вторичных и третичных спиртов в трёхкомпонентной реакции органических галогенидов с карбонильными соединениями в присутствии таких металлов, как цинк, олово, магний и др., протекающей по схеме (М – металл, Х - галоген):

Исследования этой реакции проводились под руководством Ф.Барбье (Ph.Barbier, 1899). К этому времени уже были получены органические производные цинка, ртути, олова и алюминия в различных условиях взаимодействия металлов с алкилгалогенидами, и можно было предположить, что промежуточными продуктами в реакции, которой позже было присвоено имя реакции Барбье, являются металлорганические соединения, образующиеся из органического галогенида и металла. Хорошие выходы в реакции Барбье получаются при использовании более активного, чем цинк или олово, металлического магния. В соответствии с этим В.Гриньяр, работавший под руководством Ф.Барбье, стал исследовать условия протекания реакции между металлическим магнием и органическими галогенидами. Результатом проведенных им исследований стало получение магнийорганических соединений, нашедших широчайшее применение в области синтетической органической химии. Уже через десять лет после публикации работ по синтезу этих реагентов В.Гриньяру была присуждена Нобелевская премия в области химии (совместно с П.Сабатье, исследовавшим каталитическое гидрирование олефинов).
Реактивы Гриньяра легко получаются из соответствующих галогенидов и металлического магния при отсутствии в среде для проведения реакции следов воды и других протонодонорных веществ. Важно, что реактивы Гриньяра удобны в обращении. Для их получения можно использовать практически любые алифатические и ароматические галогениды, за исключением, конечно, фторидов. Реакция протекает в соответствии с общей схемой:

В дополнение к этому были разработаны другие способы получения магнийорганических соединений, в частности, это реакции переметаллирования при взаимодействии других металлорганических соединений с безводными солями магния. Так, например, реактивы Гриньяра можно получать переметаллированием литийорганических соединений безводным хлоридом или бромидом магния:

Определённое значение имеет обмен ртути в ртутьорганических соединениях на магний. Ещё один способ получения магнийорганических соединений представлен замещением подвижных атомов водорода, например, в молекулах ацетиленов, в реакции с реактивом Гриньяра:
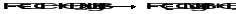
Образующиеся в этой реакции магнийорганические производные ацетиленов называют реактивами Иоцича.
При прямом металлировании относительная реакционная способность органических галогенидов в реакциях с магнием повышается от фторидов к иодидам, при этом фториды настолько инертны, что их можно переводить в реактивы Гриньяра только в особых условиях.
RI > RBr > RCl > > RF
Алкилгалогениды реагируют с магнием легче, чем арилгалогениды. В общем случае влияние природы органического остатка на скорость образования реактива Гриньяра снижается в ряду:
аллил ~ бензил > первичный алкил > вторичный алкил > циклоалкил > > третичный алкил ~ ароматический остаток > алкенил/винил
Прочность связи атома галогена с атомом углерода зависит как от природы галогена, так и от строения органического остатка:
С-I < C-Br < C-Cl
C(sp3)-X < C(sp2)-X
В соответствии с этим образование реактива Гриньяра легче всего протекает с иодидами и с атомами галогенов, связанными с sp3‑гибридизованными атомами углерода.
Правда, при взаимодействии магния с органическим галогенидом ослабление связи атомов галогена с атомами углерода приводит к увеличению доли побочных реакций, основной из которых является реакция гомосочетания по типу реакции Вюрца. Вследствие этого выход магнийорганических соединений в реакциях реакционноспособных галогенидов с металлическим магнием часто оказывается низким.
Хотя первые магнийорганические соединения были получены уже более 120 лет назад, остаётся ещё много вопросов о механизме их образования. Реакция протекает гетерофазно на поверхности магния, при этом важную роль играют отсутствие влаги в растворителе и в реагентах, отсутствие кислорода и другие факторы. Реакция начинается не сразу, ей предшествует более или менее продолжительный индукционный период, при этом сама реакция протекает экзотермически.
Химия магнийорганических соединений основана на полярности связи атомов углерода и атомов металлов с отрицательным зарядом на атоме углерода. Про такие соединения часто говорят, что они представляют собой карбанионы с высокой основностью и нуклеофильностью атома углерода.
Увеличение разницы в значениях электроотрицательности (полярности) приводит к увеличению реакционной способности. Связь магния с углеродом менее поляризована чем связь лития с углеродом, что в общем случае обеспечивает реактивам Гриньяра меньшую реакционную способность и более высокую избирательность. Литийорганические и магнийорганические соединения более реакционноспособны по отношению к электрофилам, чем соответствующие органические производные цинка, бора и олова.
В реакцию прямого металлирования органических галогенидов магний вводят в виде стружек, но в отдельных случаях используют порошкообразный магний с определённым размером частиц. Обычно этот реагент не нуждается в дополнительной обработке. Присутствующие в магнии в виде примесей другие металлы в реакцию образования металлорганических соединений не вступают и остаются в реакционной массе в виде тонкого осадка тёмного цвета. Магний и органический галогенид вводят в реакцию в эквивалентных количествах, но можно брать и небольшой избыток магния.
Органический галогенид чаще всего представлен бромидом, скорость его реакции с магнием выше, чем с соответствующим хлоридом, хотя выход реактивов Гриньяра на основе органических хлоридов обычно превышает выход магнийорганических соединений в реакциях магния с соответствующими бромидами. Легче всего идёт реакция с иодидами, но их редко используют из-за более высокой стоимости и увеличения доли побочных реакций, в частности, реакции Вюрца–Фиттига.
Используемые в качестве исходных соединений галогениды должны быть очищены от спиртов, кислот и воды. Эти примеси не только снижают выход магнийорганического соединения, но и ингибируют реакцию на начальной стадии. Галогениды сушат хлоридом кальция и перегоняют непосредственно перед проведением реакции с магнием (хлорид кальция надо перед перегонкой отделить фильтрованием или декантацией).
Накопленный опыт по проведению реакции Гриньяра показал, что растворитель играет важную роль при получении магнийорганических соединений. Более всего для этого подходит диэтиловый эфир, но можно использовать также дипропиловый, дибутиловый и диизопентиловый эфиры, а также тетрагидрофуран и диоксан. В качестве растворителя могут быть использованы ацетали формальдегида, например, диизопропоксиметан и диизобутоксиметан:
-

и

Используемый для проведения реакции эфир должен быть абсолютным, т.е. он должен быть очищен от влаги и спирта. Для этого эфир в течение достаточно длительного времени выдерживают над металлическим натрием. Количество растворителя должно соответствовать образованию раствора реактива Гриньяра с концентрацией от 1 до 2 молей в литре.
Простые эфиры выполняют функцию растворителя для образующегося магнийорганического соединения, которое чаще всего нерастворимо в других инертных органических растворителях. Переходом магнийорганического соединения в раствор поддерживается свободная поверхность металлического магния. Магнийорганическое соединение растворяется в эфире в виде аддукта, экзотермический эффект образования которого поддерживает реакционную массу в состоянии кипения. Эфираты продуктов реакции магния с органическими галогенидами могут быть выделены в виде бесцветных кристаллических веществ состава, например, R2Mg∙MgX2∙4(C2H5)2O. Состав органических соединений магния в эфирном растворе представляется динамическим равновесием Шленка:

При этом соотношение между алкилмагнийгалогенидом и диалкилмагнием может меняться в зависимости от растворителя. Так, например, в диоксане повышено содержание диалкилмагния из-за того, что хлорид магния образует с диоксаном нерастворимое комплексное соединение, выводящее неорганический хлорид из равновесия. В диэтиловом эфире реактивы Гриньяра с ионами брома и иода находятся в виде мономеров, а в виде димеров они находятся в тех случаях, когда атом галогена представлен хлором или фтором. В тетрагидрофуране все реактивы Гриньяра находятся преимущественно в мономерном состоянии. Однако особенности межмолекулярных взаимодействий у магнийорганических соединений практически не сказываются на их реакционной способности.
Реактивы Гриньяра растворимы во многих апротонных растворителях с атомами кислорода или азота, образующими донорно-акцепторные связи с атомами магния. В сравнении с литийорганическими соединениями реактивы Гриньяра менее оснóвны, а их растворы в эфире достаточно стабильны при комнатной температуре или даже при повышенных температурах.
Свободные от галогенов магнийорганические соединения можно получать осаждением галогенида магния из эфирного раствора реактива Гриньяра диоксаном. При этом осаждается и часть алкилмагнийгалогенида, в результате чего в растворе останется, например, всего лишь 6 % диэтилмагния из реактива Гриньяра, полученного из этилиодида и магния, а при осаждении хлорида магния из эфирного раствора бутилмагнийхлорида в растворе остаётся 84 % дибутилмагния. Выход свободных от галогенов магнийорганических соединений при таком способе их выделения можно повысить путём очень медленного прибавления диоксана к эфирному раствору реактива Гриньяра, например, в течение трёх дней.
Ещё один способ получения свободных от галогенидов диалкильных или диарильных магнийорганических соединений представлен реакцией металлического магния с соответствующими ртутьорганическими соединениями:
![]()
Диалкильные и диарильные магнийорганические соединения представляют собой бесцветные неплавкие кристаллические вещества, нерастворимые в углеводородах. В то же время они растворимы в эфире и во всех растворителях, с которыми они могут образовывать координационные комплексы, например, в диоксане и в пиридине. Эфират дифенилмагния растворим также в бензоле.
Несмотря на их высокую реакционную способность, алкильные производные магния достаточно термостабильны, например, диэтилмагний начинает разлагаться только при температуре более 175 °С, превращаясь при этом в гидрид магния и этилен. Ещё одним продуктом пиролиза диэтилмагния становится полимерный этиленмагний –(СН2СН2Мg)n– и этан.
Реакция магния с органическими галогенидами может ускоряться не только простыми эфирами, но и другими веществами, которые образуют аналогичные аддукты с реактивами Гриньяра. В качестве примера можно привести тиоэфиры, и такие третичные амины, как диметиланилин, пиридин и хинолин.
Средой для получения реактивов Гриньяра могут служить углеводороды (например, бензол, толуол и петролейный эфир), но эти вещества не сольватируют магнийорганические соединения и поэтому не растворяют их. Очень хорошие результаты получены при проведении реакции Гриньяра в додекане, изооктане или тетралине, при этом оптимальная скорость взаимодействия магния с алкилгалогенидами достигается при температуре от 80 до 100 °С, а реакция с арилгалогенидами в углеводородах идёт при температуре от 160 до 170 °С. Хорошие выходы реактивов Гриньяра получены также при проведении реакции магния с органическими галогенидами в таких углеводородах, как бензол, толуол или ксилол, к которым добавлен тетрагидрофуран или триэтиламин в количестве 1 моль на г-атом магния.
Реактивы Гриньяра получают в трёхгорлой колбе, снабжённой мешалкой, обратным холодильником и капельной воронкой. Мешалка сокращает индукционный период реакции в результате нарушения целостности оксидной плёнки на поверхности магния от трения частиц. Магнийорганические соединения реагируют с влагой воздуха, кислородом и диоксидом углерода, но обычно для защиты реакционной массы от этих составляющих атмосферного воздуха достаточно хлоркальциевой трубки на обратном холодильнике, так как пары кипящего эфира перекрывают доступ воздуха к поверхности реакционной массы. В колбу загружают весь магний, приливают немного абсолютного эфира, включают перемешивание и прибавляют из капельной воронки небольшую часть раствора галогенида в абсолютном эфире. В отдельных случаях взаимодействие магния с органическим галогенидом ускоряют прибавлением кристаллика иода. Начало реакции отмечается кипением эфира и помутнением реакционной массы. Если взаимодействие протекает слишком бурно, колбу погружают в воду со льдом. Далее течение реакции регулируют скоростью прибавления раствора галогенида. После окончания прибавления галогенида реакционную массу поддерживают в кипящем состоянии около часа для завершения реакции. Раствор реактива Гриньяра обычно используют сразу после его получения, хотя при исключении контакта с воздухом его можно хранить в течение нескольких дней. При этом не следует хранить растворы магнийорганичесих соединений в холодильнике, поскольку охлаждение приводит обычно к образованию осадков, которые не переходят снова в раствор при повышении температуры.
Взаимодействие магния с арилхлоридами даже в абсолютном тетрагидрофуране идёт слишком медленно. Определённые сложности представляет получение реактивов Гриньяра из третичных алкилгалогенидов. Если реакция в диэтиловом эфире идёт медленно, то в качестве растворителя можно взять эфир с более высокой температурой кипения или диметиланилин. Хорошими растворителями для проведения реакции магния с органическими галогенидами являются также тетрагидрофуран и диметиловый эфир этиленгликоля СН3ОСН2СН2ОСН3 (моноглим). В частности, для получения реактивов Гриньяра из винилгалогенидов в качестве растворителя используют абсолютный тетрагидрофуран.
Ещё один способ получения реактивов Гриньяра из органических галогенидов с невысокой реакционной способностью представлен параллельным протеканием реакции с участием реакционноспособного галогенида. При этом, конечно, количество магния должно быть эквивалентно смеси галогенидов. Таким способом можно вводить в реакцию даже такой пассивный галогенид, как пентаметилбромбензол. Добавляемый при этом второй реагент выбирают так, чтобы продукты последующего превращения смеси реактивов Гриньяра легко разделялись. Чаще всего в качестве сопутствующего галогенида используют этилбромид или пропилбромид. Аналогичная активация может достигаться прибавлением к смеси эфира, магния и органического галогенида небольшого количества полученного ранее реактива Гриньяра.
Побочная реакция при получении реактивов Гриньяра представлена взаимодействием образующегося магнийорганического соединения с исходным галогенидом по аналогии с реакцией Вюрца:
![]()
Скорость этой реакции определяется реакционной способностью галогенида. В соответствии с этим, как отмечалось выше, превращение по представленной схеме достаточно значимо для реакций с алкилиодидами. Доля этой реакции снижается при проведении взаимодействия в мягких условиях и в разбавленных растворах.
Ещё одна побочная реакция представлена дегидрогалогенированием алкилгалогенидов с образованием олефинов. Чаще всего эта реакция протекает при взаимодействии магния с третичными алкилгалогенидами.
Не всегда удаётся получать реактивы Гриньяра из соединений, содержащих более одного атома галогена. Если атомы галогенов разделены двумя или тремя атомами углерода (как, например, в 1,2-дибромэтане или 1,3‑дибромпропане) то их взаимодействие с магнием протекает преимущественно с образованием бромида магния. В то же время метилендибромид и метилендииодид с хорошим выходом могут быть превращены в соответствующие метиленбис(магнийгалогениды). Реакция магния с галогенидами, в которых атомы галогенов разделены четырьмя и более атомами углерода, часто сопровождается реакцией гомосочетания, когда, например, из 1,5-дибромпентана образуется заметное количество декаметиленбис(магнийбромида). Определённый интерес представляют реакции магния с дигалогенидами с разной реакционной способностью атомов галогенов. В частности, соединения общей формулы Cl(CH2)nBr реагируют с магнием в тетрагидрофуране с образованием ω-хлоралкилмагнийбромидов.
С хорошим выходом из соответствующих дибромбензолов в тетрагидрофуране образуются м- и п-фениленбис(магнийбромиды). В реакцию с магнием в тетрагидрофуране вступают также пергалогенированные ароматические соединения. Так, например, из пентафторбромбензола можно получить пентафторфенилмагнийбромид, а из гексахлорбензола пентахлорфенилмагнийхлорид:

При температурах от –65 до –35 °С можно получать реактивы Гриньяра из перфторалкилгалогенидов и магния или амальгамы магния.
Взаимодействие хлорметиловых эфиров с магнием протекает преимущественно с элиминированием этилена:
![]()
Однако при низких температурах образующиеся в качестве промежуточных продуктов в этом превращении реактивы Гриньяра могут быть использованы в обычных для этих соединений реакциях.
Магнийорганические соединения могут вступать в реакции с реакционноспособными органическими галогенидами с образованием С‑С‑связей по типу реакции Вюрца–Фиттига. Так, например, фенилмагнийбромид реагирует с аллилхлоридом с образованием аллилбензола:
![]()
При обработке образующейся при этом реакционной массы следует принимать во внимание, что аллилбензол в присутствии оснований претерпевает аллильную перегруппировку и превращается в 1‑пропенилбензол.
По схеме гетеросочетания реактивы Гриньяра реагируют и с другими органическими галогенидами с активными атомами галогена (например, с α‑хлорзамещёнными простыми эфирами).
Менее реакционноспособные алкилгалогениды взаимодействуют с реактивами Гриньяра с образованием смесей регио- и стереоизомеров с очень низкими выходами. Часто при этом действие реактива Гриньяра сопровождается дегидрогалогенированием с образованием алкена из алкилгалогенида и алкана из алкилмагнийгалогенида. В этом случае магнийорганическое соединение выступает в роли основания, отрывая протон в вицинальном положении по отношению к несущему атом галогена атому углерода.
Заметное различие в реакционной способности магний- и литий- органических соединений демонстрируется в реакциях гетеросочетания с такими третичными галогенидами, как третбутилбромид. Литийорганическое соединение, представляющее собой сильное основание, реагирует с третбутилбромидом с отщеплением бромистого водорода, тогда как реактив Гриньяра реагирует с этим галогенидом, замещая атом брома по механизму SN1:
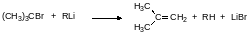

Магнийорганические соединения, полученные из третичных алкилгалогенидов или арилгалогенидов, реагируют с бромидом серебра, хлоридом или бромидом меди(II) по схеме реакции Вюрца, например, по реакции:
![]()
Много внимания уделяется реакциям гетеросочетания реактивов Гриньяра с алкинильными, алкенильными и арильными галогенидами. Выходы в этих реакциях могут быть значительно повышены добавлением таких катализаторов, как соли меди, серебра, железа или никеля в стехиометрическом или в каталитическом количестве. В качестве примера можно привести реакцию (S)-(4-метилциклогексилиден)-бромметана с метилмагнийбромидом:

В присутствии никелевых и кобальтовых катализаторов эта реакция протекает с сохранением хиральности, тогда как катализаторы с ионами серебра приводят к полной рацемизации продукта реакции.
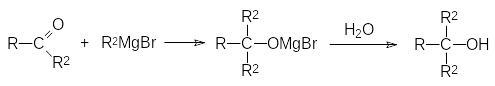
И всё же основная область применения магнийорганических соединений представлена реакциями с образованием С–С-связей в результате их присоединения к карбонильным группам в составе альдегидов, кетонов или сложных эфиров, а также в результате присоединения к иминам, нитрилам и диоксиду углерода.
Взаимодействие реактива Гриньяра с карбонильной группой представляет собой восстановительный процесс, поскольку образование новой С–С-связи приводит к превращению карбонильной группы в спиртовую:

Если в этой реакции R1 означает атом водорода, то продуктом реакции становится вторичный спирт, а взаимодействие с реактивом Гриньяра кетона (R1 означает органический остаток) приводит к третичному спирту.
Литийорганические соединения реагируют с кетонами так же, как и магнийорганические соединения. Однако они более реакционноспособны, что позволяет использовать их в тех случаях, когда реактивы Гриньяра с кетонами не реагируют. В соответствии с этим реакции по карбонильным группам стерически затруднённых кетонов лучше проводить с литийорганическими соединениями. Так, например, для получения триизопропилкарбинола проводят взаимодействие диизопропилкетона с изопропиллитием:
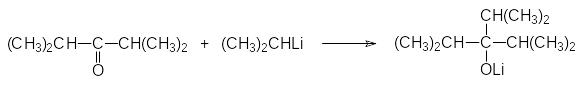
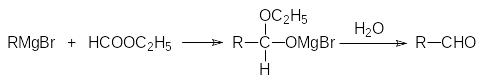
Действие реактивов Гриньяра на сложные эфиры (в приведенном выше общем уравнении R означает алкоксильную группу) также приводит к образованию третичных спиртов, поскольку образующиеся в результате первичного присоединения магнийорганического соединения аддукты разлагаются на алкоголят и кетон:
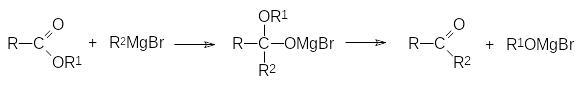
На первой стадии реакцию можно остановить только с эфирами муравьиной кислоты. В соответствии с этим гидролиз продуктов присоединения реактивов Гриньяра к формиатам приводит к альдегидам:
Гладко реагируют с реактивами Гриньяра ортоэфиры карбоновых кислот:

Образующиеся при этом кетали можно перевести в кетоны действием водных растворов сильных кислот.
Взаимодействие реактивов Гриньяра с триэтилортоформиатом можно использовать для получения альдегидов. Так, например, из полученного на основе 2-бромтиофена магнийорганического соединения и триэтилортоформиата получают 2‑формилтиофен:

С низкой скоростью идёт взаимодействие реактивов Гриньяра с нитрилами. При длительном кипячении в эфире или при нагревании в растворителях с более высокой температурой кипения в этой реакции образуются соли кетиминов, гидролиз которых приводит к кетонам:
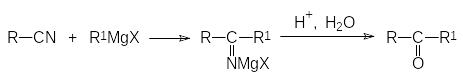
При пониженных температурах и при интенсивном перемешивании проводят реакцию реактивов Гриньяра с диоксидом углерода, протекающую с образованием солей соответствующих карбоновых кислот:
![]()
Поддерживая температуру от 10 до –10 °С, при перемешивании пропускают диоксид углерода над эфирным раствором реактива Гриньяра. Такой способ введения в реакцию диоксида углерода нужен для того, чтобы осадок образующей соли карбоновой кислоты не забивал трубку для подачи СО2. Можно также приливать раствор магнийорганического соединения к измельченной твёрдой углекислоте. Для протекания реакции с некоторыми магнийорганическими соединениями, полученными из третичных галогенидов, требуется повышенное давление СО2.
Реактивы Гриньяра присоединяются также к кратным связям с участием других гетероатомов, например, к С=S-связям в тиоэфирах или к кратным СN‑связям в иминах или в карбодиимидах.
Реактивы Гриньяра реагируют с алкиленоксидами с раскрытием оксиранового цикла, например, по схеме:
![]()
В результате реакции с этиленоксидом образуется первичный спирт, с увеличенной на две метиленовых группы углеводородной цепью. При взаимодействии с замещёнными оксиранами органический остаток в составе реактива Гриньяра присоединяется к наименее стерически затрудненному атому углерода:
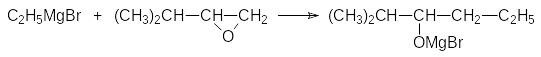
По аналогичной схеме реагируют с магнийорганическими соединениями оксетаны. При этом продуктами реакции становятся спирты с углеводородной цепью, удлиненной на три атома углерода:
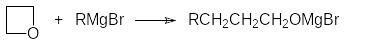
Прибавление реактива Гриньяра к раствору оксетана в эфире сопровождается незначительным разогреванием реакционной массы и для завершения реакции её нагревают ещё около 1 часа.
При работе с большими загрузками следует соблюдать осторожность при разложении реакционной массы с продуктами превращения реактивов Гриньяра, поскольку даже небольшие количества непрореагировавших магнийорганических соединений при взаимодействии с водой или растворами кислот вызывают интенсивное кипение растворителя. Прибавляя раствор кислоты к реакционной массе с образовавшимся алкоголятом, следует принимать во внимание, что первые порции водного раствора кислоты полностью реагируют с ним с образованием спирта, галогенида и гидроксида магния. Это означает, что практически весь экзотермический эффект реакции разложения реализуется в самом начале переработки реакционной массы. Желательно проводить разложение реакционной массы, образовавшейся из реактива Гриньяра и карбонильного соединения или оксирана, выливая её небольшими порциями в интенсивно перемешиваемую смесь разбавленной соляной или серной кислоты со льдом. Если реакционная масса содержит соединения, чувствительные к действию кислот, разложение проводят раствором хлорида аммония.
Общая картина превращений, протекающих с использованием реактивов Гриньяра, представлена схемой, в которой в качестве исходного соединения используется метилмагнийбромид:

В отдельных случаях стерически затрудненные карбонильные соединения или стерически затрудненные реактивы Гриньяра реагируют с образованием енольных производных. Чаще всего енолизация при действии стерически затрудненных магнийорганических соединений протекает с СН-кислотами, представленными β-дикарбонильными соединениями:
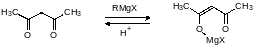
В некоторых случаях реактивы Гриньяра с атомами водорода в β‑положении восстанавливают карбонильные соединения вместо того, чтобы присоединяться по двойной связи:

Взаимодействие алкильных магнийорганических соединений с α,β‑ненасыщенными карбонильными соединениями протекает обычно с образованием смеси продуктов 1,2- и 1,4-присоединения, например:
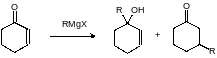
В реакции циклогексен-3-она с этилмагнийбромидом 3-гидрокси-3-этилциклогексен (продукт 1,2-присоединения) образуется с выходом 52 %, выход продукта 1,4-присоединения (3-этилциклогексанона) составляет 24 %, а третбутилмагнийхлорид реагирует с циклогексен-3-оном только по схеме 1,4‑присоединения с образованием 3-третбутилциклогексанона с выходом до 70 %. В отличие от этого аллильные и ароматические магнийорганические соединения всегда реагируют с ненасыщенными кетонами по схеме 1,2‑присоединения. Энантиоселективное присоединение к кратным связям можно проводить в присутствии хиральных лигандов с третичными атомами азота.
Основность реактивов Гриньяра RMgX определяется также природой органического остатка. Так, например, этилмагнийхлорид имеет значение рКа 30,1, а фенилмагнийбромид соответственно 22,2. Этим определяется их способность депротонировать такие соединения, как вода, спирты и амины, превращаясь при этом в алканы (RH). В частности, протекающая с образованием метана реакция метилмагнийиодида с соединениями с активным (подвижным) атомом водорода использовалась ранее для количественного определения его содержания (метод Чугаева–Церевитинова, 1902-1907 гг.). Магнийорганические соединения сравнимы по основности с литийорганическими соединениями, но последние чаще используются в качестве сильных оснований.
В органическом синтезе определенное значение имеет упоминавшееся выше депротонирование ацетиленовых соединений реактивами Гриньяра (реакция Иоцича). Образующиеся при этом алкинильные магнийорганические соединения могут быть использованы, например, для получения важных в практическом отношении пропаргиловых спиртов по реакции с карбонильными соединениями, например, по реакции:

Катализируемая тетрахлоридом титана реакция олефинов с алкилгалогенидами магния, в алкильных группах которых есть атом водорода в β-положении, называется гидромагнезированием, поскольку формально она представляет собой присоединение “HMgX” по двойной связи:
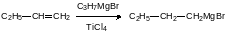
Область применения этой реакции, выход и региоселективность могут быть расширены и улучшены за счёт использования в качестве катализатора дихлорида титаноцена (Cp2TiCl2)
Реакция протекает через отличающийся очень высокой реакционной способностью Cp2TiClН, который образуется в результате переметаллирования Cp2TiCl2 в реакции с магнийорганическим соединением с последующим β-гидридным элиминированием. Гидрид титана региоселективно присоединяется к олефину и на завершающей стадии второй эквивалент реактива Гриньяра регенерирует гидридное соединение титана с образованием целевого продукта.
