
молекулярная-спектроскопия-часть-2
.pdf
ХАРАКТЕРИСТИКИ ЛЮМИНЕСЦЕНЦИИ (ФЛУОРЕСЦЕНЦИИ)
Квантовый выход φ
Энергетический выход φс люминесценции - |
люминесценции - это отношение |
|||||
это отношение энергии Еlm, излучаемой |
||||||
числа излученных квантов |
||||||
люминесцирующим веществом к энергии Еabc |
||||||
люминисценции Nlm к числу |
||||||
поглощенного света: |
||||||
квантов Nabc поглощенного |
||||||
|
|
|
||||
|
φс=Еlm/Еabc |
|
||||
|
|
возбуждающего излучения: |
||||
Энергетический выход характеризует |
|
φ=Nlm/Nabc |
|
|||
|
|
|
||||
эффективность преобразования поглощенной Чем больше квантовый выход, тем эффективнее световой Е в Е люминисцентного излучения. преобразование возбуждающего света в излучение
флуоресценции. Фотолюминесценция возникает за счет поглощаемой энергии возбуждающего света. Однако лишь часть ее превращается в энергию люминесценции. Эффективность этого процесса принято характеризовать выходом люминесценции.
ЗАКОН ВАВИЛОВА
КВАНТОВЫЙ ВЫХОД НЕ ЗАВИСИТ ОТ ДЛИНЫ ВОЛНЫ ВОЗБУЖДАЮЩЕГО СВЕТА
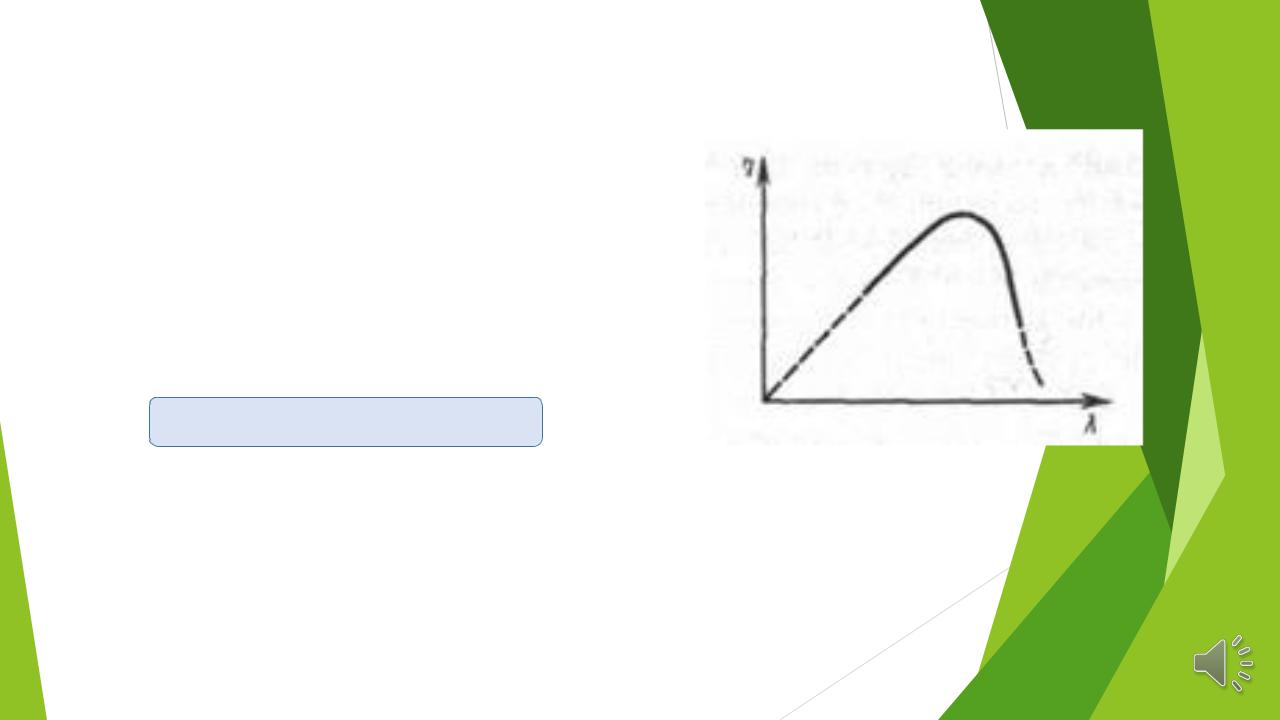
Закон Вавилова : квантовый выход флуоресценции постоянен, если длина волны возбуждающего света меньше длины волны флуоресценции:
φ=const, если λabs> λlm
Согласно закону Вавилова:
-квантовый выход постоянен при изменении в широких пределах длины волны возбуждающего света в стоксовской области;
-квантовый |
выход падает если длина волны возбуждающего света лежит в |
антистоксовой области. |
|

Флуориметрический метод анализа основан на возбуждении электронных спектров испускания молекул определяемого вещества внешним УФизлучением и измерении интенсивности их фотолюминесценции.
Метод основан на использовании прямой пропорциональной зависимости между интенсивностью люминесценции (флуоресценции) и концентрацией определяемого вещества в растворе:
Iфл=kc
Чем больше квантовый выход φ, тем больше коэффициент пропорциональности k и тем выше чувствительность флуоресцентного анализа.

|
УСЛОВИЯ ПРОВЕДЕНИЯ ФЛУОРИМЕТРИЧЕСКОГО АНАЛИЗА |
|
|
|
|
|||||||
1) |
Интервал длин волн возбуждающего излучения 250-800 нм. |
|
|
|
|
|
|
|||||
2) |
Анализируемый |
раствор |
должен |
быть сильно |
разбавленным |
(концентрация |
< 10 4 |
|||||
моль/л). |
|
|
|
|
|
|
|
|
|
|
|
|
Уменьшение |
интенсивности |
люминесценции |
при |
|
увеличении |
концентрации |
|
раствора |
||||
|
называется |
концентрационным |
тушением |
флуоресценции. |
С |
ростом |
концентрации |
|||||
увеличивается |
|
вероятность |
ассоциации |
молекул |
люминофора |
с |
образованием |
|||||
|
|
|
||||||||||
нелюминесцирующих агрегатов, что приводит к безызлучательным потерям энергии. Минимальная концентрация, при которой уже наблюдается концентрационное тушение флуоресценции, называется
пороговой концентрацией.
3) Температура во время измерений должна поддерживаться постоянной.
При повышении температуры наблюдается температурное тушение флуоресценции.
Выход флуоресценции уменьшается за счет возрастания колебательной энергии молекул, приводящего к увеличению доли безызлучательных переходов.

ФЛУОРЕСЦЕНЦИЯ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
К флуоресценции способны многие органические вещества (ПАУ, красители и т.д.) - система сопряжённых π-связей (возможность поглощать УФ-излучение);
-отсутствие вращения частей молекулы (кислородные мостики, полиароматические соединения); - электронодонорные заместители усиливают флуоресценцию, электроноакцепторные - тушат.
Фенолфталеин |
родамин 6Ж |
|
|
(окрашен, не |
|
флуоресцирует) |
|
хинин
1
3

СПЕКТРЫ ФЛУОРЕСЦЕНЦИИ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
1
4
ПРИМЕРЫ ЛЮМИНЕСЦЕНТНЫХ РЕАКЦИЙ
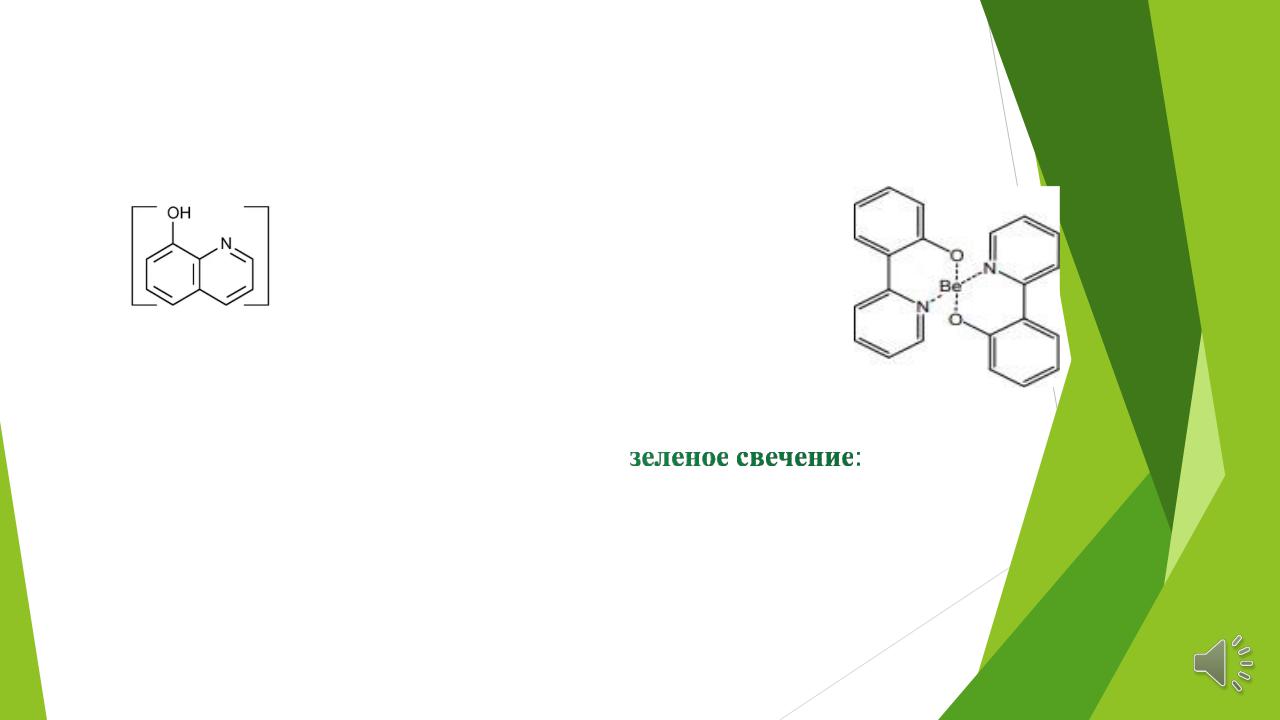
Для определения катионов Li+, Be2+, Mg2+, Al3+ проводят люминесцентные реакции этих катионов с 8-оксихинолином:
Be2+ + 2HR = BeR2 +2H+
8-оксихинолин
Катионы натрия Na+ можно определить реакцией с цинкуранилацетатом. Образующийся |
|||||||||||
продукт реакции - натрийцинкуранилацетат |
|
|
|
|
|||||||
NaBr + Zn(UO ) (CH COO) + CH COOH + 9H |
2 |
O → NaZn(UO ) (CH COO) .9H O + HBr |
|||||||||
2 3 |
3 |
8 |
|
3 |
|
|
2 3 |
3 |
9 |
2 |
|
Определение |
сероводорода |
|
основано на |
его |
|
||||||
|
поглощении щелочным |
||||||||||
|
раствором |
|
|
|
|
|
|
|
|
|
|
ртутьацетатфлуоресцеина |
и |
регистрации |
уменьшения интенсивности желто-зеленой |
||||||||
флуоресценции реагента за счет взаимодействия с сероводородом:
HgR2 + H2S=HgS + 2HR, KS(HgS) = 10-52

ХАРАКТЕРИСТИКИ ФЛУОРИМЕТРИЧЕСКОГО АНАЛИЗА
Высокая чувствительность (по сравнению с фотометрией).
Предел обнаружения определяемых веществ 10 8 мас.% (концентрации до
10 12-10 15 г/л).
-Погрешность флуориметрического анализа обычно составляет около 2-5%. -Относительно несложное аппаратурное оформление.
ПРИМЕНЕНИЕ
-Метод применяется при контроле качества фармпрепаратов (фолиевой кислоты, рибофлавина, флавоноидов и др.);
-флуориметрически определяют содержание катионов магния в сыворотке крови;
-определение фенолов в воде
-определение ПАУ;
-использование флуоресцентных индикаторов в титровании.


