
Учебники 80385
.pdfg g .. |
(5) |
При реконструктивных превращениях групповая подчинённость типа (4)
или (5) отсутствует, и кристаллические структуры реагента и продукта реакции связаны между собой только соотношением (3).
Далее мы рассмотрим каждый из трёх вариантов (3)-(5) по отдельности.
Реконструктивные превращения
Реконструктивные превращения, рассматриваемые здесь как переходы g g , подчиняющиеся соотношению (3) при отсутствии добавочного ограни-
чения (4) либо (5), могут быть двух видов: А) переход из гексагирной подгруп-
пы гексагональной голоэдрии 6/mmm в изометрическую подгруппу кубической голоэдрии m3m либо тетрагирную подгруппу тетрагональной голоэдрии
4/mmm; Б) переходмежду тетрагирной подгруппой тетрагональной голоэдрии и тригирной подгруппой гексагональной голоэдрии либо переход между прими-
тивной планальной группой и примитивной аксиальной группой.
Хорошо известно, что топохимическая реакция лимитируется образова-
нием и ростом ядер – зародышей продукта реакции. Так как молярные объёмы реагента и продукта реакции заведомо различны, рост ядер продукта реакции вызывает упругие напряжения в кристалле реагента. Отсутствие групповой подчинённости между структурами реагента и продукта реакции при рекон-
структивном превращении означает, что обусловленные этими напряжениями искажения кристаллической структуры реагента «не свойственны» его решётке.
Вследствие этого реакция реконструктивного типа протекает в две стадии.
На первой стадии формируется промежуточная решётка, обеспечивающая групповую соподчинённость симметрии структур реагента и продукта реакции и тем самым минимизирующая реакционные напряжения в кристалле реагента.
В случае А – эта промежуточная решётка имеет пониженную симметрию, в
случае Б – повышенную симметрию. Реакционные напряжения обладают из-
60

Химия, физика и механика материалов. Выпуск № 2 (25), 2020
быточной энергией Гиббса и потому способны ускорять реакцию на её второй стадии – в ходе релаксационной трансформации промежуточной решётки в ре-
шётку продукта реакции. Удельный вклад энергии реакционного напряжения тем больше, чем мельче кристаллы реагента. В монокристалле реакционные напряжения могут оказаться слишком слабыми, и тогда скорость топохимиче-
ской реакции быстро достигает максимума; реакция, едва начавшись, практиче-
ски сразу замедляется. Измельчение реагента повышает не только степень его конверсии, но и вероятность его последующего самодробления, дополнительно ускоряющего реакцию. При этом реакционные напряжения вызывают физиче-
ское (опережающее) самодробление: физический процесс развития трещин опережает химическую реакцию. Если же кристаллическая фаза имеет макро-
скопические несовершенства строения, то топохимическая реакция может из-
бирательно проникать в реагент вдоль межблочных границ, вызывая химиче-
ское (сопровождающее) самодробление.
В случае А группы Гесселя структур реагента и продукта реакции имеют общую неединичную подгруппу, соответствующую сохраняющимся в ходе ре-
акции признакам кристаллохимической общности обеих структур: тригональ-
ной симметрии (при переходах с участием кубических структур), осевой сим-
метрии (при переходе между одноосными структурами) и т. п.
В случае Б у структур реагента и продукта реакции такая общность от-
сутствует, т. к. у их групп Гесселя отсутствует общая неединичная подгруппа.
По этой причине такие превращения протекают наиболее медленно, а их про-
межуточная ступень определяется общей надгруппой G. Соответственно, пер-
вая стадия реакционного процесса в случае Б – разупорядочение исходной кри-
сталлической структуры реагента, повышающее её симметрию до надгруппо-
вой. Если превращение соответствует переходу между ацентричной тригирной группой и тетрагирно-инверсионной группой, то G 43m; если же переход со-
вершается между примитивной планальной группой и примитивной гексагир-
ной группой, то G = 6mm. Для прочих переходов, соответствующих случаю Б,
G = m3m.
61
Возможны изохимические реконструктивные превращения – термоинду-
цированные структурные трансформации без изменения состава. В большин-
стве случаев нагрев, повышая интенсивность тепловых колебаний, оказывает разупорядочивающее действие, т. е. создаёт предпосылки для повышения сим-
метрии. В частности, именно такая термическая корреляция структур – повы-
шение симметрии кристаллической решётки при повышении температуры – свойственна топотактическим процессам (см. далее). В то же время, для про-
цессов реконструктивного типа характерно отсутствие термической корреляции структур. При этом реконструктивный механизм изохимического превращения наиболее вероятен тогда, когда кристаллическая решётка низкотемпературной модификации обладает псевдосимметрией и потому склонна к радикальной пе-
рестройке при термоиндуцированном разупорядочении её структурных единиц.
Мероэдрические реакции
Вариант (4) означает, что сопровождающий реакцию рекристаллизацион-
ный процесс приводит к мероэдрическому искажению структуры реагента, т. е.
понижению её симметрии в соотношении «группа-подгруппа». Понижение симметрии кристаллической структуры может быть не только результатом ре-
кристаллизации, но и следствием деформации кристалла [15]. Накладываясь на изменение симметрии структуры в ходе рекристаллизации, деформационная диссимметризация может способствовать топохимическому процессу либо по-
давлять его. Ввиду этого обстоятельства деформационная диссимметризация может существенно влиять на характер и результат рекристаллизационной пе-
рестройки твёрдой фазы реакционной смеси.
В идеальном случае (реагент – монокристаллический) деформационные напряжения легко создать анизотропным механическим воздействием. Другими словами, ходом топохимической реакции можно управлять, деформируя моно-
кристалл реагента. Близкая по своей сущности идея была высказана в работе
[16] в связи с обнаружением зависимости скорости химической коррозии от
62

Химия, физика и механика материалов. Выпуск № 2 (25), 2020
знака деформации. Этот эффект, обусловленный неоднородностью поверхност-
ной энергии пластины вследствие её деформации (растяжение выпуклой сторо-
ны и сжатие вогнутой стороны), является топохимическим аналогом известного в материаловедении феномена концентрации напряжений. Более общий топо-
химический эффект деформационной диссимметризации структуры наиболее наглядно проявится при изохимических превращениях. Структурное превраще-
ние мероэдрического типа можно индуцировать анизотропным деформацион-
ным воздействием с адекватной симметрией – сдвиговой деформацией, изгибом или кручением. При этом для топотактических превращений будет иметь место обратный эффект – подавление рекристаллизационного процесса (см. далее).
Обычно твёрдая фаза реакционной смеси находится в поликристалличе-
ском состоянии, а деформационное воздействие на неё является изотропным
(барическим). В таких условиях эффект деформационной диссимметризации сводится к тому, что барическое воздействие, подавляя подвижность структур-
ных единиц, уменьшает вариативность их позиций, т. е. усиливает влияние кри-
сталлохимических барьеров. В результате создаются предпочтительные усло-
вия для кристаллической фазы с более вероятным типом структуры.
Топотактические реакции
Соотношение (5), критеризующее топотактические реакции, означает, что при таких реакциях релаксация реакционных напряжений обеспечивается коге-
рентностью структуры растущего кристалла продукта реакции относительно кристаллической решётки исходного вещества. Вследствие этого продукт топо-
тактической реакции закономерно ориентирован относительно реагента.
Упомянутая ориентация будет кристаллографически регулярной по от-
ношению к реагенту, если группа g соответствует средней кристаллографиче-
ской категории, т. е. если структура реагента одноосна. Примерами таких топо-
тактических реакций могут служить дегидратация портландита Ca(OH)2 (пере-
63

ход 3m m3m), образование гематита Fe2O3 при разложении ильменита
FeTiO3 (переход 3 3m) и т. д.
Если же группа g соответствует высшей кристаллографической катего-
рии (т. е. в структуре реагента нет единичных направлений) либо низшей кри-
сталлографической категории (в структуре реагента несколько единичных направлений), то продукт реакции может иметь несколько различных ориента-
ций по отношению к реагенту. В частности, такая ориентационная неоднознач-
ность наблюдается при формировании орторомбической структуры форстерита в ходе дегидратации моноклинного хризотила.
Изоморфность структур реагента и продукта топотактической реакции благоприятствует её протеканию. В то же время, чем сильнее выражена меро-
эдричность структуры реагента по отношению к структуре продукта, тем боль-
ше затруднена топотактическая реакция. Как следствие, имеют место две зако-
номерности.
Во-первых, топотактическое превращение в монокристалле можно пода-
вить внешним деформационным воздействием с адекватной симметрией – сдвиговой деформацией, изгибом или кручением. Такое подавление способна обеспечить, например, сдвиговая деформация монокристалла бадделеита ZrO2,
который в отсутствие деформирующего воздействия испытывает при нагрева-
нии до температуры 1150 °С переход в модификацию со структурой искажён-
ного флюорита.
Во-вторых, чем сильнее выражена мероэдричность структуры реагента по отношению к структуре продукта топотактической реакции, тем выше вероят-
ность её протекания с промежуточными изохимическими (полиморфными)
превращениями. Классический пример процесса с таким ступенчатым течением
– дегидратация кристаллогидратов [17].
Руководствуясь вышесказанным, можно прогнозировать ступенчатость дегидратационной трансформации датолита CaBSiO4OH (пр. гр. P21/c) в ока-
ямалит Ca2B2SiO7 (пр. гр. P421m). Датолиту, как и другим водным боросилика-
64

Химия, физика и механика материалов. Выпуск № 2 (25), 2020
там кальция, свойственен полиморфизм. Имеются также указания [18] на суще-
ствование полиморфной модификации у окаямалита. Однако если сам факт по-
лиморфного перехода в окаямалите при температуре 550 °С установлен вполне убедительно, то предварительные данные о структуре его высокотемпе-
ратурной модификации нуждаются в уточнении. В самом деле, согласно [18],
при полиморфном превращении окаямалита дифракционная картина изменяет-
ся незначительно, т. е. топология боросиликатного слоя в его структуре прак-
тически не изменяется. В отсутствие радикальной перестройки атомных груп-
пировок переход в высокотемпературную структурную модификацию должен сопровождаться повышением симметрии структуры. Между тем, по предполо-
жению [18], структуре высокотемпературной модификации окаямалита соот-
ветствует пр.гр. P21212, что не может не вызывать сомнения.
Магнитохимическая рекристаллизация
Отдельного обсуждения заслуживает топохимическая рекристаллизация карбоната кальция, индуцируемая магнитным полем.
Хорошо известно, что при нагревании природной («жёсткой») воды до температуры 50-55 °С растворённый в ней гидрокарбонат кальция начинает разлагаться:
Ca(HСO3)2 = CaСO3 + CO2 + H2O. |
(6) |
Кристаллизующийся при этом карбонат кальция образует накипь, созда-
ющую серьёзные технические трудности. Однако если подвергнуть нагревае-
мую воду омагничиванию, то выделяющийся в ходе реакции (6) карбонат каль-
ция кристаллизуется не в форме кальцита (пр. гр. R3с), образующего плотную трудноудаляемую накипь на поверхностях, а в форме арагонита (пр. гр. Pnma),
остающегося во взвешенном состоянии либо образующего легкоудаляемые от-
ложения [19]. Об отчётливо выраженном ослаблении накипеобразования в маг-
65

нитном поле многократно сообщалось по результатам опытов, различавшихся исходными характеристиками обрабатываемой воды и в ещё большей степени различавшихся временны́ м режимом обработки, гидродинамическими особен-
ностями конструкции аппаратуры и т. п. (см. обзоры [20], [21]). Такая незави-
симость противонакипного эффекта магнетизации воды от немагнитных факто-
ров указывает на наличие у этого явления фундаментальных предпосылок.
Проанализируем их.
Протекание кристаллизации карбоната кальция в водном растворе суще-
ственно зависит от температуры. Для оценки её влияния нами был проведён расчёт констант скорости реакций образования обеих модификаций карбоната кальция. Результаты этого расчёта, выполненного с использованием данных
[22], представлены на рисунке 1.
Рис. 1. Температурная зависимость констант скорости реакций образования карбоната кальция: а – арагонит, с – кальцит
66
Химия, физика и механика материалов. Выпуск № 2 (25), 2020
Хорошо видно, что константа скорости реакции образования арагонита существенно превосходит константу скорости реакции образования кальцита.
Благодаря этому достаточно инициировать магнитным полем выделение CaСO3
в форме арагонита, после чего при дальнейшем нагреве воды воздействие маг-
нитного поля не обязательно. Ввиду отсутствия у структур арагонита и кальци-
та топохимического сходства кристаллизация кальцита на зародышах арагонита невозможна, вследствие чего при повышении температуры процесс образова-
ния арагонитовой модификации необратим.
При стандартном давлении в широком диапазоне температур, включаю-
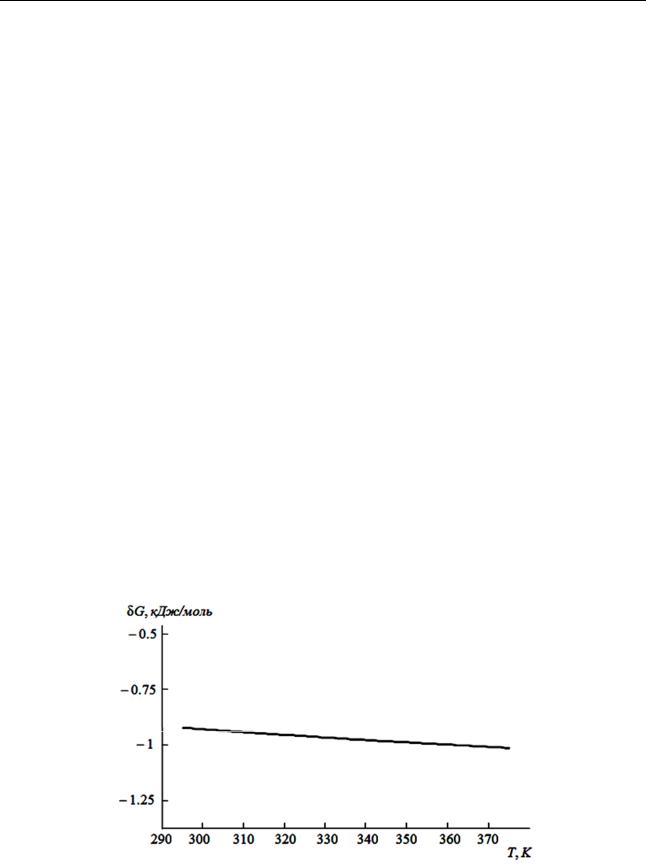
щем интересующий нас интервал 273 K < T < 373 K, термодинамически устой-
чивой фазой CaСO3 является кальцит: Gc < Ga, где Gc – молярная энергия Гиббса образования кальцита, Ga – молярная энергия Гиббса образования ара-
гонита. Проведённый нами по справочным данным [22] расчёт показал (см. ри-
сунок 2), что запрещающая образование арагонита отрицательная величина
G = Gc – Ga с ростом температуры возрастает по модулю, что усугубляет термодинамический запрет на кристаллизацию арагонита вместо кальцита при нагревании воды в обычных условиях.
Рис. 2. Температурная зависимость разности молярных энергий Гиббса образования модификаций карбоната кальция
67

Однако абсолютная величина G весьма мала ( 1 кДж/моль), а её возрас-
тание по мере нагрева воды выражено очень слабо. К тому же, арагонит обла-
дает более высоким кристаллохимическим приоритетом, поскольку Pnma: R3с
= 49.36: 1. Благодаря этому вышеупомянутый запрет образования арагонита легко снимается воздействием магнитного поля, причём величина необходимой для этого напряжённости поля h 5 кЭ (что соответствует магнитной индукции
0.5Тл) не требует температурной корректировки [23].
Для противонакипной обработки воды её омагничивание должно произ-
водиться одновременно с нагревом до температуры 50-55 °С. Тем самым обеспечивается формирование кристаллизационных зародышей арагонитовой модификации, что, в свою очередь, задаёт нужное направление кристаллизаци-
онного процесса, необратимого при дальнейшем нагреве. Противонакипный эффект в воде, обработанной в указанном температурно-магнитном режиме, бу-
дет сохраняться в течение промежутка времени, необходимого для растворения зародышей арагонитовой фазы, образовавшихся в ходе омагничивания воды.
Вышесказанное относится к первичному противонакипному эффекту – подавлению образования кальцитовой накипи путём омагничивания воды.
Наряду с этим, возможен также вторичный противонакипный эффект – удале-
ние уже существующей кальцитовой накипи под действием магнитного поля.
Вторичный эффект обусловлен двумя факторами. Во-первых, раствори-
мость арагонита в воде существенно больше растворимости кальцита [21]. Во-
вторых, растворимость карбонатов повышается с ростом парциального давле-
ния углекислого газа в растворе [24].
Рост парциального давления углекислого газа, образующегося в результа-
те разложения гидрокарбоната кальция, интенсифицирует переход «кальцито-
вых» ионов Са2+ в раствор. При h ≠ 0 указанные ионы будут формировать ара-
гонитовую фазу, выделение которой обеспечивается не только повышенным кристаллохимическим приоритетом её структуры, но и значительно более вы-
сокой, нежели у кальцита, растворимостью, т. е. существенно меньшей склон-
ностью арагонита к пересыщению раствора. В результате магнитное поле ин-
68
Химия, физика и механика материалов. Выпуск № 2 (25), 2020
дуцирует рекристаллизационную трансформацию присутствующего в реакци-
онной системе кальцита в арагонит. Внешне это проявляется как удаление уже существующей накипи.
Важно подчеркнуть, что такое удаление требует непрерывного воздей-
ствия магнитного поля. Это принципиально отличает вторичный противона-
кипный эффект от первичного, для которого достаточно инициирующего омаг-
ничивания воды в начале её прогрева (до температуры 50-55 °С). Другое принципиальное различие между первичным и вторичный эффектами – рабо-
чий интервал температур: омагничивание горячей воды (свыше 55-60 °С) целе-
сообразно только с точки зрения вторичного противонакипного эффекта.
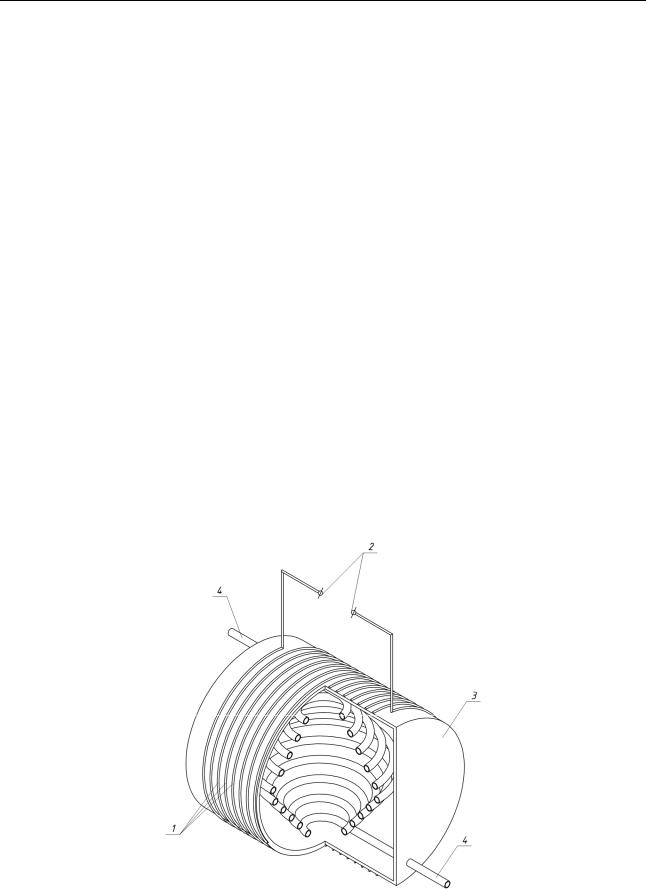
Конструктивная схема устройства для реализации вышеописанных маг-
нитохимических эффектов представлена на рисунке 3. Токовая обмотка 1, под-
ключаемая к источнику постоянного напряжения при помощи зажимов 2, рас-
полагается на внешней поверхности корпуса 3, во внутреннем пространстве ко-
торого находится змеевик 4 для пропускания воды в магнитном поле соленои-
дальной обмотки.
Рис. 3. Принципиальная конструктивная схема устройства для магнитоиндуцированной рекристаллизации карбоната кальция в воде
69
