
- •Методические указания
- •2. Лабораторная работа №2
- •3. Лабораторная работа №3
- •4. Лабораторная работа №4
- •Лабораторная работа №1. Исследование диссоциации карбонатов
- •1.1. Цель работы
- •1.3. Дополнительные задания
- •1.4. Контрольные вопросы
- •Лабораторная работа №2 исследование кинетики изотермического окисления металлов
- •2.1. Цель работы.
- •2.2. Методика измерения, аппаратура и порядок выполнении работы
- •2.3. Контрольные вопросы
- •Лабораторная работа №3
- •3.2. Методика измерения, аппаратура и порядок выполнения работы
- •Лабораторная работа №4 оценкаокислительно-восстановительных свойств газовой фазы
- •4.1. Цель работы
- •4.2. Теоретические основы
- •4.3. Расчетные задания
- •4.4. Контрольные вопросы
- •394026 Воронеж, Московский просп., 14
ФГБОУ ВПО «Воронежский государственный
технический университет»
Кафедра материаловедения и физики металлов
Методические указания
к лабораторным работам по курсу
«Теория металлургических процессов»
для студентов направления 150400.62 «Металлургия»,
профиля «Технология литейных процессов»
очной формы обучения
Воронеж 2014
Составитель канд. техн. наук Т.И. Сушко
УДК 541.1 (07)
Методические указания к лабораторным работам по курсу «Теория металлургических процессов» для студентов направления 150400.62 «Металлургия», профиля «Технология литейных процессов» очной формы обучения / ФГБОУ ВПО «Воронежский государственный технический университет»; сост. Т.И. Сушко. Воронеж, 2014. 48 с.
Методические указания содержат теоретический и практический материал для самостоятельной подготовки к выполнению лабораторных работ по курсу «Теория металлургических процессов». Предназначены для студентов третьего курса.
Методические указания подготовлены в электронном виде в текстовом редакторе MS Word и содержится в файле «Теория металлургических процессов.doc».
Табл. 5. Ил. 9. Библиогр.: 4 назв.
Рецензент канд. физ.-мат. наук, доц. А.В. Миленин
Ответственный за выпуск зав. кафедрой канд. физ.-мат. наук, доц. Д.Г. Жиляков
Издается по решению редакционно-издательского совета Воронежского государственного технического университета
© ФГБОУ ВПО «Воронежский государственный технический университет», 2014.
СОДЕРЖАНИЕ
1. Лабораторная работа №1
Исследование диссоциации карбонатов 2
2. Лабораторная работа №2
Исследование кинетики изотермического окисления
металлов 16
3. Лабораторная работа №3
Определение энергии активации гетерогенных
реакций 28
4. Лабораторная работа №4
Оценка окислительно – восстановительных свойств
газовой фазы 41
БИБЛИОГРАФИЧЕСКИЙ СПИСОК 48
Лабораторная работа №1. Исследование диссоциации карбонатов
1.1. Цель работы
Исследование температурной зависимости равновесного давления углекислого газа СО2 при диссоциации карбоната кальция СаСО3;.
Диссоциация твердых карбонатов, оксидов и сульфидов широко используется в металлургических процессов. Она заключается в том, что при нагреве до определенных температур – обжиге – сложные соединения разлагаются и при этом образуется типа
АВ(тв) ↔ А(тв) + В(газ) , (1.1)
где АВ может быть карбонатом, окислом или сульфидом; А - металлом или оксидом; В – двуокисью углерода, кислородом, серой и др.
Рассмотрим вначале наиболее простой случай отсутствия растворов между твердыми веществами АВ и А. Для диссоциации карбонатов это означает, что и образующийся окисел и исходный карбонат представляют собой самостоятельные чистые фразы, общее число которых, включая и газообразную, равно трем:
МеСО(тв) ↔ МеО(тв) + СО(газ) , (1.2)
Система двухкомпонентных – три вещества и одно уравнение реакции. К числу внешних факторов, определяющих равновесие реакции (1.2), относятся температура и давление. В соответствии с правилом фаз Гиббса данная система моноварианта:
j = к + n – f = 2 + 2 – 3 = 1 , (1.3)
где j – число степеней свободы; к – число компонентов; n – число внешних факторов; f – число фаз. Для однокомпонентной системы (К=1) правило фаз записывается в виде:
С = 3-f (1.4)
f = 2, то С = 1 , система моновариантная, что означает равновесное давление двуокиси углерода зависит только от температуры:
РСО2 = φ(Т) (1.5)
Вид данной функции можно получить из константы равновесия реакции (1.2)
РСО2 · аМео
К = (1.6)
аМеСО3
где аМео и аМеСО3 - активности окисла и карбоната соответственно.
Активности чистых твердых веществ примерно равны единице, и практически К = РСО2 .
Равновесное парциальное давление двуокиси углерода РСО2 (в дальнейшем будет означать Р) в реакции диссоциации (или образования) углекислого соединения называется упругостью диссоциации карбоната. При отсутствии растворов она является функцией только температуры и эквивалента константе равновесия.
Как известно из курса физической химии, для оценки сравнительной прочности различных соединений используется стандартное изменение изобарно-изотермического потенциала (энергии Гиббса), который однозначно связан с константой равновесия реакции образования соединений из более простых веществ:
∆G0 = - RTlnP . (1.7)
Таким образом, упругость диссоциации Р, так же, как и убыль изобарно-изотермического потенциала, может служить мерой сравнительной прочности карбонатов. Чем больше │∆G0│, как следует из уравнения (1.7), чем меньше Р, тем прочнее карбонат.
Вид функции Р = φ(Т) можно найти путем интегрирования изобары реакции (1.2)
![]() , (1.8)
, (1.8)
где ∆Н - изменение энтальпии; R – универсальная газовая постоянная.
В свою очередь изменение энтальпии находят по уровненю
![]() , (1.9)
, (1.9)
где ∆Н0 - постоянная интегрирования, а ∆СР - изменение изобарной теплоемкости системы, обусловленное протеканием реакции. Для нахождения ∆СР теплоемкости компонентов записывает в форме
Ср = а + вТ + сТ2 , (1.10)
где а, в и с – табличные константы; Т – температура, и подставляют в уравнение
∆С = ССаО + ССО2 – ССаСО3 . (1.11)
Учитывается, что К = Р, и подставляя (1.9) в (1.8), после интегрирования получаем:
![]() ,(1.12)
,(1.12)
где ∆а, ∆в и ∆с - константы, которые находят из уравнения (1.11)
Для небольших температурных интервалов можно принять, что ∆Н = const , и тогда из уравнения (1.8) получаем:
![]() ,
(1.13)
,
(1.13)
Которое обычно записывают в форме
![]() ,
(1.14)
,
(1.14)
где М и N – числовые коэффициенты, устанавливаемые из опытных данных для определенного температурного интервала.
Уравнение (1.14) показывает, что Р представляет собой возрастающую экспоненциальную функцию температуры (рис. 1.1). По заданным Р и Т можно с помощью данного графика определить, находится система в равновесии или является неравновесной. В последнем случае можно выяснить, по которую сторону от равновесия находится система и насколько она удалена от него, в каком направлении пойдет в системе исследуемый процесс и при каких условиях будет достигнуто равновесие.

Рис. 1.1. График для определения направления реакции образования или диссоциации карбонатов: а – при любом парциальном давлении СО2 в газе; б – то же, при постоянном давлении РФ
О направлении процесса (1.2) судят по знаку изменения изобарно-изотермического потенциала ∆G в уравнении изотермы реакции (уравнение Вант-Гоффа), которое применительно к чистому карбонату приобретает вид:
∆G = RT(lnPФ – lnP) , (1.15)
где Р – равновесное парциальное давление CO2 над карбонатами, а PФ - фактическое парциальное давление CO2 в среде, окружающей окисел и карбонат.
Между и Рφ и Р возможны следующие соотношения:
1. PФ > P , т.е. в системе имеется избыток CO2 в сравнении с равновесной концентрацией. При этом ∆G > 0, и реакция (1.2) может идти только в сторону образования карбоната.
2. PФ < P , фактическое давление CO2 меньше равновесного. В данном случае ∆G < 0, и процесс может идти в сторону диссоциации карбоната.
3. При PФ = P система находится в равновесии.
Сказанное иллюстрирует рис. 1.1а. Точки, лежащие на кривой, относятся к равновесной системе и характеризуют упругость диссоциации карбоната, которая возрастает с повышением температуры.
Кривая Р(Т) делит поле диаграммы на две области I и II, в которых процесс (1.2) может идти только в обратном и только в прямом направлении соответственно. Например, если система описывается фигуративной точкой а (рис.1.1 а), то в ней может идти только процесс образования карбонатов.
Часто возникает необходимость определять направление процесса в газовой фазе постоянного состава, например, в атмосфере воздуха. Пусть имеется воздушная среда, для которой парциальное давление СО2 постоянно РФ = соnst (рис. 1.1б). Из рисунка видно, что равновесие системы (РФ = Р) осуществимо только при одной температуре ТР. При Т < ТР (например, Т1) процесс идет в сторону образования карбонатов, при Т > ТР - в сторону диссоциации карбонатов. ТР называют температурой начала разложения карбонатов в газовой фазе о постоянным давлением СО2. Она тем выше, чем больше Рф.
Кроме температуры на давление диссоциации карбоната влияет степень дисперсности конденсированных фаз. Это связано с тем, что энергетические состояния частиц вещества (для карбонатов его ионы Ме2+ и СО32-), расположенных на внешней поверхности фазы и внутри нее, неодинаковы. Первые падвержены несимметричным межчастичным силам притяжения, вследствие чего у них возникает избыточная поверхностная энергия по сравнению с той, которой обладают вторые:
![]() пов >
об
, (1.16)
пов >
об
, (1.16)
где - среднее значение изобарно-изотермического потенциала (свободной энергии) объемных (об.) и поверхностны (пов.) частиц.
Общая величина свободной анергии для определенной массы вещества, содержащей nоб частиц в объеме и nпов - на поверхности, складывается и Gоб = nоб об и Gпов = nпов пов :
G = Gоб + Gпов (1.17)
С повышением степени дисперсности величина изабарного потенциала системы возрастает, так как при этом увеличивается доля частиц, расположенных на поверхности. Легко сообразить, что чем нише степень дисперсности, тем больше активность твердого вещества, и ее нельзя принимать за единицу. Из уравнения (1.6) следует, что
аМеСО3
РСО2 = К (1.18)
аМеО
Поскольку константа равновесия однозначно определяется температурой, то при Т = соnst и К = соnst. Отсюда при постоянной температуре увеличение степени дисперсности карбоната, а значит, и возрастание аMеСО3, ведет к росту упругости диссоциации, а повышение дисперсности окисла и аМеО - к ее уменьшению.
При наличии взаимной растворимости веществ АВ и А реакция диссоциации может быть записана в виде
(А,АВ)(тв.р-р) ↔ (А ,АВ)' (тв.р- р) + В(газ) , (1.19)
при этом следует различать два варианта:
1. А и АВ обладают неограниченной взаимной растворимостью.
2. А и АВ растворимы друг в друге ограниченно.
В равновесном состоянии появляются еще два переменных параметра - концентрации А и АВ в твердом растворе (АВ + А). Двухкомпонентная двухфазная система (1.19) в соответствии с правилом фаз имеет две степени свободы, то есть является бивариантной. Это значит, что для четырех переменных параметров, определяющих равновесное состояние системы, Т, Рв, ХА, ХАВ, должна существовать два уравнения связи
![]() , (1.20)
, (1.20)
ХА+ХАВ = 1 , (1.21)
где ХА и ХАВ - мольные доли соответственно компонентов А и АВ. Поскольку константа равновесия является функцией только температуры, то из (1.20) и (1.21) следует, что равновесное давление РВ данном случае зависит не только от температуры, но и от состава твердого раствора:
![]() , (1.22)
, (1.22)
при ХА→ 0, РВ→∞, при ХА → 1, РВ → 0.
Таким образом, при неограниченной взаимной растворимости и равно изменяется во всем, интервале концентрации от 0 до как угодно больших величин.
Нетрудно понять, что при ограниченной раствори мости А и АВ в А достижение предела растворимости лишает систему одной степени свободы, так как появляется еще одна фаза и Р становится функцией только температуры (рис. 1.2).
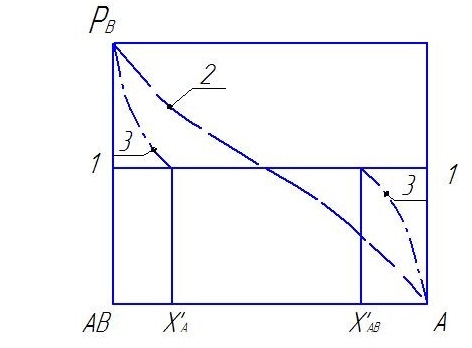
Рис. 1.2. РВ = φ(ХА) 1-1 - система без фаз переменного состава (моновариантности); 2 -- система с неограниченной взаимной растворимостью АВ и А; 3 - система с ограниченной растворимостью А и АВ ( в пределах от Х'А , до Х'АВ)
В настоящей работе измеряется равновесное давление циссоциации карбоната кальция. Принято считать, что в практике металлургического производства при температурах доменного процесса эта реакция протекает без образования твердого раствора (СаСО3; и СаО) и поэтому может быть представлена для термодинiамического анализа в виде
СаСО3(Тв) ↔ СаО(тв) + СО2(газ) , (1.23)
при этом термодинамически устойчивой модификацией карбоната при высоких температурах является кальцит.
Для решения уравнения (1.8) можно использовать следующие данные:
СРСО2 = 7,0 + 7,1· 10-3 Т – 1,86 · 10-6Т2 , (1.24)
СРСаСО2 = 14,75 + 18,2 · 10-3Т , (1.25)
СРСаО = 11,05 + 1,1 · 10-3Т , (1.26)
∆Н298 = 42520 кал , (1.27)
∆G0 = - RTlnPCO2 = 0 при Т = 908 ± 60 С , (1.28)
Что приводит к выражению
lnPCO2
= - ![]() + 1,66lgT – 1,09 ·
10-3Т +
+ 1,66lgT – 1,09 ·
10-3Т +
+ 6,8 · 10-8Т2 + 5,69 (ат). (1.29)
Часто для расчета значений РСО2 применяют и более простые эмпирические уравнения, например
lnPCO2
= - ![]() + 7,85 . (1.30)
+ 7,85 . (1.30)
Данные некоторых расчетов по уравнениям (1.29) и (1.30), а также значения теплоты реакции приведены в табл. 1.1.
Таблица 1.1
Упругость диссоциации СаСО3 как функция температуры
Т,К |
lgPСО3 (ат) по уравнениям |
∆Н, кал |
|
(1.25) |
(1.26) |
||
900 |
-3,67 |
-3,50 |
41337 |
1000 |
-2,66 |
-2,55 |
40887 |
1100 |
-1,56 |
-1,40 |
40371 |
1200 |
0,11 |
0,11 |
39797 |
1300 |
0,68 |
0,70 |
39157 |
1400 |
1,15 |
1,21 |
38467 |
1.2. Методика измерения, аппаратура и порядок выполнения работы
На рис. 1.3. приведена схема установки.
В извлеченную из трубчатой печи 1 запаянную с одного конца реакционную кварцевую трубку 2 засыпают с помощью воронки навеску (0,5 г) измельченного карбоната кальция 3. Затем с помощью резинового шланга 4 соединяют эту трубку через манометр 5 с насосом Комовского 6.
Откачав реакционное пространство до предельного по манометру разряжения, краном 7 отключают трубку 2 от насоса.

Рис. 1.3. Схема экспериментальной установки: 1 - печь; 2 - реакционная трубка, 3 - карбонат, 4 - резиновый шланг; 5 - манометр; 6 - насос, 7 - кран; 8 - терморегулятор
Включают печь 1 и вводят в нее реакционную трубку 2 так, чтобы запаянный конец трубки с карбонатом оказался посередине печи в изотермической зоне, температура которой измеряется с точностью ±20 °С и поддерживается постоянной с помощью термометра 8.
Для трех-четырех заданных преподавателем значений температуры при достижении постоянства последней определяют с помощью манометра 5 давление в системе, которое и соответствует равновесному давлению диссоциации РСО2 .
Для заданных температур по уравнению (1.30) рассчитывают значения раиновесного давления РСО2 . Рассчитанные и опытные значения величины РСО2, представляют в табл. 1.2.
Таблица 1.2
Зависимость РСО2 от температуры
Т,К
|
РСО2 , ат
|
|
Расчетное
|
Опытное
|
|
По табличным данным строят графики в координатах РСО2 - Т (Р в ат., Т в градусах абсолютной шкалы), получая дне кривые - расчетную и опытную.
В выводах по работе отмечают характер влияния температуры на упругость диссоциации карбоната, указывают, как велико расхождение опытных данных с расчетными.
