
- •Методические указания
- •150104.65 «Литейное производство черных и цветных металлов», направления 150400.62 «Металлургия» (профиль «Технология литейных процессов»)
- •Практическое занятие №1 кристаллическое строение металлов
- •Структура реальных кристаллов
- •Пластическая деформация. Механические свойства. Рекристаллизация
- •Основы теории сплавов
- •Диаграмма состояния сплавов системы железо-углерод
- •Методические указания
- •150104.65 «Литейное производство черных и цветных металлов», направления 150400.62 «Металлургия» (профиль «Технология литейных процессов»)
- •394026 Воронеж, Московский просп., 14
ФГБОУ ВПО «Воронежский государственный
технический университет»
Кафедра материаловедения и физики металлов
Методические указания
к проведению практических занятий по дисциплине «Материаловедение» для студентов специальности
150104.65 «Литейное производство черных и цветных металлов», направления 150400.62 «Металлургия» (профиль «Технология литейных процессов»)
очной формы обучения
Воронеж 2013
Составители: ст. преп. В.А. Юрьева, ст. преп. О.В. Горожанкина
УДК 620.26
Методические указания к проведению практических занятий по дисциплине «Материаловедение» для студентов специальности 150104.65 «Литейное производство черных и цветных металлов», направления 150400.62 «Металлургия» (профиль «Технология литейных процессов») очной формы обучения / ФГБОУ ВПО «Воронежский государственный технический университет»; сост. В.А. Юрьева, О.В. Горожанкина. Воронеж, 2013. 50 с.
Методические указания содержат теоретические сведения по теме занятия, контрольные вопросы для оценки полноты освоения изучаемого раздела курса, перечень рекомендуемой литературы. Теоретические сведения, представленные в методических указаниях, позволяют студенту самостоятельно выполнить весь объем заданий, подготовиться к ответам на контрольные вопросы.
Методические указания подготовлены в электронном виде в текстовом редакторе MS Word 2003 и содержатся в файле практика ЛП.doc
Табл. 3. Ил. 24. Библиогр.: 3 назв.
Рецензент д-р физ.-мат. наук, проф. Ю.Е. Калинин
Ответственный за выпуск зав. кафедрой д-р физ.-мат. наук, проф. А.Т. Косилов
Издается по решению редакционно-издательского совета Воронежского государственного технического университета
© ФГБОУ ВПО «Воронежский государственный
технический университет», 2013
Практическое занятие №1 кристаллическое строение металлов
Краткие теоретические сведения
Все кристаллы по характеру превалирующей связи между элементарными частицами подразделяют на молекулярные, ковалентные, металлические и ионные.
Молекулярные кристаллы – это кристаллы, в которых преобладает связь Ван-дер-Ваальса. Силы Ван-дер-Ваальса невелики и не имеют направленного характера.
В ковалентных кристаллах атомы, вступая во взаимодействие друг с другом, обобществляют свои валентные электроны с соседними атомами, достраивая тем самым свою валентную оболочку. Ковалентная связь характеризуется направленностью, что приводит к низкой пластичности, но высокой твердости. Ковалентные кристаллы – полупроводники и даже диэлектрики. Температурный коэффициент электросопротивления у ковалентных кристаллов имеет отрицательное значение.
В ионных кристаллах при сближении атомов и перекрытии валентных энергетических зон между элементами происходит перераспределение электронов. Электроположительный элемент теряет валентные электроны, превращаясь в положительный ион, а электроотрицательный – приобретает его, достраивая тем самым свою валентную зону до устойчивой конфигурации. Ионная связь –направленная, что приводит к высокой твердости и отсутствию пластичности.
В металлическом кристалле валентные энергетические зоны атомов перекрываются, образуя общую зону со свободными подуровнями. Это дает возможность валентным электронам свободно перемещаться в пределах этой зоны от атома к атому. Происходит обобществление валентных электронов в объеме всего кристалла. Металлическая связь ненаправленная.
Металлы в твердом состоянии обладают рядом характерных свойств:
-высокими теплопроводностью и электрической проводимостью,
-положительным температурным коэффициентом электрического сопротивления,
-термоэлектронной эмиссией, т.е. способностью испускать электроны при нагреве,
-хорошей отражательной способностью: металлы непрозрачны и обладают металлическим блеском,
-повышенной способностью к пластической деформации.
Наличие этих свойств характеризует металлическое состояние вещества.
Все металлы и металлические сплавы – тела кристаллические, атомы (ионы) расположены в металлах закономерно, образуя правильную кристаллическую решетку, в отличие от аморфных тел, в которых атомы расположены хаотично.
Большинство металлов образует одну из следующих высокосимметричных решеток с плотной упаковкой атомов: кубическую объемно центрированную, кубическую гранецентрированную и гексагональную (рис.1.1)
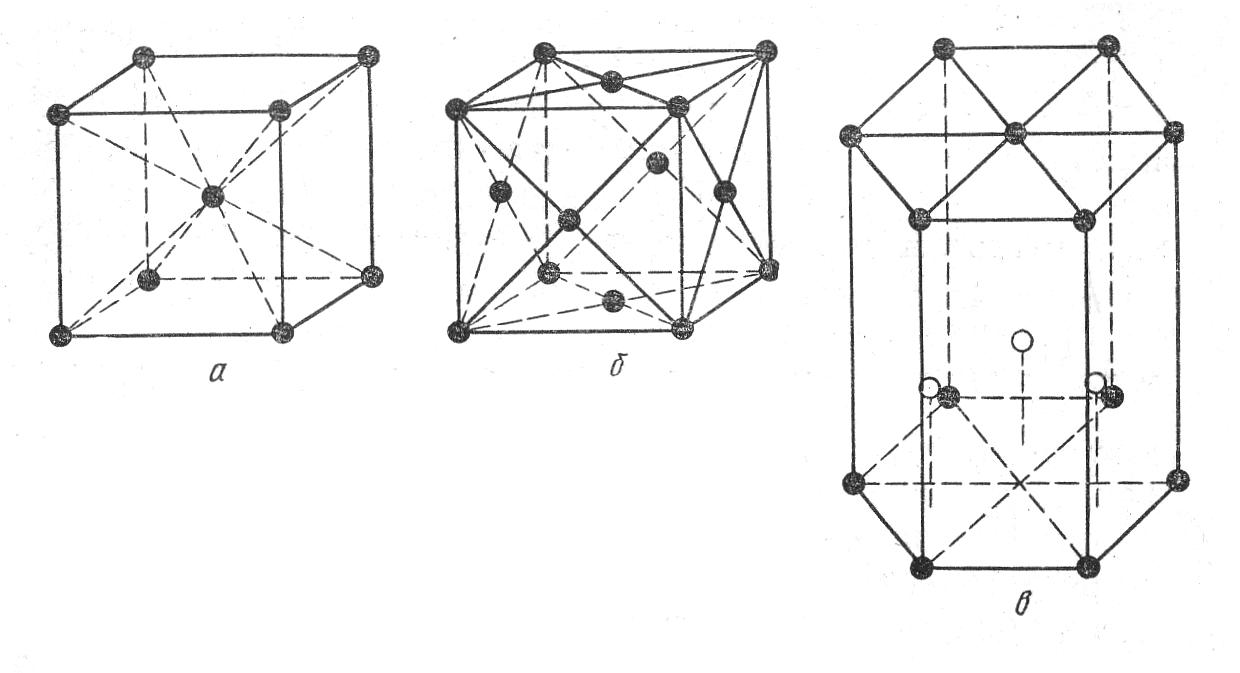
Рис.1.1. Элементарные ячейки плотноупакованных кристаллических решеток: а - объемноцентрированная кубическая; б - гранецентрированная кубическая; в – плотноупакованная гексагональная
Координационное число (КЧ) - количество атомов, находящихся на наиболее близком и одинаковом расстоянии от любого произвольно выбранного атома в решетке.
Число структурных единиц (nя ) - количество атомов каждого элемента, приходящихся на одну элементарную ячейку.
При определении числа структурных единиц следует учитывать положение каждого атома в элементарной ячейке. Атомы могут занимать одно из четырех положений: в вершине элементарной ячейки, на ребре ячейки, на ее грани или внутри элементарной ячейки. Лишь в последнем случае атом целиком принадлежит данной ячейке. Так, атом, расположенный на грани элементарной ячейки, принадлежит в равной мере двум ячейкам, и поэтому на каждую из ячеек приходится лишь по половине атома.
Атом на ребре элементарной ячейки, где стыкуются четыре ячейки, одновременно входит во все четыре ячейки, причем на каждую из ячеек приходится в среднем по четверти атома. И, наконец, от каждого вершинного атома на одну элементарную ячейку придется по тем же соображениям по одной восьмой части, поскольку в каждой вершине стыкуются восемь элементарных ячеек, имеющих форму параллелепипедов.
Таким образом, при определении числа структурных единиц необходимо учитывать не только число атомов данного элемента, но и долю их участия с помощью того или иного долевого коэффициента:
1/8 - для вершинных атомов,
1/4 - для атомов на ребрах элементарной ячейки,
1/2 - для атомов на гранях элементарной ячейки,
1 - для атомов, расположенных внутри элементарной ячейки.
Коэффициент компактности решетки () определяется отношением объема, занимаемого атомами с условно сферической формой, ко всему объему ячейки.
При решении задач необходимо иметь систему обозначений для записи ориентации граней и плоскостей кристалла, а также ребер и направлений. Чтобы определить индексы Миллера для плоскости необходимо выполнить следующие действия: установить систему координат, найти отрезки, отсекаемые плоскостью на осях координат x,y и z, измеренные в осевых единицах, взять обратные значения этих чисел и привести эти значения к целым числам. Полученные числа h, k, l записывают в круглых скобках –(hkl).
При индицировании направлений, одну точку прямой помещают в начало координат, а другую получают путем последовательного векторного сложения 3-х перемещений, параллельных трем осям координат. Так, если точка смещается на u осевых единиц вдоль оси х, v осевых единиц вдоль оси y и w единиц вдоль оси z, то эти три взаимно простые числа u, v, w , помещенные в квадратные скобки, и будут индексами направления - [uvw].
Задачи и вопросы по теме
1.Чем объясняется высокая электропроводность и пластичность металлов?
2.Что характеризует прочность связи между атомами в кристаллическом теле: температура плавления, ионизационный потенциал или теплота сублимации?
3. Что характеризует координационное число решетки?
4. Чему равно координационное число ОЦК решетки?
5. Чему равно координационное число ГЦК решетки?
6. Чему равно координационное число ГПУ решетки?
7. Чему равно координационное число решетки алмаза
(рис. 1.2)?
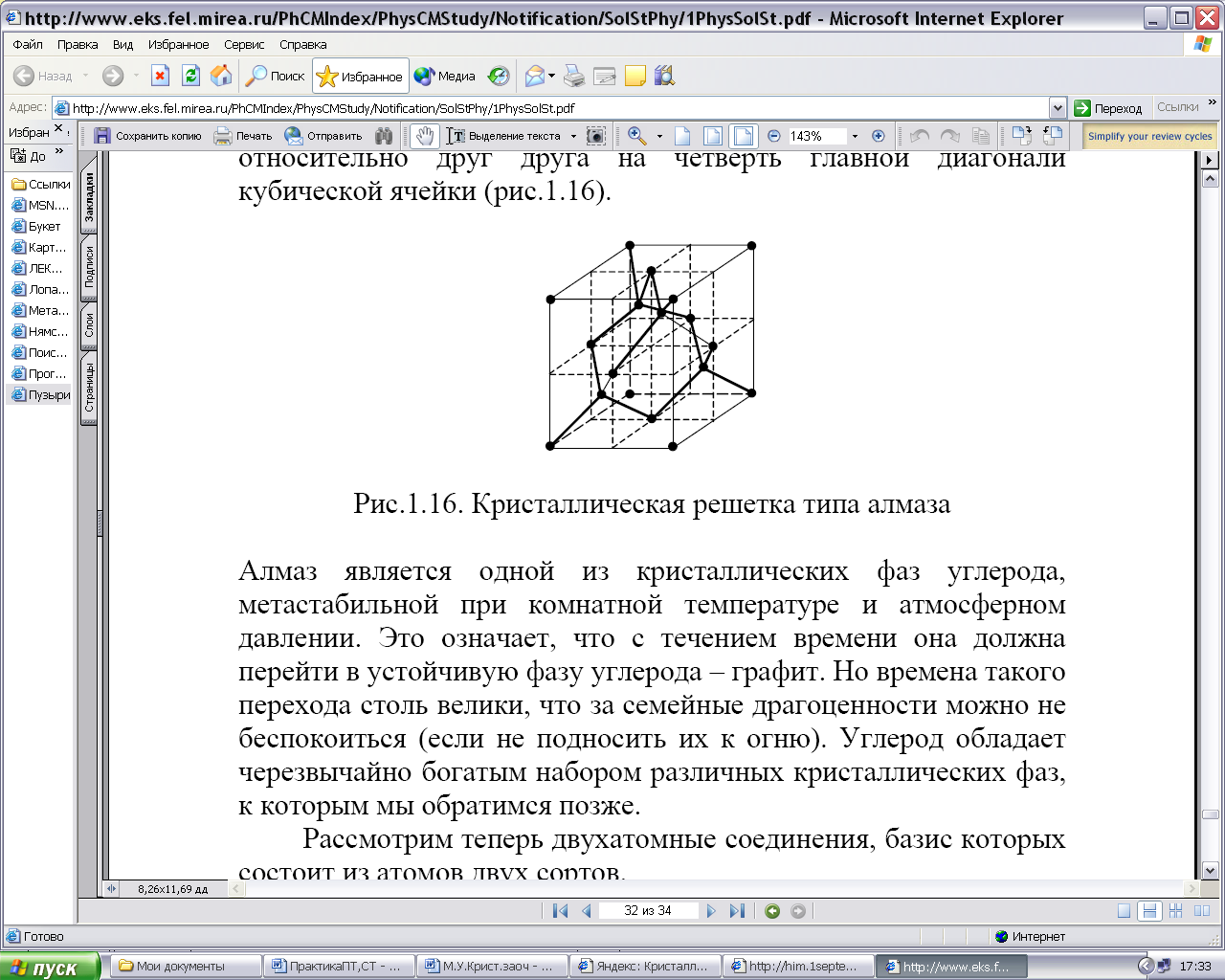
Рис.1.2. Структура алмаза
8. Чему равно координационное число простой кубической решетки?
9. Определить число атомов nя, принадлежащих ОЦК ячейке.
10. Определить число атомов nя, принадлежащих ГЦК ячейке.
11. Определить число атомов nя, принадлежащих простой кубической ячейке.
12. Определить число атомов nя, принадлежащих ячейке алмаза (рис.1.2).
13. Какая зависимость между величиной отсекаемых отрезков и индексами Миллера?
14. Какие координатные отрезки отсекают грани со следующими символами: (423), (021), (2 03), (310), (100) ,(001).
15. Изобразить кристаллографические направления [010], [112], [103], [221], [321].
16. Изобразить в пределах кубической элементарной ячейки кристаллографические плоскости (01 0). (111), (230), (112), (301).
17. Каковы индексы плоскостей и направлений в кубической решетке (рис.1.3)?
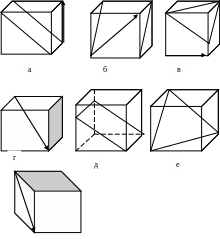
ж
ж
Рис.1.3. Индицирование кристаллографических плоскостей и направлений
ПРАКТИЧЕСКОЕ ЗАНЯТИЕ №2
