
- •Методические указания
- •1. Свойства и поведение веществ в раздробленном (дисперсном) состоянии Общие положения
- •1.1. Количественные характеристики веществ в раздробленном состоянии
- •1.2. Поверхностное натяжение воды и материалов
- •1.3. Свойства дисперсных материалов
- •1.4. Особенности горения пылей и порошков
- •1.5. Примеры решения задач
- •1.6. Задачи
- •1.7. Контрольные вопросы
- •2. Основные параметры пожара
- •2.1. Общие положения
- •2.2. Примеры решения задач
- •2.3. Задачи
- •2.4. Контрольные вопросы
- •Методические указания
- •Фгбоу впо «Воронежский государственный
- •394026 Воронеж, Московский просп., 14
1.3. Свойства дисперсных материалов
Дисперсность (удельная поверхность) является самостоятельным термодинамическим параметром состояния системы, изменение которого вызывает соответствующие изменения различных ее свойств. Реакционная способность вещества определяется величиной энергии Гиббса. Она характеризует способность вещества перейти в другое состояние, вступить в химическую реакцию. Для дисперсных материалов реакционная способность связана с уровнем их раздробленности выражением:
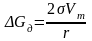 ,
(1.8)
,
(1.8)
где
 −
приращение энергии Гиббса при переходе
вещества в дисперсное состояние, Дж;
−
приращение энергии Гиббса при переходе
вещества в дисперсное состояние, Дж;
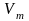 − мольный объем вещества, м3/моль;
r
− радиус частиц дисперсной фазы.
− мольный объем вещества, м3/моль;
r
− радиус частиц дисперсной фазы.
Эта зависимость показывает, что с уменьшением размера частиц их реакционная способность возрастает, а, значит, происходит интенсификация химических взаимодействий, в том числе реакций горения. При достаточно высокой степени диспергирования горючей жидкости, в частности, до состояния тумана кинетика процессов горения может стать вообще дезактивационной, и, следовательно, может носить взрывной характер. Повышение реакционной способности некоторых диспергированных металлов может сопровождаться их горением даже в бескислородной среде, например, в атмосфере азота, что естественно следует принимать во внимание при прогнозировании возникновения и развития пожара с участием дисперсных систем.
Уровень дисперсности может повлиять также на равновесие химической реакции горения. Эта связь характеризуется выражением, учитывающим константы прямой и обратной реакций:
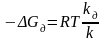 ,
(1.9)
,
(1.9)
где kд, k − константы равновесия реакции с участием веществ в диспергированном и недиспергированном состояниях, соответственно.
С увеличением дисперсности возрастает активность компонентов реакции, а отсюда в зависимости от уровня дисперсности исходных веществ и продуктов может измениться константа равновесия процесса и даже его направление.
Важная зависимость для прогнозирования развития пожара связана с влиянием уровня дисперсности на температуру фазовых переходов вещества (плавления, испарения). При уменьшении размера частиц температура плавление снижается. Это следует из термодинамических соотношений и выражается формулой:
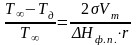 , (1.10)
, (1.10)
где
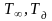 − температура фазового перехода
(плавления) в недиспергированном и
диспергированном состоянии, соответственно;
ΔНф.п.
− энтальпия (теплота) фазового перехода.
− температура фазового перехода
(плавления) в недиспергированном и
диспергированном состоянии, соответственно;
ΔНф.п.
− энтальпия (теплота) фазового перехода.
Понижение температуры плавления с увеличением дисперсности тем больше, чем выше ее значение в недиспергированном состоянии. Следует сказать, что некоторые металлы с низкой температурой плавления после диспергирования в нормальных условиях будут находиться в жидком агрегатном состоянии. В связи с этим их поведение на пожаре будет отличаться.
В диспергированных системах самопроизвольно идут процессы, направленные на уменьшение удельной поверхности вещества: изменяется форма частиц дисперсной фазы (например, стремление капель жидкости, расплава, пузырьков газа принять сферическую форму); происходит укрупнение капель эмульсии или пузырьков газа в пенах, слипание частиц в порошках.
Замедление этих процессов является актуальным, например, для решения вопросов повышения устойчивости противопожарных пен или стабилизации гранулометрического состава порошковых огнетушащих веществ. Уменьшение свободной энергии системы может происходить за счет снижения величины поверхностного натяжения. Основным путем его интенсификации на практике является введение в систему поверхностно-активных веществ (ПАВ).
Способность ПАВ снижать поверхностное натяжение растворов оценивается по величине их поверхностной активности g:
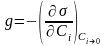 (1.11)
(1.11)
Это уравнение свидетельствует о том, что чем сильнее уменьшается поверхностное натяжение с увеличением концентрации ПАВ в системе Сi, тем больше его поверхностная активность.
Для гомологического ряда предельных жирных кислот, являющихся наиболее распространенными ПАВами, известно эмпирическое правило Дюкло−Траубе:
Поверхностная активность возрастает в 3.0−3.6 раза при удлинении углеводородной цепи молекулы ПАВ на каждую СН2−группу.
Таким образом, с ростом углеводородной цепи в арифметической прогрессии поверхностная активность ПАВ увеличивается в геометрической прогрессии.
